谷胱甘肽过氧化酶4 激动剂Fer-1 对睡眠碎片化的老年小鼠术后认知功能障碍防治作用观察
周银,侍崇龙,金文杰
南京医科大学第一附属医院麻醉科,南京 210029
近年来,术后认知功能障碍(Postoperative cognitive dysfunction,POCD)的发病率逐年上升,已成为老年人及危重症患者术后中枢神经系统的常见并发症之一[1]。POCD是围术期神经认知障碍(Perioperative neurocognitive disorders, PND)的一种[2],主要临床表现为进行性记忆障碍和认知能力下降,可伴有定向障碍、情绪失调或睡眠障碍[3]。睡眠碎片化(Sleep fragment, SF)与学习记忆、言语表达、注意力、处理速度和执行功能的损害有关。SF 可以促进神经退行性病变的发展[4],但其是否导致围术期POCD 的发生目前尚无研究。线粒体稳态失衡可激活机体的氧化应激,导致中枢的炎症反应[5]。一方面,线粒体呼吸链产生的能量可满足细胞生理功能所需;另一方面,线粒体氧化磷酸化和三羧酸循环阶段可产生活性氧簇(Reactive oxygen species, ROS)。谷胱甘肽过氧化物酶4(GPX4)是一种膜锚定糖蛋白,主要存在于海马区、小脑区和下丘脑等区域,可清除应激反应产生的H2O2、OH-及各种巯基,减轻过度应激反应导致的中枢神经系统的炎症反应[6-7]。研究[11]发现,阿尔兹海默病(AD)、帕金森病(PD)患者的大脑认知区域GPX4 活性降低,导致ROS 不能被有效清除,且可影响线粒体ATP 生成。SF 是否通过影响海马组织GPX4 及线粒体呼吸链功能相关指标,导致POCD 的发生发展,目前相关研究较少。2022年2月—2023年3月,我们观察了GPX4激动剂Ferrostatin-1(Fer-1)对睡眠碎片化老年雄性小鼠POCD 的防治作用,并探讨其可能作用机制,现将结果报告如下。
1 材料与方法
1.1 动物、试剂及仪器老年雄性SPF级C57BL/6小鼠(18 月龄,30 g 左右)36 只,购于维通利华公司,放置在标准实验室条件中饲养[(25 ± 2)℃,12 h 昼夜循环光照,相对湿度50%~60%],自由饮水摄食,小鼠适应性饲养1 周后进行后续实验。所有动物实验均经南京医科大学实验动物福利伦理审查委员会许可(批准号:IACUC-2008037)。线粒体呼吸链复合物Ⅰ(Complex Ⅰ)活性试剂盒(南京建成生物工程研究所);鱼藤酮(Rotenone)、抗霉素A(Antimycin A)均购自美国Sigma-Aldrich 公司; GPX4 兔多克隆抗体(杭州华安生物技术有限公司)、β-actin 抗体、BCA 试剂盒、RIPA 缓冲液(上海碧云天公司);Fer-1蛋白酶抑制剂和磷酸酶抑制剂(Roche 公司,瑞士);线粒体Mito SOX™ 荧光探针(赛默飞世尔科技有限公司); DAPI 染液(美国Abcam 公司);超速离心机(美国贝克曼公司); Seahorse XF24海马细胞能量代谢分析仪(美国安捷伦公司)。
1.2 睡眠碎片化的小鼠POCD发生情况观察
1.2.1 小鼠分组、睡眠碎片化干预及胫骨骨折加髓内固定术(Tibial fracture surgery,TFS)方法 取24只小鼠随机分为实验组、对照组,每组12只,实验组小鼠予连续3 天多平台水环境睡眠碎片化处理,对照组小鼠不做特殊处理,正常饲养。第4 天时两组小鼠均行TFS(常用POCD 动物模型制备方法)。术后两组小鼠均正常饲养。
1.2.2 两组小鼠POCD 发生情况观察 术后第3天取两组小鼠,采用逃避恐惧实验和Y-maze 迷宫实验(Y 迷宫)评估小鼠的逃避恐惧能力和短期记忆能力(代表小鼠POCD 发生情况)。①逃避恐惧实验用来评估小鼠海马记忆能力:TFS 术前首先进行适应性训练,将小鼠放入TFC 仪器中自由探索100 s,然后给予小鼠听觉刺激20 s(80 db,5 kHz),后立即给予足底电击(0.8 mA),重复2 次,中间间隔100 s。刺激结束后30 min 行TFS 手术,术后第3 天通过视频跟踪软件(Xeye Fcs, 北京天鸣鸿远科技发展有限公司)自动记录小鼠300 s内除呼吸以外没有任何运动的僵直反应时间。②Y 迷宫用来评估小鼠学习记忆和空间认知能力。Y 迷宫由三个辐射式迷路箱和一个控制仪器组成。Y 迷宫有三个等长,角度互为120°的臂,将小鼠从起始臂面壁放入,先自由活动10 min,取消挡板,在3 个臂中自由活动5 min, 记录5 min 内每只小鼠的新颖臂穿梭次数。实验重复3次,取平均值。
1.2.3 两组小鼠海马组织GPX4检测 术后第3天处死两组小鼠,取海马组织。采用WESTERN Blotting 法检测小鼠海马组织 GPX4。取海马组织,匀浆后置于冰上保存30 min,4 ℃、12 000 r/ min 离心15 min,取上清液进行蛋白定量, 电泳分离、转膜、封闭、孵育抗体,采用增强化学发光试剂盒显影蛋白条带,以β-actin 为内参,测算GPX4 蛋白。重复测算3次,取平均值。
1.2.4 两组小鼠脑组织线粒体呼吸链功能检测采用SeahorseXF24细胞能量代谢仪检测脑组织线粒体呼吸链功能。取获取海马、前额皮质、小脑组织,提取完整线粒体,在EP 加入500 μL 的MHSE 溶液,机械垂直上下研磨20 次,于800 g 离心10 min,取上清液,再12 000 g 离心10 min,弃上清。加入400 μL的MAS 溶液,充分吹匀,取10 μL 液体,BCA 法测蛋白含量,加入MAS液调整至600 μg/mL,上样至检测板,30 μg/50 μL 孔,对照孔加入50 μL 的MAS。2 000 g 离心20 min,充分使线粒体覆盖底层。在校正板依次加入ADP、Olyomycin、FCCP、Rotenone&antimycin A 等激发或抑制呼吸链功能试剂,置换含线粒体板至XF24 检测线粒体功能,测算线粒体基础呼吸率、ADP 激发呼吸率及最大呼吸率,实验重复测算3次,取平均值。
1.2.5 两组海马组织线粒体能量代谢指标Complex Ⅰ及ROS 检测 ①采用ELISA 法检测海马组织Complex Ⅰ活性。取海马组织,参照ComplexⅠ活性测试试剂盒的说明书操作,以空白孔调零,450 nm 波长依次测量各孔的光密度(OD 值),以OD值代表Complex Ⅰ活性。所有操作均严格按照说明书进行,实验重复测算3次,取平均值。②利用线粒体荧光探针Mito SOX 测算海马组织线粒体ROS。按照说明书的实验步骤,将海马组织神经元以 5×105/mL 接种于 96 孔板,PBS 洗去培养基。培养1天后吸出培养基,加入浓度5 μmol/L 的Mito SOX 工作液2 mL,在37 ℃避光条件下孵育15 min,用荧光光度计测算荧光强度,代表海马组织ROS 含量。重复测算3次,取平均值。
1.3 加入Fer-1 对睡眠碎片化老年小鼠POCD 的防治作用观察 另取12 只老年雄性小鼠分为1、2 组,每组各6 只。两组均进行连续3 天多平台水环境睡眠碎片化。1 组小鼠睡眠碎片化处理的同时每天腹腔注射10 mg/kg 的Fer-1,1 次/天,连续3 次;2 组腹腔注射同体积的生理盐水,1 次/天,连续3 次。第4天两组均行TFS手术,TFS术后第3天采用逃避恐惧实验测试和Y-maze实验观察两组小鼠POCD发生情况,处死两组小鼠取海马组织,利用线粒体荧光探针Mito SOX 测算海马组织线粒体ROS。重复测算3次,取平均值。
1.4 统计学方法 采用IBM SPSS Statistics 25.0 统计软件行数据处理。采用Kruskal-Wallis 检验计量资料的正态性,符合正态分布的计量资料以-x±s表示,组间比较采用单因素方差分析、t检验;非正态分布的计量资料以M(P25,P75)表示,两组间比较采用秩和检验。P<0.05为差异具有统计学意义。
2 结果
2.1 术后第3 天实验组与对照组小鼠僵直反应时间、进入新颖臂百分比比较 术后第3 天实验组、对照组僵直反应时间分别为(112.00 ± 24.58)、(193.25 ± 20.02)s,进入新颖臂百分比分别为46.08% ± 7.39%、56.41% ± 8.81%,二者比较,P均<0.05。
2.2 实验组与对照组小鼠海马组织GPX4 相对表达量比较 术后第3 天实验组、对照组小鼠海马组织GPX4 相对表达量分别为0.44 ± 0.09、1.00 ±0.04,二者比较,P<0.01。
2.3 实验组与对照组小鼠脑组织线粒体基础呼吸率、ADP 激发呼吸率及最大呼吸率比较 术后第3天两组小鼠脑组织线粒体基础呼吸率、ADP 激发呼吸率及最大呼吸率见表1。由表1可见,与对照组比较,术后第3 天实验组小鼠脑组织线粒体体基础呼吸率、ADP 激发呼吸率及最大呼吸率低(P均<0.05)。
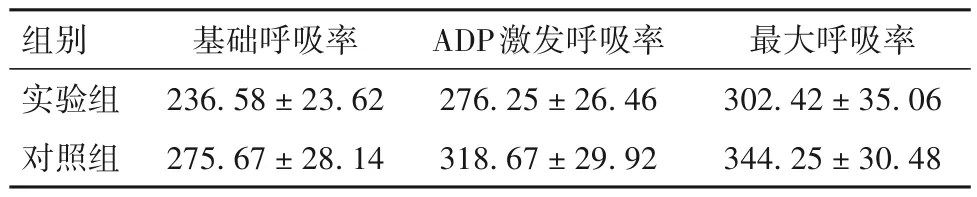
表1 术后第3天实验组与对照组小鼠脑组织线粒体基础呼吸率、ADP激发呼吸率及最大呼吸率(%,-x ± s)
2.4 实验组与对照组小鼠海马组织线粒体Complex Ⅰ活性和ROS 含量比较 术后第3 天实验组、对照组Complex Ⅰ活性分别为(112.00 ± 24.58)、(193.25 ± 20.02)s,ROS 相对表达量分别为1.56 ±0.27、1.00 ± 0.17。与对照组比较,术后第3 天实验组小鼠海马组织Complex Ⅰ活性低、ROS 含量高(P均<0.05)。
2.5 1 组和2 组小鼠僵直反应时间、进入新颖臂百分比及海马组织ROS 含量 结果见表2。由表2 可见,与2 组比较,术后第3 天1 组小鼠僵直反应时间长、进入新颖臂百分比高、海马组织ROS 含量低(P均<0.05)。
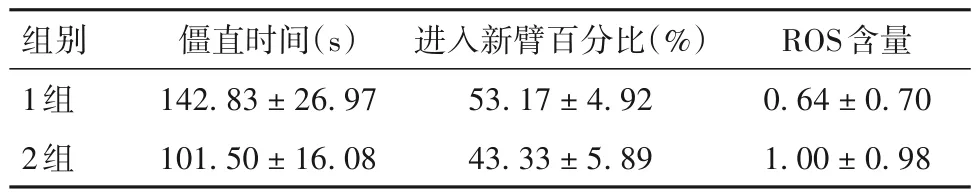
表2 术后第3天1组和2组小鼠僵直反应时间、进入新颖臂百分比及海马组织ROS含量(-x ± s)
3 讨论
临床研究[12]发现老年人围术期容易出现睡眠障碍,表现为入睡困难和睡眠破碎,同时发生睡眠障碍的老年患者术后更易发生POCD。有学者[13]对C57BL/6J成年小鼠进行睡眠剥夺,发现睡眠剥夺可诱导海马中枢炎症,导致术后认知功能障碍。但也有研究[14]提出不同观点,急性的睡眠碎片化可导致中枢炎症,但是不导致术后认知功能改变。针对上述研究的异同,我们通过建立小鼠睡眠碎片化模型和胫骨骨折加髓内固定术手术模型,术后评估18个月龄的C57BL/6J小鼠的认知功能,发现睡眠碎片化组小鼠麻醉术后72 h 学习记忆减退,认知功能显著降低,说明睡眠碎片化可导致老年小鼠POCD 的发生发展。
线粒体是能量代谢的中枢,一方面,产生能量满足细胞生理功能所需,另一方面,线粒体氧化磷酸化和三羧酸循环阶段可产生活性氧。一旦线粒体代谢紊乱产生过多 ROS 导致细胞损害,轻则引起神经功能改变,重则引发炎症反应,造成细胞死亡和神经退行性变。良好的睡眠可调控线粒体功能及ATP 合成的平衡,促进海马区结构可塑性,加强记忆形成[15]。而SF 可导致海马区神经元突触密度降低并减少突触的有效性,损害认知功能[16]。有研究[17]发现,手术可引起老年大鼠中枢 ROS、炎症因子大量释放,导致术后认知功能下降。我们推测睡眠碎片化可损害线粒体呼吸链功能,如线粒体呼吸链复合物酶活性下降、电子传递异常、ROS 积累等。
慢性睡眠碎片化引发线粒体能量代谢失衡,释放大量 ROS,呼吸链 Complex Ⅰ活性下降,表明睡眠碎片化引起线粒体能量代谢和呼吸链显著受损,氧化应激损伤加强。睡眠碎片化一方面通过损害线粒体呼吸链电子传递,降低复合体酶的活性,造成线粒体呼吸功能的异常,最终引起ATP 生成障碍,ROS 大量累积,影响能量内稳态;另一方面老年患者自身神经退行性变增加,脑内线粒体功能缺陷,氧化应激增强,导致葡萄糖、脂肪、氨基酸代谢受阻,进一步损害神经元的突触可塑性,学习记忆减退。GPX4 可通过调控线粒体氧化应激维持正常发展和细胞代谢[18]。衰老大脑特别易于受到氧化应激伤害,而GPX4 是脑部的主要的抗氧化酶,可直接清除ROS、RNS 等,其水平过低可导致脂质过氧化物的积累,在神经退行性变疾病进展中起着重要作用。为了进一步研究睡眠碎片化是直接作用线粒体呼吸链,还是通过抑制GPX4 活性导致ROS 增加,间接影响线粒体呼吸能力,结果发现SF 组小鼠海马区GPX4 蛋白含量明显降低,表明睡眠碎片化通过抑制海马区GPX4 的表达,导致脑内ROS 无法及时有效清除,提示GPX4 可能是导致围术期睡眠障碍患者认知功能损伤的靶点。
为了进一步验证GPX4 在睡眠碎片化导致POCD 中的作用,我们对慢性睡眠碎片化模型小鼠腹腔注射Fer-1后,发现小鼠海马区ROS水平出现一定的下降,小鼠的认知功能也得到明显的改善。这些结果表明GPX4 表达的上升减轻了海马区炎症反应、氧化应激水平,改善小鼠的术后认知记忆。正常情况下,在缺乏GSH 活性时,GPX4 仍可代偿处理胞质和线粒体产生的ROS,随着ROS 的增加,清除ROS 的GPX4 酶活性理应相应增强,蛋白表达增加。但我们的结果表明,睡眠碎片化导致线粒体呼吸链损伤产生的ROS 增加时,海马区GPX4 蛋白表达量反而出现明显的降低,表明GPX4 蛋白是睡眠碎片化作用的直接靶点,腹腔注射Fer-1 后,海马区ROS水平得到控制,也验证我们这一结论。因此,睡眠碎片化可能通过直接抑制GPX4 活性,导致线粒体内产生的大量ROS 无法有效清除,损害线粒体电子呼吸链的传递功能,导致线粒体呼吸代谢储备及能量产生严重受损,进而产生更多的ROS,二者形成正反馈,共同导致了POCD 的发生发展。考虑到GPX4是铁死亡的标志性蛋白,Fer-1 也可以通过螯合铁,清除脂质过氧化物,捕获氧自由基而产生抗铁死亡作用[19]。慢性睡眠碎片化是否是通过抑制GPX4 诱导铁死亡导致POCD 的发生,尚需要进一步实验来证明。
综上所述,睡眠碎片化的老年小鼠TFS 术后POCD 程度较重,海马组织GPX4 表达降低,脑组织线粒体呼吸链功能降低,海马组织Complex Ⅰ活性低、ROS 含量高。Fer-1 可改善睡眠碎片化的老年雄性小鼠POCD。睡眠碎片化可能通过抑制小鼠海马组织GPX4 活性,促进海马组织ROS 积累,抑制线粒体呼吸链功能,促进POCD 发生发展。但是本研究并未进一步验证GPX4 与线粒体呼吸链之间的因果关系,今后需进一步深入探讨睡眠碎片化在POCD发生发展中的具体作用机制。

