多材料3D打印微管阵列神经支架研究
张 晖,张黎明,王赫然,郑雄飞
(1.中国科学院沈阳自动化研究所机器人学国家重点实验室,辽宁 沈阳 110016;2.中国科学院机器人与智能制造创新研究院,辽宁 沈阳 110169;3.中国科学院大学,北京 100049)
1 引言
严重创伤、压迫性损伤以及医源性损伤等都可能导致创口周围神经受损,严重影响着感知和运动等功能。周围神经损伤作为临床上作为常见的病症之一,全球每年新增患者高达百万,给家庭和社会带来沉重的负担[1]。目前,小尺度的神经损伤可以通过手术缝合的方式进行治疗,当神经受损长度超过20mm时就需要进行自体神经移植或者神经支架修复等治疗方式[2]。自体移植的神经不仅来源有限,还会导致供给区域出现神经缺损和无法匹配修复尺寸等问题[3]。目前商品化的产品主要有中空神经导管和脱细胞神经支架两种类型。其中神经导管结构存在管壁较薄容易塌陷、缺乏空间三维结构无法长距离引导以及降解太慢限制神经恢复速度等问题,而脱细胞神经支架结构存在着交叉感染、免疫排斥和脱细胞基质供给等风险[4]。此外,由于神经缺损具有高度随机性,现有商品化支架并不能满足对缺损神经修复的快速性和匹配度要求,限制了神经支架的大规模应用和推广。
近些年,仿生神经支架的制备工艺成为了一项热点研究内容,并且发展出了多种制备方式,其中仿生多通道结构神经导管的制备工艺主要以铸造工艺为主。文献[5]中通过对含有盐溶液的聚合物进行铸造成型,基于无机盐结晶析出原理制备了多孔薄膜结构,最后从盐溶液的质量分数角度对支架的孔隙率、比表面积和微管直径等参数进行了研究。文献[6]通过明胶材料在模具内低温凝胶的工艺路线制备了多孔神经导管,基于明胶吸水特性实现了导管结构的形状恢复功能,简化了神经导管和体内神经的连接过程,动物实验结果表明明胶材料制备的多孔导管具有良好的生物降解性和促进神经恢复功能。文献[7]中利用3D打印制作的模具进行水凝胶材料的灌注,通过低温物理凝胶方式构建了不同几何形状的导管结构,并对植入后的水凝胶导管降解性能进行了分析,指出水凝胶导管在神经修复以及临床应用方面具有潜在的价值。文献[8]通过在模具中灌注高浓度胶原蛋白并控制模具中钢丝的直径和数量的方式,实现了多通道胶原蛋白神经支架的制备,并进行了神经支架植入的动物实验,验证了多通道结构对防止外部结缔组织的浸润、减少神经细胞生长因子的流失和提高神经生长的方向性方面的作用。文献[9]采用打印的构建了胶原和F127材料的复合管腔结构,通过京尼平溶液进行交联并去除溶芯材料,从而制备了胶原管腔支架结构。
由以上研究可知,目前多通道神经支架对神经的再生和桥接具有良好的促进作用,现阶段主要是通过模具灌注成型的方法来制造,这种制造方法在支架尺寸、通道数目以及通道直径方面具有很大的局限性,难以实现神经修复的快速性和高匹配度要求,并且铸造成型工艺流程相对复杂,有机溶剂通常具有毒性。因此,这里提出挤出式3D打印成型方式对神经支架进行批量化制造,以常用生物墨水甲基丙烯酸酐化明胶(GelMA)和明胶为打印墨水,基于明胶材料溶芯原理构建水凝胶支架微管阵列结构,从微管直径、微管间距、孔隙率和力学性能方面对神经支架的成型质量进行评价,为微管阵列神经支架的制备提供了一种快速个性化的方法。
2 实验材料与方法
2.1 实验材料
甲基丙烯酸酐购自Sigma-Aldrich公司,276685;A型猪皮明胶购自Sigma-Aldrich公司,V 900863;PBS磷酸盐缓冲剂(0.01M,PH7.2-7.4)购自鼎国昌盛,BF-0011;苯基(2,4,6-三甲基苯甲酰基)磷酸锂盐(LAP)购自Sigma-Aldrich公司,900889-1G;实验所用水均来自Milli-Q Direct纯水系统。
使用甲基丙烯酸酐与明胶反应制成GelMA。在500ml烧杯中先后加入300ml的PBS溶液和30g的明胶,将烧杯放入水浴锅中,设置水温度为60℃,磁力搅拌至完全溶解。然后将温度降至50℃,取30ml甲基丙烯酸酐,用注射器缓慢滴入明胶溶液中,加热搅拌1h。将上层反应产物装进3.5kDa透析袋,在40℃下对蒸馏水透析一周。将得到的产物GelMA放入冻干机进行冷冻干燥处理,封装后储存在4℃冰箱中。
将冻干态GelMA溶解于PBS缓冲液中配置成5%、7%和9%(w/v)的GelMA溶液,添加0.1%(w/v)LAP摇晃溶解,形成可紫外光交联固化的光敏材料。将颗粒状明胶溶解于PBS缓冲液中配置成10%(w/v)明胶溶液,完全溶解后进行离心(2000r/min)以及过滤(0.22μm)处理,分装后放于4℃冰箱中避光保存。
2.2 实验设备
实验采用自主研发的高精度生物3D 打印机(SIA Bioprinter Pro),打印机整体上可分为三部分,分别为三轴运动平台、精密挤出多喷头系统和温控系统,并且内部可提供紫外灭菌环境,如图1所示。三轴运动平台运动精度达0.1μm,可满足长宽高(50×30×20)mm尺度打印的需求;精密挤出喷头采用滚珠丝杠推杆装置实现,直线位移精度为1μm,对打印过程中墨水的定量挤出实现精准控制;温控系统中打印底板以及五个打印喷头均具有单独控温功能,底板的温度调节范围为-10℃到60℃,打印头的温度调节范围为10℃到60℃,温度控制精度为0.5℃,可满足多种材料不同温度复合打印的需求。实验中采用500μL的玻璃进样针作为料仓,进样针底部通过金属连接件与武藏不锈钢针头连接,针头出丝直径最小为50μm。

图1 生物3D打印机Fig.1 Biological 3D Printer
2.3 实验方法
实验采用GelMA 为基质材料,明胶为支撑和溶芯材料。在打印过程中,明胶材料为圆柱体提供稳定的支撑,同时作为溶芯材料暂时占据微管位置。GelMA和明胶水凝胶具有温度敏感特性,在降低温度时,其模量会逐渐升高。当储能模量与损耗模量达到平衡时,材料会呈现适合打印的凝胶状态,此时继续降温会呈现过凝胶状态,影响挤出丝的形貌和保真度。打印机的两个喷头中分别装载GelMA和明胶材料,调节喷头温度和底板温度,进行逐层打印,如图2所示。在实验中,5%、7%和9%的GelMA打印温度分别设置为18℃、20℃和22℃,明胶的打印温度设置为24℃,保证水凝胶材料均匀挤出成丝。打印底板温度设置为10℃,增强材料的物理凝胶强度,提高结构稳定性。打印后使用365nm紫外光照射整体支架结构45s,对结构中的GelMA材料进行交联,稳定支架形态,提高支架力学性能。最后将交联后的支架放于PBS溶液内升温至37℃,1h后明胶溶解在PBS溶液中,形成支架内的微管阵列结构。

图2 微管阵列神经支架工艺流程图Fig.2 Technological Process of Neural Scaffold with Multichannel Characteristics
实验后通过显微镜对支架切片结构进行观察,使用软件ImageJ测量支架几何参数,对微管阵列的直径和间距进行评价。使用液氮对支架进行冷冻,在真空冷冻干燥机中冻干12h,切片后进行喷金处理,使用扫描电子显微镜观察。
对支架尺寸和微管特征进行参数设置,微管阵列神经支架打印实验中,支架几何尺寸为φ4.0×30mm,微管阵列尺寸通过控制每段打印轨迹中材料属性的方式进行设置,如表1 所示。实验使用3D 打印机配套自研软件Biopcoder 进行参数配置和G代码生成。

表1 微管阵列实验参数表Tab.1 Experimental Parameters Table of Multichannel Characteristics
3 结果与分析
GelMA和明胶墨水具有较强的温敏特性,在温度由高到低的变化过程中,两者将从液态逐渐向凝胶态转变,当温度升高后将重新液化。5%的GelMA溶液和10%的明胶溶液在从0℃升温到37℃过程中流变学特性会发生变化,如图3所示。随着温度的升高,材料的储能模量(G')和损耗模量(G'')会逐渐降低,两者相交的位置为凝胶点。从曲线可以看出10%的明胶在37℃下损耗模量远大于储能模量,呈现液态,能够溶解在PBS 溶液中被去除。GelMA以及明胶墨水在升温和降温过程中表现出不同的流变学特性,降温过程的凝胶点会低于升温过程的凝胶点。实验前生物墨水的准备是一个降温过程,因此采用降温过程的凝胶点作为打印温度的参考。5%、7%和9%的GelMA凝胶点温度分别为18℃、20℃和22℃附近,明胶的凝胶点温度为24℃附近。
在显微镜下观察打印的神经支架以及微管阵列结构,如图4所示。
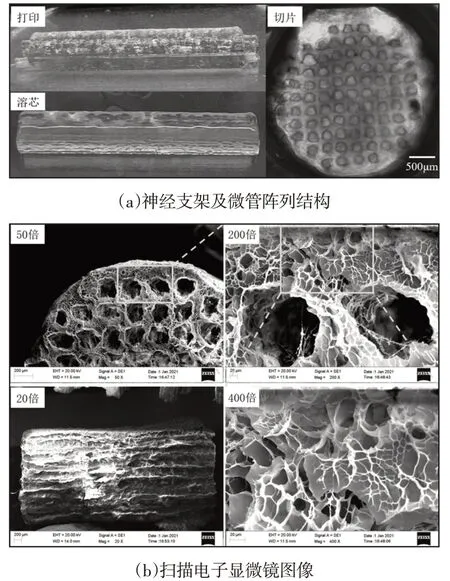
图4 神经支架和扫描电子显微镜图像Fig.4 Nerve Scaffold and Scanning Electron Microscopy Images
在明胶溶芯材料的支撑作用下,打印后的微管阵列神经支架结构具有较高的完整度,如图4(a)所示。将交联的支架进行溶芯处理,可以看出溶芯后支架未发生塌陷情况,说明支架具有相对较高的力学性能,并且支架形成了光滑的表面。将神经支架进行切片处理后,对内部的微管结构进行观察,微管密度高达6.8条/mm2,并且支架内部形成了高度统一的微管阵列结构,利于神经再生轴突从近端向远端的高密度迁移生长。电镜观察神经支架横截面的50倍、200倍、400倍图像以及纵截面的20倍图像,如图4(b)所示。从横截面的图像来看,支架在不同尺度下均都有清晰可见的孔隙结构,有利于营养物质的渗透。纵截面显示出微管的连通性,有利于对神经细胞进行定向引导。
3.1 微管直径
不同GelMA 浓度条件下,对神经支架内部微管直径进行对比,如图5所示。
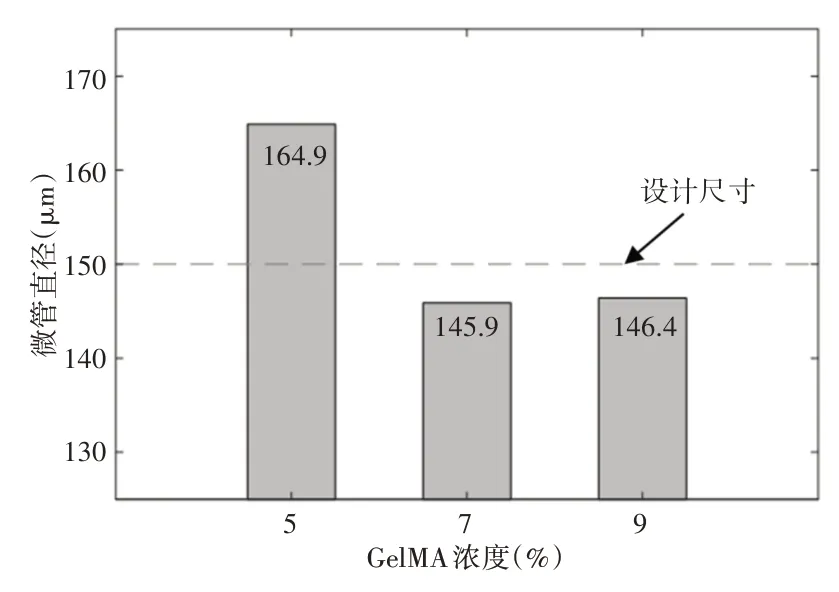
图5 微管直径的对比情况Fig.5 Comparison of Micro-Tube Diameter
从整体上看,当GelMA 浓度为5%时,微管直径大于设计尺寸,当浓度为7%和9%时,微管呈现出小于设计尺寸的趋势,这可能是由于浓度较低时支架本体中GelMA 结合强度较弱,微管内壁处的GelMA 材料随明胶材料的溶解而脱落,导致成型后的微管直径偏大。从支架内微管直径和设计尺寸的对比上分析,当浓度为5%时两者的误差最大,此时误差在10%以下,说明在挤出式打印中明胶材料对维持微管形状的完整性起到了良好的作用。随着GelMA 浓度的增加,微管直径和设计尺寸之间的误差减小,说明提高GelMA 浓度可以改善支架内微管的成型质量。当浓度为7%和9%时,两者的微管直径均值基本一致,浓度为9%时误差最小为2.4%,这说明当GelMA浓度较高时,制备的支架已经实现了高质量微管加工,此时增加浓度对微管直径的影响较小。
3.2 微管间距
不同GelMA 浓度条件下,对神经支架内部微管间距进行对比,如图6所示。

图6 微管间距的对比情况Fig.6 Comparison of Micro-Tube Spacing
从整体上看,微管之间的距离均小于设计尺寸,这说明使用PBS溶液进行溶芯时,不同浓度条件下的支架都出现了失水后尺寸收缩的情况,不同浓度GelMA材料制备的支架,微管间距呈现出明显的区别。当浓度为5%时微管间距最小,也验证了GelMA浓度较低时,固化后的GelMA 出现的孔壁材料脱落情况。当浓度为5%时,微管间距和设计尺寸之间的误差最大,此时两者的误差为8.2%。当浓度为7%时微管间距基本和理论值相同,两者之间误差在0.3%以下,说明浓度为7%时GelMA 紫外固化的效果最好,并且溶芯成型时受到PBS溶液的影响最小。
3.3 孔隙率
支架结构内部的孔隙对神经的修复起到重要的影响,随着孔隙率的升高支架结构的通透性也会增强,有助于导管外部营养物质的渗透以及神经之间信号的相互传递,促进了神经细胞在导管内的生长[10]。
由神经支架截面积的几何特征进行分析,其中支架截面积V为:
式中:R—神经支架外径;
n—微管数量;
E(r)—微管直径的期望;
L—神经支架长度。
对于神经支架的孔隙率P可以表示为:
式中:m—冷冻干燥后神经支架的质量;
ρ—冷冻干燥后GelMA材料的密度。
对不同浓度的GelMA 材料打印后支架内孔隙率进行对比,如图7所示。

图7 支架孔隙的对比情况Fig.7 Comparison of Scaffold Pore
随着GelMA浓度的增加,支架内孔隙率呈逐渐下降的趋势,这是由于支架内部大部分由PBS溶液构成,当支架冷冻干燥后其形状基本保持不变,溶液通过升华形成支架孔隙。通过对比可以看出,当GelMA浓度为5%和7%时,支架孔隙率在90%以上,说明制备的神经支架具有良好的通透性,适宜营养物质的传送和新陈代谢的排出。
3.4 力学性能
使用质构仪(CT3 Texture Analyzer Brookfield)在室温下对不同浓度的GelMA支架进行力学性能测试。触发点负载为0.008N,测试速度为0.1mm/s。轴向压缩测试时将支架截成1.8mm 长的圆柱,取应变(0~0.2)范围内的曲线进行线性拟合,计算压缩模量。测量不同浓度的GelMA 神经支架的压缩应力-应变曲线,如图8 所示。为支架拉伸和压缩模量的对比情况,GelMA神经支架的拉伸和压缩模量都随着浓度的增加而增大,如图9所示。但是其机械强度均小于人的自体神经组织[11]。在后续的研究中,可以通过增加外皮或者混入增强材料来提高整体的机械性能。
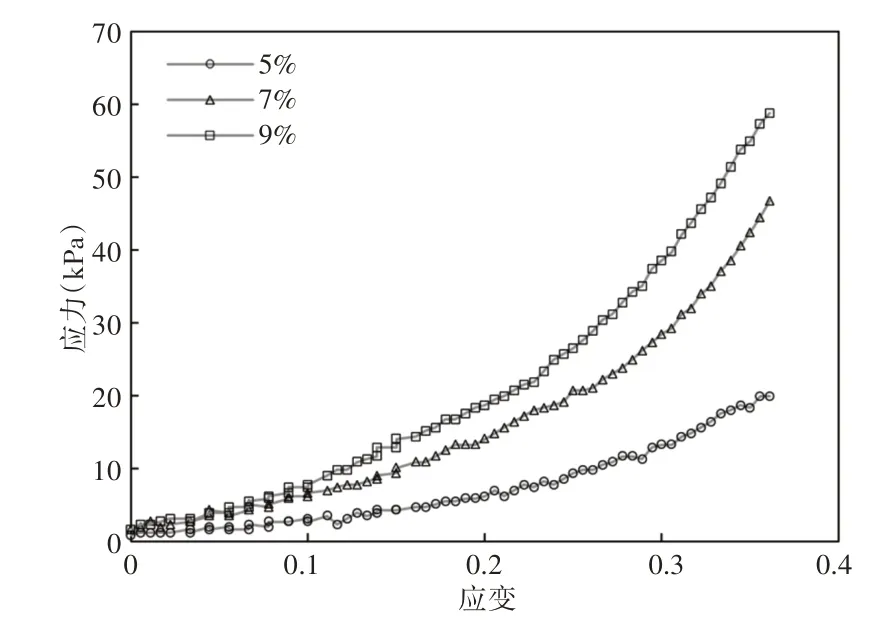
图8 支架压缩应力-应变曲线Fig.8 The Stress-Strain Curve of Scaffold Compression

图9 支架拉伸及压缩模量Fig.9 Tensile and Compression Modulus of Nerve Scaffold
4 结语
这里首先通过3D 打印技术对GelMA 材料和明胶材料进行挤出成型,然后通过紫外光对支架整体结构进行化学交联,最后基于明胶材料的升温溶芯工艺对微管阵列结构进行构建,主要得出以下几点结论:
(1)微管直径和设计尺寸之间的误差最小为2.4%,当浓度为7%时微管间距和设计尺寸之间的误差在0.3%以下;(2)支架内孔隙率随GelMA 浓度的增加呈逐渐降低的趋势,当GelMA 浓度为5%和7%时,支架孔隙率在90%以上;(3)当GelMA浓度增加时,支架孔隙率降低,机械性能增强。孔隙率与力学性能之间存在矛盾,需要进一步的研究来平衡支架的综合性能。(4)从整体上看,当GelMA浓度为7%时制备的微管阵列神经支架结构,在微管直径、微管间距、孔隙率以及力学性能方面都较为优异。
——水芹主要害虫识别与为害症状

