BMSCs 移植通过激活AMPK/mTOR 信号通路介导的自噬抑制大鼠蛛网膜下腔出血后神经元凋亡
崔彩玲,许心语,张 豫,崔博文,胡艾蕙,刘俊杰,2,李建民,2
(1.华北理工大学临床医学院,河北 唐山 063000;2.华北理工大学附属医院神经外科,河北 唐山 063000)
蛛网膜下腔出血(SAH)是由脑实质中的浅表血管破裂和血液灌入蛛网膜下腔引起的一种临床综合征,在临床上具有极高的病死率和残疾率。余志强等[1]认为,发生SAH 后,神经小胶质细胞受到刺激、免疫细胞发生聚集,引起微循环障碍,进而血脑屏障被破坏,进而导致神经元直接或间接凋亡。因此,神经元凋亡在早期脑损伤(EBI)的病理生理过程中被认为具有重要的作用[2-4]。细胞自噬是依赖溶酶体内的异常蛋白,以及受损的细胞器所产生或暴露的蛋白的一个重要分解途径。其中,磷酸腺苷活化蛋白激酶/哺乳动物雷帕霉素靶蛋白(AMPK/mTOR)通路是自噬上游的一条关键途径。当机体能量供应充足时,mTORC1 使ULK1 发生磷酸化,进而阻断其与AMPK 作用激活,从而抑制细胞自噬启动[5]。当机体处于能量不足时,AMPK 使Raptor 磷酸化并被抑制,从而下调mTORC1 的活性。另外,ULK1 也可被磷酸化激活,引发自噬级联的启动[6];已有研究表明,蛛网膜下腔出血后,AMPK/mTOR 和PI3K-Akt/mTOR通路对自噬强度的调节可对神经元起保护作用[7],这些实验均表明,在SAH 后神经元凋亡及自噬过程的调控中,AMPK/mTOR 通路可能扮演着不可或缺的角色。骨髓间充质干细胞(BMSCs)具有穿越血脑屏障、迁移到中枢神经系统的能力,并在移植后分化为神经细胞。目前已有研究表明骨髓间充质干细胞移植治疗可能有促进脑出血(ICH)大鼠神经系统功能恢复的作用,一方面移植干细胞能够减轻神经元的凋亡,加强损伤后的组织修复,改善损伤处内环境,起到保护血肿周围组织的作用[8-10];另一方面ICH 后,出血灶周围的脑组织内可检测到PI3K-Akt-mTOR 相关通路的激活;进行BMSCs 治疗后,此通路激活程度加强,细胞自噬与轴突再生也 同 时 增 强[11]。然 而,BMSCs 移 植 能 否 通 过AMPK/mTOR 通路引起自噬从而减轻SAH 后的神经元凋亡却鲜有报道。因此,本实验欲建立SAH大鼠模型,探究BMSCs 移植治疗通过AMPK/mTOR 通路诱导SAH 后神经元自噬与凋亡的程度和可能机制,旨在为其它相关研究提供更好的实验基础,为SAH 的临床诊治及药物开发提供新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性Sprague-Dawley(SD)大鼠,体重280~300 g。实验组大鼠于华北理工大学动物实验基地进行人工饲养,每天给予大鼠自由进食,其饮水及所处环境通风情况良好。实验开始之前,对大鼠进行适应性喂养1 周。
1.1.2 实验试剂与仪器 AMPK 抑制剂Compound C 于 美 国Sigma 公 司 购 入,抗Beclin-1 单 克 隆抗体、抗LC3-Ⅱ多克隆抗体、抗GAPDH 单克隆抗体于Proteintech 公司购入;二抗及显色用品于美国KPL 公司购入;抗p-mTOR 单克隆抗体、抗mTOR多克隆抗体、抗p-AMPKα 单克隆抗体、抗AMPKα单克隆抗体均于美国Cell Signaling Technology 购入。TP-1 型摊片机(湖北康强医疗设备有限公司),820-Ⅱ切片机(德国LEICA 公司),大鼠脑立体定位仪(上海宇燕科学仪器有限公司)。
1.2 实验方法
1.2.1 动物分组及模型构建 采用随机数字方法,将48 只SD 大鼠(雄性)按如下方式分组:假手术(Sham)组、模型(SAH)组、模型组+骨髓间充质干细胞(BMSCs)组、模型组+BMSCs+AMPK 抑制剂(Compound C)组,每组各12 只。在模型制作之前,所有动物12 h 内禁食,4 h 内禁水。参考文献[12]所述,建立SAH 大鼠模型,采用血管穿刺技术,术后24 h 取材,SAH 手术模型制作成功的临床表现指证为蛛网膜下腔内出现血凝块;若不合格则剔除实验[13]。假手术组不扎穿血管壁,其他术式无明显差异。Compound C 组、BMSCs 组分别在造模前30 min 将Compound C(100 nmol 溶于10 μL 生理盐水)和10 μL 生理盐水(2 μL 二甲基亚砜溶于8 μL 0.1 mol/L 磷酸盐缓冲液)使用大鼠脑立体定位仪注入左侧侧脑室(前囟后1 mm、旁开1.5 mm、深3.5 mm)注射。在造模成功后1 h,将2 μL 浓度的1×108/mL 的细胞悬液通过脑室注射。
1.2.2 大鼠神经功能评估 造模成功之后24 h,以Garcia 评分表[14]为依据随机评估每组6 只大鼠的神经系统缺陷,包括自主活动、肢体运动、前肢伸展和攀登以及对躯干和肢体触摸的反应。其中自主活动、肢体运动对称性和前肢伸展各0~3 分;攀爬、对躯干触摸的反应和对轴向奔跑的反应各1~3 分。计算总分,分数越低表示神经系统损伤越严重。
1.2.3 大鼠脑含水量检测 每组大鼠各取6只进行造模,成功后继续喂养24 h。将SAH 的模型大鼠用水合氯醛进行麻醉并将其颈椎脱臼处死取脑,将两侧海马组织快速剥除。取200 mg 大脑皮质,放置于电子天平,记录湿重(精确到1 mg),然后恒温干燥48 h,直至恒重。称取干重量,并根据Elliott 公式分析各组脑组织水含量:脑含水量(%)=(烘干前质量-烘干后质量)/烘干前质量×100%。对四组大鼠的脑组织含水量进行测定和比较。
1.2.4 大鼠神经元凋亡情况 用4%多聚甲醛固定部分海马组织,采用石蜡包埋并执行连续分片。切片经常规脱蜡、洗涤等处理后,滴加过氧化氢排除过氧化酶活性,并在20~25 ℃室温下浸润25~30 min;完成后洗涤标本,根据TUNEL 染色试剂盒上的指示对标本进行处理与染色。显微镜下观察凋亡细胞的数量并摄片,在每个切片中随机选择海马CA1 区的5 个像场进行计数,并取其平均值作为凋亡细胞数。
1.2.5 免疫组织化学染色 常规脱蜡,避光条件下用过氧化氢加热10 min,用胰蛋白酶校正抗原20 min,于湿器中滴加抗体LC3-Ⅱ(稀释度1∶300)和抗体Beclin-1(稀释度1∶200),4 ℃过夜孵育。然后加入二抗溶液,室温下孵育半小时。之后用PBS 洗涤,二氨基联苯胺染色,脱水,透明,覆盖玻片。本实验用PBS 替代一抗做对照组。光镜下观测海马CA1 区域内的阳性细胞,并在每个切片内随机选择5 个不同的视野,计算阳性细胞平均数量[15]。
1.2.6 大鼠海马组织中相关蛋白表达水平 取大鼠海马组织,4 ℃条件下加入RIPA 裂解液研磨裂解组织,离心分离提取蛋白。取制备的蛋白提取液,上样量30 μg 蛋白,经聚丙烯酰胺凝胶电泳,转至PVDF 膜上。将PVDF 膜置于孵育盒内加入5%脱脂奶粉,室温下封闭2 h。封闭结束后利用TBST 洗膜,分别加入不同比例稀释的一抗1∶500 稀释的AMPKα;1∶1 000稀释的LC3-Ⅱ、Beclin-1、p-AMPKα、mTOR、p-mTOR;1∶1 500 稀释的GAPDH 稀释液,4 ℃过夜。完成后室温下使用TBST 洗涤,后加入辣根过氧化物酶标记的二抗孵育2 h,孵育完毕后再用TBST 洗涤。滴入ECL 超敏发光液显影。采用Image J 对蛋白质条带进行光密度值测定和量化分析。
1.2.7 统计学分析 所有数据均使用Excel 建立数据 库,应 用SPSS 23.0 和GraphPad Prism 8.0 统 计分析软件对数据进行处理,并绘制图形。所有数值均以(xˉ±s)表示。采用单向方差分析比较多个样本,采用t检验比较两组间数据。P<0.05 差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺陷评分比较
与SAH 组 大 鼠 相 比,Sham 组 大 鼠Garcia 评 分高(P<0.05),神经功能正常,而BMSCs 组Garcia 评分低,神经功能缺陷明显(P<0.05)。与BMSCs 组相比,Compound C 组神经功能则进一步降低(P<0.05),见表1。
表1 各组大鼠神经功能评分(n=6 )Tab 1 The results of the neurological score content in each group of rats (n=6)
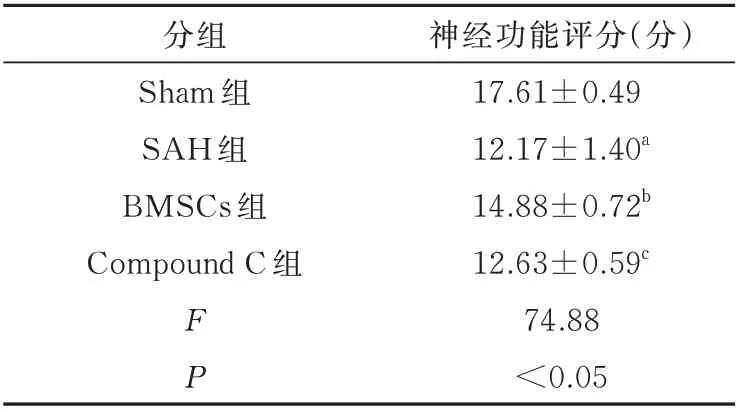
表1 各组大鼠神经功能评分(n=6 )Tab 1 The results of the neurological score content in each group of rats (n=6)
注:神经功能评分为Garcia 评分;与Sham 组相比,aP<0.05;与SAH 组相比,bP<0.05;与BMSCs 组相比,cP<0.05。
神经功能评分(分)17.61±0.49 12.17±1.40a 14.88±0.72b 12.63±0.59c 74.88<0.05分组Sham 组SAH 组BMSCs 组Compound C 组FP
2.2 各组大鼠脑含水量比较
与Sham 组相比,SAH 组大鼠的脑组织含水量显著增加(P<0.05)。与SAH 组相比,BMSCs 组降低了大鼠脑含水量(P<0.05)。与BMSCs 组比较,Compound C 组则略微升高(P<0.05);而Sham 组与BMSCs 组对比差异无统计学意义(P>0.05)。在实验过程中,可以观察到各组不同程度的水肿现象。结果见表2。
表2 各组大鼠脑组织含水量(n=6)Tab 2 The results of brain water content in each group of rats (n=6)
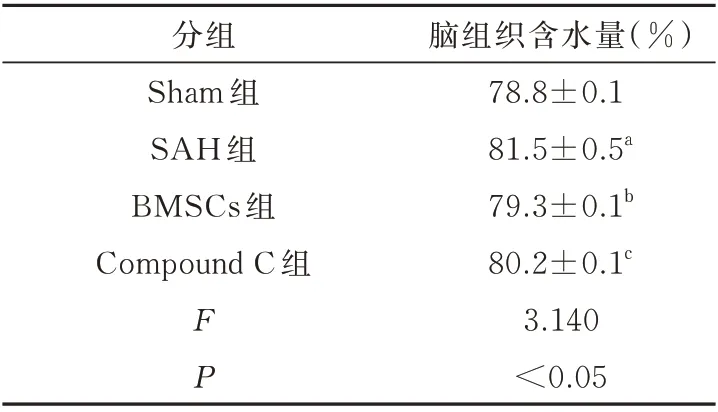
表2 各组大鼠脑组织含水量(n=6)Tab 2 The results of brain water content in each group of rats (n=6)
注:与Sham 组 相 比,aP<0.05;与SAH 组 相 比,bP<0.05;与BMSCs 组相比,cP<0.05。
脑组织含水量(%)78.8±0.1 81.5±0.5a 79.3±0.1b 80.2±0.1c 3.140<0.05分组Sham 组SAH 组BMSCs 组Compound C 组FP
2.3 各组大鼠海马组织神经元凋亡情况
借助TUNEL 染色来观察大鼠海马组织切片的结果:与Sham 组比较,SAH 组大鼠神经元凋亡程度更大,凋亡率明显升高(P<0.05);与SAH 组比较,BMSCs 组大鼠神经细胞凋亡显著降低(P<0.05);与BMSCs 组比较,Compound C 组大鼠中海马区的神经元凋亡率则呈现相对上升的趋势(P<0.05),结果见表3、图1。
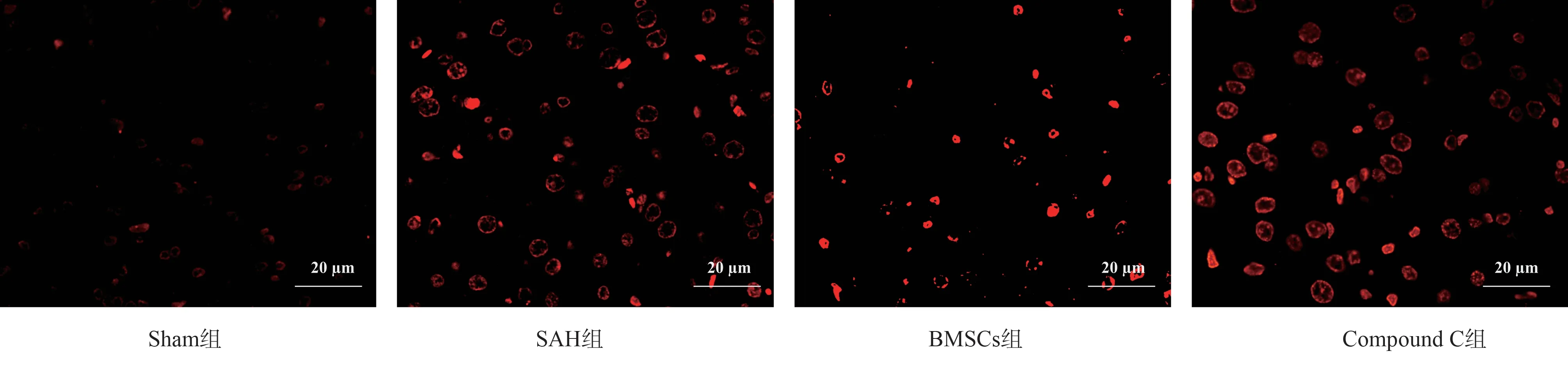
图1 TUNEL 染色(×400)Fig 1 TUNEL staining (×400)
表3 各组大鼠神经细胞凋亡数(n=6)Tab 3 The number of neuronal apoptosis in rats in each group(n=6)

表3 各组大鼠神经细胞凋亡数(n=6)Tab 3 The number of neuronal apoptosis in rats in each group(n=6)
注:与Sham 组相比,aP<0.05;与SAH 组相比,bP<0.05;与BMSCs 组相比,cP<0.05。
CA1 区1.61±0.22 45.25±3.79a 29.47±1.52b 39.38±1.72c 17.44<0.05分组Sham 组SAH 组BMSCs 组Compound C 组FP
2.4 各组大鼠海马组织中Beclin-1 与LC3-Ⅱ蛋白表达水平
研究大鼠海马组织中Beclin-1 和LC3-Ⅱ蛋白的表达水平,发现SAH 组与Sham 组比较,大鼠自噬蛋白表达水平降低;BMSCs 组与SAH 组大鼠比较,大鼠自噬蛋白表达水平显著升高;Compound C组与BMSCs 组比较,自噬蛋白水平则有所下降。以上均具有统计学差异(P<0.05)。结果见表4、图2、3。
表4 各组海马组织Beclin-1和LC3-Ⅱ的阳性细胞数(n=6)Tab 4 The number of positive cells of Beclin-1 and LC3-Ⅱin hippocampal tissue of different groups(n=6)
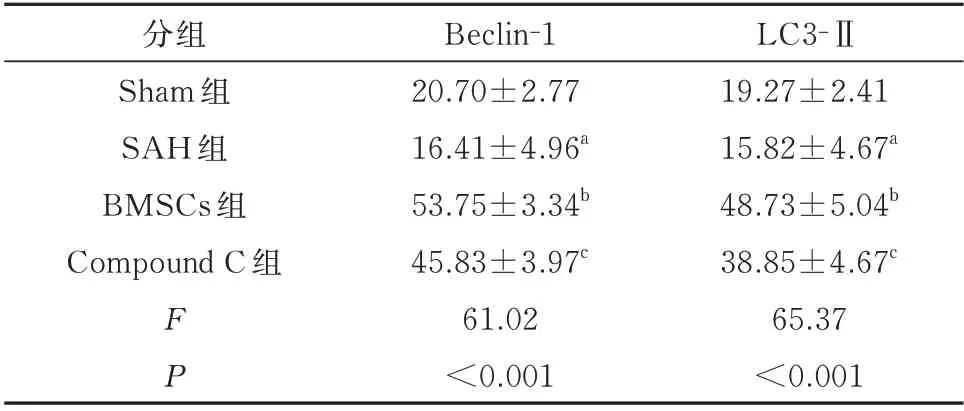
表4 各组海马组织Beclin-1和LC3-Ⅱ的阳性细胞数(n=6)Tab 4 The number of positive cells of Beclin-1 and LC3-Ⅱin hippocampal tissue of different groups(n=6)
注:与Sham 组相比,aP<0.05;与SAH 组 相比,bP<0.05;与BMSCs 组相比,cP<0.05。
LC3-Ⅱ19.27±2.41 15.82±4.67a 48.73±5.04b 38.85±4.67c 65.37<0.001分组Sham 组SAH 组BMSCs 组Compound C 组FP Beclin-1 20.70±2.77 16.41±4.96a 53.75±3.34b 45.83±3.97c 61.02<0.001
2.5 各组大鼠AMPK 通路相关蛋白的变化
Western blot 检测AMPK 通路蛋白显示:与Sham 组相比,SAH 组中p-AMPK 与AMPK 的比值降低,p-mTOR 与mTOR 的比值增高(P<0.05);与SAH 组 相 比,BMSCs 组p-AMPK 与AMPK 比 值 增加,p-mTOR 与mTOR 的比值降低(P<0.05)。与BMSCs 组 相 比,Compound C 组 则p-AMPK 与AMPK 的比值下调,p-mTOR 与mTOR 的比值上调(P<0.05)。提示BMSCs 可能对AMPK/mTOR 通 路具有激活作用,见图4。
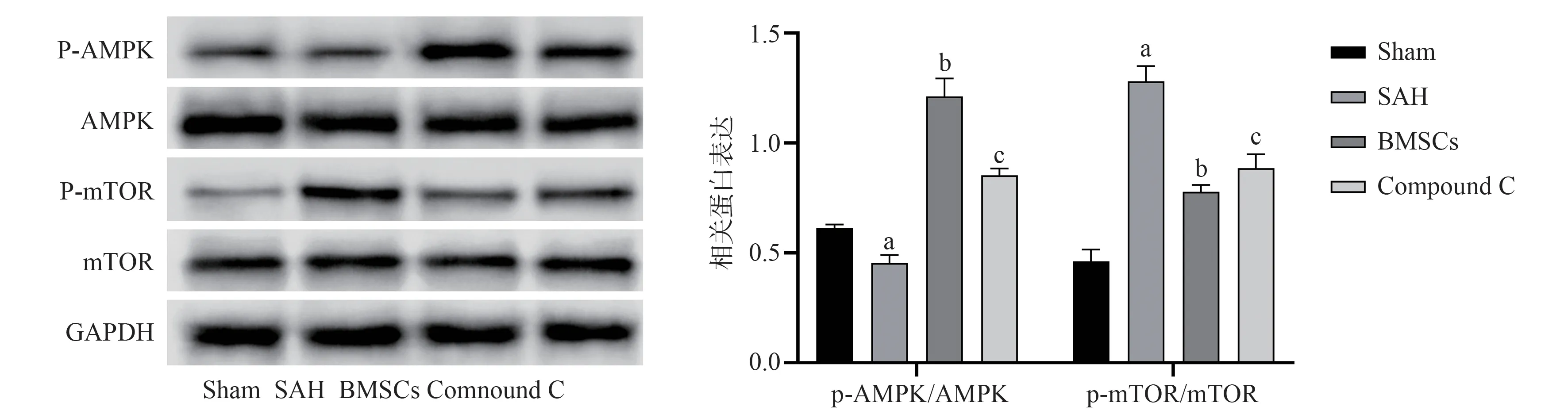
图4 各组大鼠AMPK 信号通路相关蛋白表达水平Fig 4 Expression levels of proteins associated with the AMPK signaling pathway in different groups of rats
3 讨论
自噬是指通过消化和降解破坏的细胞器、病原体等来维持细胞内环境的一种现象。自噬对SAH后神经细胞凋亡的影响和作用机理已成为当前研究的一个重要热点。李小亮等[16]研究证实,如果通过AMPK/mTOR 信号通路诱导大鼠凋亡,则大鼠BMSCs 合成可能影响神经细胞自噬。适当的自噬帮助细胞排出毒素和损伤物质,增加存活的神经元,抑制细胞走向凋亡。大量的实验研究表明,SAH 后神经元的自相位可能被激活,并进一步诱发自噬,加强自噬可以降低SAH 后的神经细胞凋亡,使神经功能损害得到缓解。在自噬体形成过程中,LC3-Ⅱ是其自噬体膜上形成和定位的标志性蛋白[17]。本实验研究发现,在对自噬因子LC3-Ⅱ和Beclin-1 蛋白的测定实验中,发现与SAH 组相比较,BMSCs 组大鼠海马组织内蛋白表达水平显著增强,通过观察大鼠海马回神经凋亡情况发现SAH 组TUNEL 阳性细胞数显著上升,假手术组则不显著;BMSCs 组的TUNEL 阳性细胞数比SAH 组显著降低,表明神经元细胞凋亡水平降低。实验研究表明,通过骨髓间充质干细胞移植可改善SAH 大鼠的自噬神经元程度及克制其凋亡,同时可加强修复大鼠神经功能及改善脑水肿。这些结果表明BMSCs可能是通过增加自噬从而抑制SAH 后早期神经元凋亡。但是目前SAH 试验后BMSCs 抑制低振幅神经元凋亡的潜在机制尚未得到完全证实。
已有研究表明,SAH 后可通过激活自噬一定程度上对SAH 后大鼠神经元的保护[18]。本实验通过采用孙新刚等[12]颈动脉穿刺法制作蛛网膜下腔出血的大鼠模型研究后发现,SAH 大鼠海马组织中神经元凋亡情况严重,神经功能评分显著降低;加入BMSCs 后,大鼠神经功能评分相对上升,提示在一定程度上恢复了感觉和运动功能。目前已有研究表明,骨髓间充质干细胞能促进SAH 大鼠受损神经细 胞 的 恢 复[19],且BMSCs 可 以 通 过PI3K-Akt/mTOR 通路来影响SAH 的自噬[11]。mTOR 是调控自噬的关键物质,其上游调控通路主要包括PI3K/Alt 和LKBl/AMPK,通过mTOR 的激活来抑制神经元自噬。作为mTOR 的负调控因子,AMPK 的激活可促进自噬[20]。AMPK 是关键的细胞能量传感器,激活后通过调节合成代谢和分解代谢并诱导自噬,维持细胞能量平衡,促进细胞生存[21]。
AMPK/mTOR 途径是最重要的自相位控制途径之一。其中,AMPK 被磷酸化为p-AMPK,进一步 抑 制mTOR 激 酶 的 磷 酸 化,最 终 引 发 自 噬[22,23]。实验研究结果显示,发现加入BMSCs 可显著升高p-AMPK 的水平,同时降低SAH 后大鼠海马组织p-mTOR 的表达水平,说明BMSCs 移植后激活了AMPK/mTOR 信号通路。同时,用AMPK 抑制剂(Compound C)进 行 干 预,Compound C 组 的p-AMPK 活性在几乎所有时期都显著低于BMSCs组,而mTOR 蛋白活性则高于BMSCs 组,并且增加了p-mTOR 表达。因此猜测通过BMSCs 移植后的大鼠SAH,可能是通过调控AMPK/mTOR 通路来加强影响大鼠海马回神经元自噬,从而减轻其向细胞凋亡的转归。
综上所述,BMSCs 可能是通过促进AMPK/mTOR 通路活化打开细胞自噬,来实现抑制神经元凋亡的效果。SAH 大鼠受损海马组织中的神经细胞存在自噬及AMPK/mTOR 通路的激活;移植BMSCs 治疗可以进一步激活AMPK/mTOR 通路,并增强受损组织内的细胞自噬,神经元凋亡受到抑制,进而使SAH 大鼠神经功能损伤得到改善,这为BMSCs 移植治疗SAH 后神经损伤提供了新的参考依据。然而,本研究尚未阐明BMSCs 在调节AMPK/mTOR 途径中的具体作用,需在后期进行深入研究与叙述。
作者贡献度说明:
崔彩玲:实验设计,实验实施,分析数据,撰写论文;许心语、张豫:协助实验设计,分析数据,撰写论文;崔博文、胡艾蕙:实验实施,搜集数据;刘俊杰、李建民:设计实验,指导写作。
所有作者声明不存在利益冲突关系。

