二苯乙烯苷调控MKK7/JNK 信号通路改善阿尔茨海默病大鼠神经元损伤作用及机制研究
李 悦,康碧倩,何晓璇,胡 睿,肖 振,罗陈亮,吴桂有,黄忠仕
(1.右江民族医学院基础医学院,广西 百色 533000;2.广西中医药大学药学院,广西 百色 533000)
阿尔茨海默氏病(AD)是最常见的痴呆症类型,正在成为全球健康和社会保健的主要挑战。然而,目前对 AD 发病机制的了解有限,目前尚无早期诊断和公认根治该疾病的药物疗法[1]。AD 是一种基于神经系统方面的退行性改变的疾病,目前认为,其发病的主要机制是和人脑皮质的边缘区域中淀粉样蛋白β(Aβ)斑块形成以及tau 蛋白过度磷酸形成纤维缠结,炎症的发生,氧自由基的形成有关,AD 的特点是记忆力减退和进行性神经认知功能障碍并且影响日常生活活动和社会功能[2]。随着预期寿命的延长和人口老龄化的发生,全球患病率预计将继续上升,尤其是在发展中国家,给社会和家庭带来高昂的疾病负担[3]。
2,3,5,4-四羟基二苯乙烯葡萄糖苷(TSG)又称二苯乙烯苷,是中药何首乌中发挥主要药理作用的成份,有抗炎修复,抗氧化,抗细胞凋亡和清除自由基的作用,对神经系统起到保护作用,改善学习记忆能力修复脑损伤,对改善AD 有一定的疗效,可舒张血管,促进血管内皮细胞增殖,降低胆固醇及抑 制 动 脉 粥 样 硬 化 等 多 种 作 用[4,5]。有 研 究 表 明TSG 能提高多种AD 有关蛋白的表达量,从而降低小 鼠 脑 内APP 及Aβ 的 过 度 产 生 进 而 防 治AD[6]。在当前老龄化日渐普遍的背景下,研究TSG 防治AD 的作用机制有重要意义[7]。本实验通过观察老年 大 鼠AD 模 型 给 药TSG 后MKK7、JNK 因 子 的 变化来进一步探讨TSG 在治疗AD 的作用机制。
1 材料与方法
1.1 动物
SPF 级 大 鼠,SD 雄 鼠,24 月 龄,长 沙 市 天 勤 生物技术有限公司,许可证编号:SCXK(湘)2019-0014。喂养、取材以及实验等操作均于广西百色市右江民族医学院动物实验中心(SPF 级)进行,适应环境一周后用于实验。本实验由广西百色市右江民族医学院伦理委员会审批通过后开展,整个实验过程均严格按照《关于善待实验动物的指导性意见》规范要求进行。
1.2 主要试剂
二苯乙烯苷提取物(成都克洛玛生物科技有限,公司批号:CHB180810),染料法定量PCR 预混液(莫纳生物有限,公司批号:100649),封闭用正常山羊血清(北京索莱宝科技有限公司,批号:SL038) 淀粉样β 蛋白溶液25-35(美国 SIGMA 公司,批号:118M4893V),MKK7、JNK 多克隆抗体(江苏亲科生物研究中心有限公司批号:AB08284512)。
1.3 主要方法
1.3.1 动物造模 将SD 雄性老年大鼠随机分为7组,通过海马体注射Aβ25-35溶液制造老年痴呆模型,用1%戊巴比妥(40 mg/kg)进行腹腔注射麻醉后,将大鼠头部置于脑立体定位仪上,前囟和后囟充分暴露后,使其呈同一条直线。剃毛备皮,无菌碘伏消毒备皮区域后,选定手术区域[8],颅骨打孔采用直径为0.3 mm 注射器垂直进针,左右海马区以1 μL/min 的速率注射5 μL 的Aβ25-35溶液,操作完成后,停留大约5 min 使针管尖端液体被动扩散 ,为避免液体溢出,应使其充分浸入溶液后缓慢出针,伤口保持清洁。假手术组在大脑上述区域注射相同量的生理盐水,正常组日常喂养,不进行任何其他操作[9]。
1.3.2 模型的筛选 采用被动回避实验行为学测试,作为筛选造模是否成功的标志。第一阶段将实验大鼠从亮室入口放入实验箱体,亮暗室两室之间入口互通,让动物自由适应10 min。将大鼠头朝室壁放入亮室,当大鼠完全进入暗室后,关闭入口后给予电刺激,使大鼠形成记忆。第二阶段进行被动回避测试,把大鼠由明室入口放入,将大鼠从明室进入暗室费时记为大鼠潜伏期,记录大鼠潜伏期以及5 min 内遭受电击的错误次数,不进入暗室的大鼠潜伏期记录为300 s,对各组大鼠实验数据进行分析。
1.3.3 分组及给药 将42 只雄性大鼠随机分组:正常组,假手术组,模型组,阳性药组,TSG 低、中、高剂量组,每组6 只。经造模筛选后,阳性药物组给予石杉碱甲0.15 mg/kg,配置TSG 溶液浓度分别为0.033 g/kg、0.1 g/kg、0.3 g/kg 后分别按照低、中、高剂量组进行给药,其余各组给予生理盐水25 mL/kg进行连续灌胃4 周[10]。
1.3.4 小鼠海马、皮层病理学形态观察(HE 染色)每组随机选取3 只大鼠,采用多聚甲醛心脏注射,置于冰上取出大鼠完整脑组织,参考海马分区图谱剥离大鼠两侧海马组织。采用多聚甲醛固定大鼠海马组织,设置切片厚度为4 μm,石蜡包埋后连续切片,60 ℃烘箱过夜,组织切片经脱蜡、脱水后,使用HE 染液进行病理学形态染色后封片,显微镜下观察各组大鼠脑组织中海马区域病理学形态改变特点并进行分析描述。
1.3.5 TUNEL 染色法 使用 TUNEL 染色技术对石蜡包埋的切片进行染色。将切片3 次脱蜡,乙醇脱水,NaCl 洗涤和PBS 洗涤。复水后,将切片与蛋白酶K(20 μg/mL)在室温下温育后制备TUNEL反应混合液,进行末端标记反应,浸入停止缓冲液15 min,封闭、染色、梯度脱水、透明、封片晾干后,镜下观察海马区细胞凋亡情况。
1.3.6 免疫组化法检测大鼠海马区MKK7、JNK 蛋白的表达 石蜡块切片4 μm,60 ℃烘箱过夜,石蜡切片经二甲苯脱蜡、无水乙醇梯度脱水后,用柠檬酸钠缓冲液作为修复液进行抗原预处理(100 ℃,20 min),过氧化氢阻断剂阻断10 min,血清封闭;孵育一抗MKK7(1∶150)、JNK(1∶150),4 ℃封闭过夜;孵育二抗; DAB 试剂染色,在镜下观察见染色充分后停止反应;苏木素复染自来水控制反应时长;经梯度脱水、透明后中性树胶封片;检测大鼠海马CA1 区中各蛋白的表达含量,将平均光密度值作为蛋白相对表达量的统计结果利用 Image Pro plus 6.0 对数据进行分析。
1.3.7 实时荧光定量聚合酶链式反应法(qRT-RCR) 实时荧光定量聚合酶链式反应法(qRT-RCR) 取各组大鼠海马组织50 mg,在预冷条件下在组织中加入1 mL Trizol 提取大鼠总RNA,检测所提总大鼠RNA 的浓度、纯度级(OD260/OD280)及完整性。逆转录为cDNA 后,按照预混液说明书上加入引物等配置反应体系。2-ΔΔCt法计算目标mRNA 的表达量,物序列见表1。
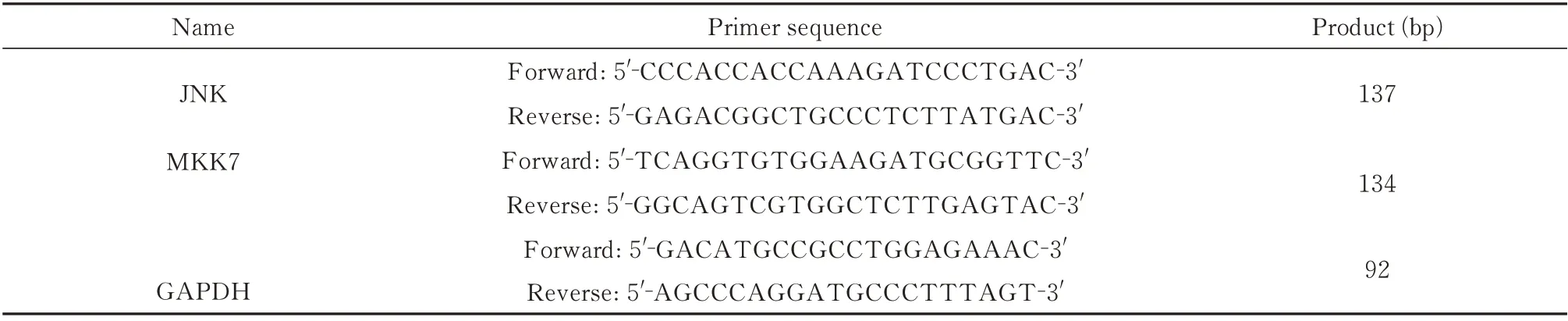
表1 引物序列Tab 1 Sequences of the primers
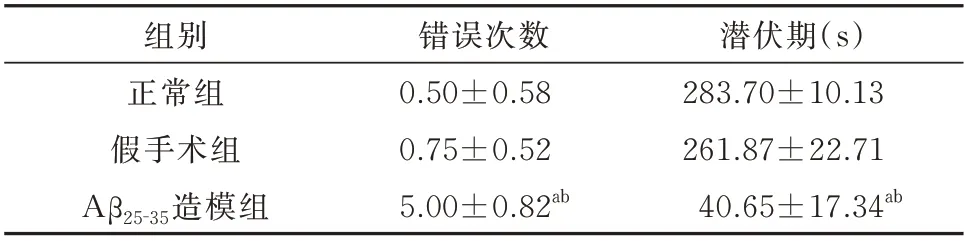
表2 行为学测试结果Tab 2 Behavioral test results
1.4 统计学处理
采用SPSS 23.0 进行数据处理和Image Pro plus6.0 进行图像分析。所有实验数据资料均采用均数±标准差()表示,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 被动回避实验行为学测试
观察实验数据表明,与正常组相比,模型组的错误次数明显增加(P<0.01),潜伏期明显缩短(P<0.05);与假手术组相比,模型组的错误次数显著增加(P<0.01),潜伏期显著缩短(P<0.05),将造模成功的大鼠进行后续的分组给药,正常组、假手术组不进行特殊操作。
2.2 HE 染结果
镜下观察可见,正常组和假手术组中海马CA1区,正常细胞数量较多,边缘清晰,细胞形态饱满丰富,核仁明显;与正常组和假手术组比较,模型组的大鼠海马CA1 区正常神经元细胞数目明显减少、神经细胞结构排列紊乱、细胞形态皱缩;与模型组相比,阳性药物组、TSG 低、中、高剂量组大鼠海马CA1 区神经细胞细胞数量相对增加,结构形态均有所改善;与阳性药相比,TSG 低、中、高剂量组大鼠海马CA1 区神经细胞数量以及细胞形态结构明显,见图1。
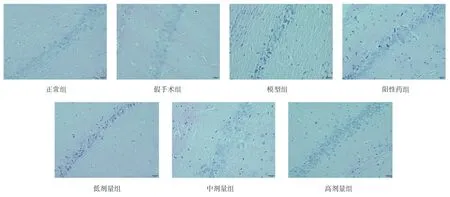
图1 各组海马CA1 区病理染色结果(×400,Bar=20 μm)Fig 1 The results of pathological staining in hippocampal CA1 region of each group(×400,Bar=20 μm)
2.3 TUNEL 染色结果
显微镜下观察可见,与正常组、假手术组比较,模型组海马CA1 区TUNEL 阳性染色细胞阳性细胞数量明显增加,细胞凋亡数量明显增加(P<0.05);与模型组相比,阳性药物组、TSG 低、中、高剂量组TUNEL 染色阳性细胞数量明显减少,细胞凋亡数量显著减少(P<0.05);与阳性药物组比较,TSG 低、中剂量组TUNEL 染色阳性细胞数相对增加(P<0.05),TSG 高剂量组TUNEL 染色阳性细胞数表达无明显变化,见图2。
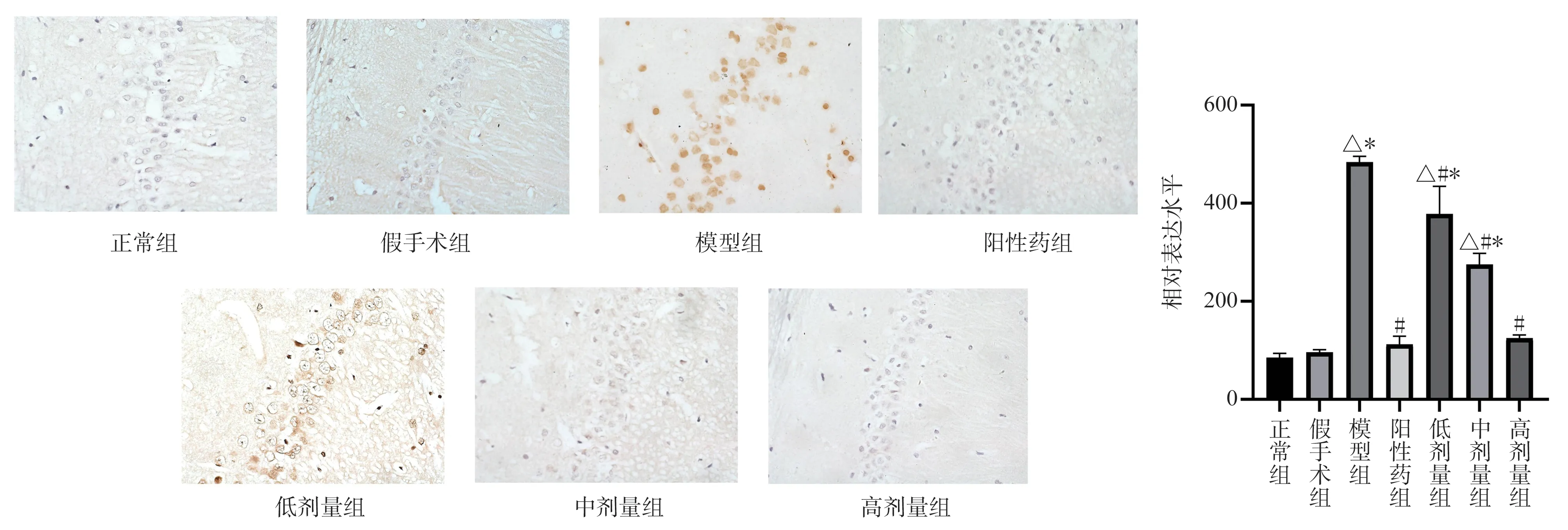
图2 各组海马区神经元TUNEL 染色结果(×400,Bar=20 μm)Fig 2 TUNEL staining of hippocampal neurons in each group (×400,Bar=20 μm)
2.4 免疫组化结果
显微镜下观察可见,与正常组、假手术组比较,模型组大鼠海马CA1 区MKK7、JNK 蛋白表达量呈现显著的高表达(P<0.05);与模型组相比阳性药物组、TSG 低、中、高剂量组海马区MKK7、JNK 蛋白表达量均明显下调(P<0.05);与阳性药物组相比MKK7 蛋白的表达量TSG 低剂量组有所升高(P<0.05)、中剂量组表达无明显变化、高剂量组表达量有所降低(P<0.05); JNK 蛋白的表达量,TSG 低、中剂量剂量组表达量上调(P<0.05),高剂量与阳性药物表达量相似,见图3、4。
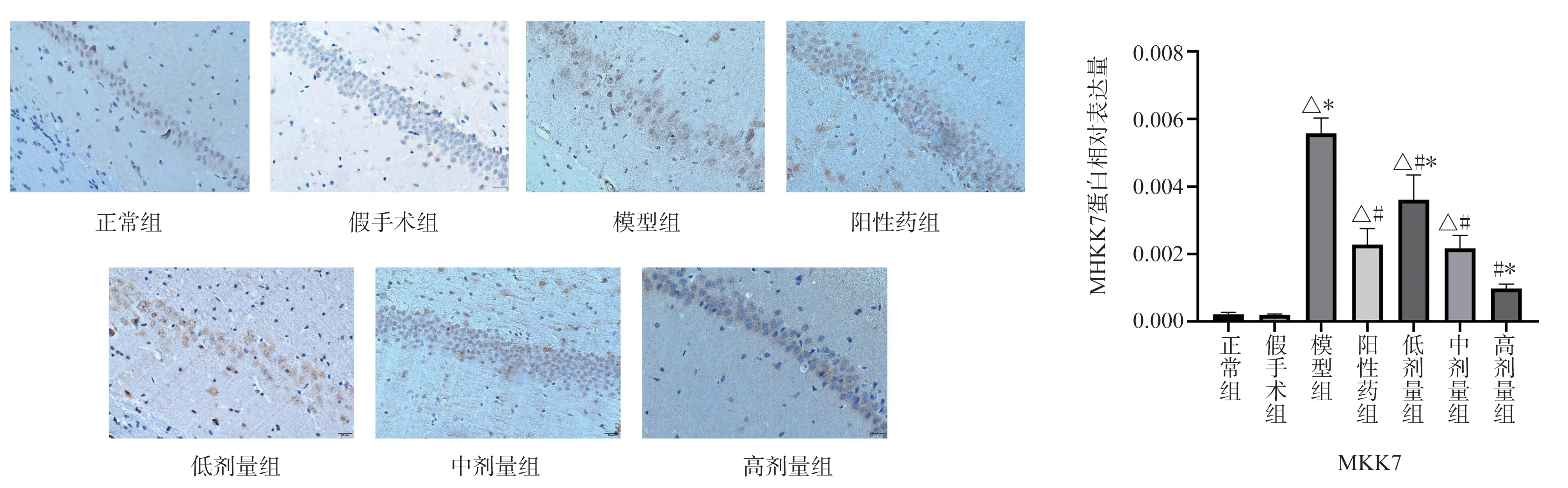
图3 大鼠海马区MKK7 蛋白表达的影响 (×400,Bar=20 μm)Fig 3 Expression of MKK7 protein in rat hippocampus (×400,Bar=20 μm)
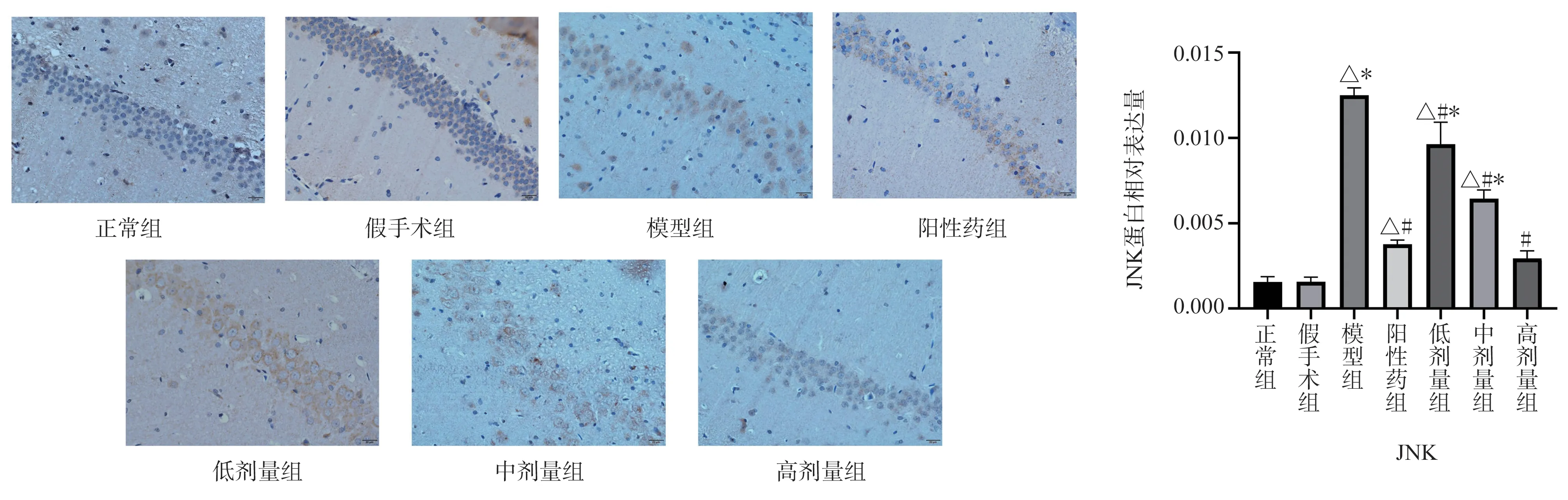
图4 大鼠海马区JNK 蛋白表达的影响(×400,Bar=20 μm)Fig 4 Expression of JNK protein in rat hippocampus (×400,Bar=20 μm)
2.5 qRT-PCR 结果
与正常组、假手术组比较,模型组MKK7、JNKmRNA 表达量显著增加(P<0.05);与模型组比较,阳性药物组中MKK7、JNK mRNA 表达量明显降低(P<0.05),TSG 中、高剂量组MKK7、JNK mRNA含量相对下调(P<0.05),TSG 低剂量组中MKK7 mRNA 含量相对下降(P<0.05)、JNK mRNA 的表达量出现小幅减少但差异无统计学意义;与阳性药比较,TSG 低剂量组MKK7、JNKmRNA 表达量相对增加(P<0.05),TSG 中、高剂量组MKK7、JNK表达量相对减少,但仅有TSG 高剂量组对JNK 的表达具有意义 (P<0.05),见图5。
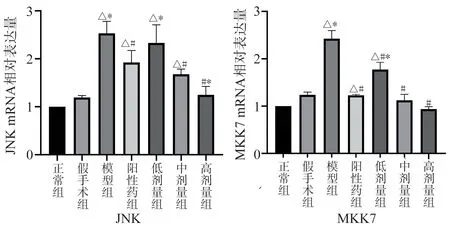
图5 各组大鼠脑组织MKK7、JNK mRNA 相对表达量Fig 5 The relative expression levels of ASK1,MKK7 and JNK mRNA in the brain tissue of rats in each group
3 讨论
AD 是一种基于神经系统方面的退行性改变疾病主要常发生在老年,其主要表现为记忆力减退、失语、失用、身份丧失、思维以及计算能力受损、性格和日常行为改变等[11]。其主要病理变化是Aβ 斑块的积累、神经原纤维缠结、胆碱能神经元丢失、炎症和代谢功能障碍[12]。相关研究表明,Aβ 积累及其相关炎症被认为是AD 大脑神经变性和神经元丢失之前的早期事件[13]。
MKK7 属于MAPKKs 家族的一员,在神经系统氧化应激、凋亡中起到关键的作用。MKK7 激活的同时受到磷酸化和泛素化的调节,活化的MKK7 可以激活JNK[14]。MKK7 是JNK 的特异性上游激酶,仅能激活JNK,是调节 JNK 级联活性最重要的MAP2K[15]。许多体外和体内研究已经报道了MKK7 对不同细胞内功能的重要性,如细胞生长、增殖、衰老、分化、转化,细胞周期调节和肿瘤代谢以及在神经系统中的作用[16]。凋亡刺激物如TNF-α,ROS 可以作用于MKK7 导致JNK 激活,从而诱导细胞的凋亡。有研究已经从MKK7、JNK 信号因子为切入点,研究药物对脑内疾病的作用及影响[17]
JNK 信号通路属于丝裂原活化蛋白激酶(MAPK)信号通路中的一个亚型在该信号通路发挥作用,在神经系统方面主要参与激活了Aβ 诱导的细胞凋亡、突触可塑性功能障碍和tau 过度磷酸化等,揭示了JNK 可以作为治疗AD 的一个靶点[18]。JNK 参与多种生理过程的关键介质,JNK 通路在中枢神经系统(CNS)中非常活跃,并且在细胞需要应对发育和成年期间的病理生理损伤时、损伤后的再生、修复,以及神经退行性疾病和神经细胞死亡都发挥重要作用[19]。其具有3 种主要亚型JNK1/JNK2/JNK3,C-Jun N-末端激酶3(JNK3) 被认为在以AD 为首的神经退行性疾病中起到了至关重要的作用,并且受上游激酶和磷酸酶的复杂调节[20]。在本实验中通过对大鼠注射Aβ25-35溶液模拟大鼠AD模型,通过免疫组化以及qRT-PCR 实验显示,与正常组及假手术组比较,在模型组中JNK 的表达量明显增高,提示JNK 的上调可能与Aβ 斑块的积累,诱导细胞凋亡导致的老年痴呆有关。通过TSG 给药治疗后,随着药物剂量的提高JNK 的表达了有所下降,提示TSG 可能通过下调JNK 的含量为作用靶点对AD 的治疗。
综上所述,实验推断TSG 可能通过下调MKK7、JNKmRNA 的转录及蛋白的表达从而达到对海马神经元损伤的保护和修复作用,但更具体的作用机制及靶点因子尚不清楚,需进一步的研究。
作者贡献度说明:
李悦:整体实验流程的设计与操作,后期数据的整理与分析,以及论文写作及文献查阅;康碧倩、何晓璇、胡睿、肖振、罗陈亮:协助完成实验;吴桂有:文献的查阅;黄忠仕:论文思路的修正,经费支持。
所有作者声明不存在利益冲突关系。

