基于铜死亡相关LncRNAs 评估胃癌预后、免疫浸润及中药预测
贠张君,沈 洋,米虽才,刘 铸,范秋月,刘爱琪,翟苗杰,侯 丽
(1.北京中医药大学东直门医院,北京 100700;2.厦门市中医院肿瘤科,福建 厦门 361015)
胃癌(gastric cancer,GC)是指原发于胃上皮的恶性肿瘤。据世界卫生组织最新的癌症统计数据显 示,2020 年GC 新 发 病 例 数108.9 万,死 亡 病 例 数76.9 万,发病率位居全球恶性肿瘤第6 位,死亡率居第3 位[1]。我国是GC 大国,2020 年全球约一半的新发和死亡病例在中国,严重威胁国民生命健康。GC 早期缺乏特异性症状,因此增加了GC 诊断和治疗的难度。临床分期可以在一定程度上评估患者的预后,帮助患者选择合适的治疗策略,但是其准确性仍有待提高。因此,有必要进一步探索具有更高预后效能的生物标志物,尽早识别高危患者,制定个体化治疗方案提高治疗有效率。
铜是机体内许多生物学过程所必需的辅助因子,但其浓度超过一定阈值时可具有一定毒性并诱导细胞死亡。Tsvetkov 等[2]的研究发现,细胞内过量的铜会引发线粒体脂质化蛋白的聚集和Fe-S 簇蛋白的不稳定,导致蛋白质毒性应激,抑制线粒体呼吸调节功能诱导细胞死亡。其不同于以往的调节性细胞死亡(如凋亡、铁凋亡和坏死),这种新型的细胞死亡方式称之为“铜死亡”。另外,研究表明依赖线粒体呼吸的细胞比依赖糖酵解的细胞对铜离子的敏感性高1 000 倍,铜死亡机制可能对线粒体呼吸敏感的细胞更加敏感。另一项研究发现,线粒体呼吸功能对GC 的进展具有重要作用,通过敲除TIMMDC1(位于线粒体内膜4 通道的膜蛋白)抑制线粒体呼吸可显著抑制GC 细胞的增殖和转移,线粒体呼吸功能可能在GC 的发生发展中具有重要作用[3]。同时,已有研究证实双硫仑(DSF)/铜复合物可通过多种途径抑制GC 细胞的增殖和转移[4,5],铜螯合剂还有望成为突破乳腺癌、肝癌、肺癌和黑色素瘤等多种癌症耐药瓶颈的治疗药物[6-9]。因此,深入研究铜死亡机制在GC 中的作用具有重要价值。
长链非编码RNAs (long noncoding RNA,LncRNAs)是一种长度大于200 个核苷酸但不编码蛋白质的RNA 转录本[10]。LncRNAs 调 控人类70%的基因表达,并可与DNA、RNA 和蛋白质相互作用,发挥增强或抑制作用[11]。虽然外显子组测序的临床应用识别了许多适合靶向治疗的蛋白质编码突变,但编码基因组在所有基因序列中占比不到2%[11]。越来越多的证据表明,在特定的细胞类型中LncRNAs 比mRNA 的调控作用更加精准,LncRNAs 的突变对癌症表型具有同等重要的驱动作用[12]。例如,某些LncRNAs 可以促进胆囊癌细胞增殖[13],抑制卵巢癌转移[14],并增强乳腺癌化疗耐药性[15]。LncRNA ABL 在GC 细胞中显著高表达,其通过结合APAF1 抑制caspase 酶活化促进GC 细胞增值[16]。因此,LncRNAs 对肿瘤发病机制及治疗策略的研究具有重大前景。
值得注意的是,铜死亡相关LncRNAs(cuproptosis -related LncRNAs,CRLs)对GC 的 治 疗、预后、免疫功能评估价值尚未得到系统性评价,铜死亡在GC 中的机制也待进一步阐明。另外,中药作为天然产物对于肿瘤治疗药物的研发具有重大价值,其活性成分不仅在铁死亡[17]、细胞焦亡[18]、细胞凋亡[19]等多个细胞死亡途径具有重要驱动作用,还具有安全、经济等优点。因此,本研究以铜死亡为切入点,筛选和评估CRLs 对GC 的预后价值,探讨CRLs 与免疫细胞浸润、免疫功能、化疗药物敏感性之间的关系,并预测对调控铜死亡相关基因(cuproptosis-related genes,CRGs)具有潜在调控作用的中药,以期为GC 的治疗、预后以及新药研发提供参考依据。
1 材料与方法
由于本研究是对先前公开发表的数据进行再次分析,因此无需额外的伦理批准。
1.1 数据获取
从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://portal.gdc.cancer.gov/projects/TCGA-STAD)获 取443 例GC 患 者 的 临床、转录组和肿瘤突变负荷数据,应用Perl 脚本获得标准化的基因表达矩阵,并对数据进行log2 处理。通 过GENCODE v40 的 注 释 文 件(https://www.gencodegenes.org/)区分转录组数据中的lncRNA 和mRNA。
1.2 CRLs 的识别
从 先 前 的 基 础 研 究[2,20,21]中,确 定16 个CRGs(NLRP3、ATP7B、ATP7A、SLC31A1、FDX1、LIAS、LIPT1、LIPT2、DLAT、PDHA1、MTF1、GLS、CDKN2A、DBT、GCSH、DLST),提取CRGs 在443例GC 中的表达数据。将CRGs 和LncRNAs 表达数据进行Pearson 相关性分析获得CRLs,筛选条件为|Pearson 相关系数|>0.4,P<0.001。Pearson 相关系数>0 代表正调控,若其<0 则为负调控。使用R“ggplot2 ”,“ggalluvial ”和“dplyr ”绘 制CRGs 和CRLs 的桑基图。
1.3 风险模型的构建和验证
按 照7∶3 将GC 患 者(All)随 机 分 为 训 练 组(Train)和验证组(Vali),在Train 组中通过单因素Cox 回归筛选与预后显著相关的CRLs(P<0.05),风险比(hazard rates,HR)用于确定CRLs 为危险因素(HR>1)或保护因素(HR<1)。随后应用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)回 归 对CRLs 再 次 筛选。为了避免过拟合,采用10 折交叉验证法选择最佳惩罚参数。最终将LASSO 回归识别的CRLs 纳入多因素Cox 比例风险回归中,通过计算每个CRL的风险评分构建风险模型。风险评分计算方法如下:

根据中位风险评分,将Train 组和Vali 组GC 患者分别分为低危组和高危组。通过Kaplan-Meier(KM)曲线比较高、低危组的总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS)评估风险模型预测GC 生存率的准确性,应用试者工作特征(receiver operating characteristic,ROC)曲线预测患者1、3、5 年生存率,以验证风险模型的准确性。
1.4 构建结合临床特征的列线图
为提高预测GC 生存率的准确性,应用R“survival“和“RMS”包构建结合临床特征的列线图,并使用ROC 曲线、校准曲线、C-指数评估列线图的准确性。随后,对年龄、性别、Stage 分期、Grade 分级、风险评分进行单因素和多因素Cox 回归分析,评估风险评分是否可做为GC 的独立预后因素。
1.5 临床亚组分析和主成成分分析
将GC 患者分为早期(Ⅰ~Ⅱ期)和晚期(Ⅲ~Ⅳ期),根据中位风险评分将早期和晚期组GC 患者分别分为高、低危组,使用KM 生存曲线比较高、低危组间生存率差异,以检验风险模型评估预后是否可独立于临床分期。通过主成分分析(principal component analysis,PCA)验证模型中CRLs 的分组能力。
1.6 功能富集分析
为探究风险评分与生物学过程的关系,根据中位风险评分将GC 患者分为高、低危组,使用R“limma”包识别组间差异基因,筛选条件为| log2 (fold change) |>1 和 FDR<0.05。应用“clusterProfiler”包对差异基因进行基因本体论(gene ontology,GO)富集分析(adjustedP< 0.05)。
1.7 免疫功能、突变基因及药物敏感性分析
根据中位风险评分将GC 患者分为高、低危组,基于单样本基因集富集分析(single-sample gene set enrichment analysis,ssGSEA)比较高、低危组中16种免疫细胞、13 条免疫相关通路的浸润评分以及免疫检查点抑制基因表达差异,以确定风险评分与免疫功能之间的关系。为评价风险评分与突变基因的关系,基于 GC 的肿瘤突变负荷(tumor mutational burden,TMB)数据,应用R“maftools”包将高、低危组中癌症相关基因的突变频率可视化。最后,使用“pRophetic”算法评估化疗/靶向药物的50%抑制浓度(IC50),以确定风险评分在预测药物敏感性方面的价值。组间差异均采用Wilcoxon 符号秩检验评估。
1.8 CRGs 的中药预测
将CRGs 导入Coremine 数据库(https://coremine.com/medical/#search)映射出具有潜在调控作用的中药,筛选条件为Significance<0.01。通过古今云医案平台(https://www.yiankb.com/)将中药的性味归经及功效分布可视化展示。
1.9 统计学处理
使用Pearson 相关性分析确定CRLs。在Train组中,通过单因素Cox、Lasso、多因素Cox 回归构建风险模型。Train 组和Vali 组之间的临床特征差异通过卡方检验进行。风险模型的准确性通过timeROC 曲线和C-index 评估。组间免疫浸润和化疗药物敏感性差异均采用Wilcoxon 符号秩检验评估,R 语言为4.2.2 版本。
2 结果
2.1 CRLs 的获取
本研究使用TCGA-STAD 队列中443 例GC 的临床数据,其临床特征见表1。

表1 443 例GC 的临床特征Tab 1 Clinical characteristics of 443 gastric cancer
从TCGA-STAD 队列中仅获得407 例GC 的转录组数据,包括19 939 个mRNAs 和16 876 个lncRNAs。通过Pearson 相关性分析筛选出429 个CRLs,见图1。

图1 CRGs 与LncRNAs 之间联系的桑基图Fig 1 Sankey diagram of the association between CRGs and LncRNAs
2.2 风险模型的构建和验证
在删除临床数据缺失的GC 患者后,共371 例患者被随机分配到Train 组(n=260)和Vali 组(n=111),两组之间的临床特征无差异,具有可比性,见表2。在Train 组中,通过单因素Cox 分析获得27 个与生存预后相关的CRLs(图2A),其中4 个为保护基因(HR<1),23 个为危险基因(HR>1)。随后根据LASSO 回归和多因素Cox 回归分析(图2B、C),最 终 确 立7 个CRLs(AP001107.9、VCAN-AS1、AC016394.2、LINC02675、AC100814.1、HAGLR、LINC01094)纳入风险模型。风险模型中7 个CRLs和CRG 之间的相关性见图2D。
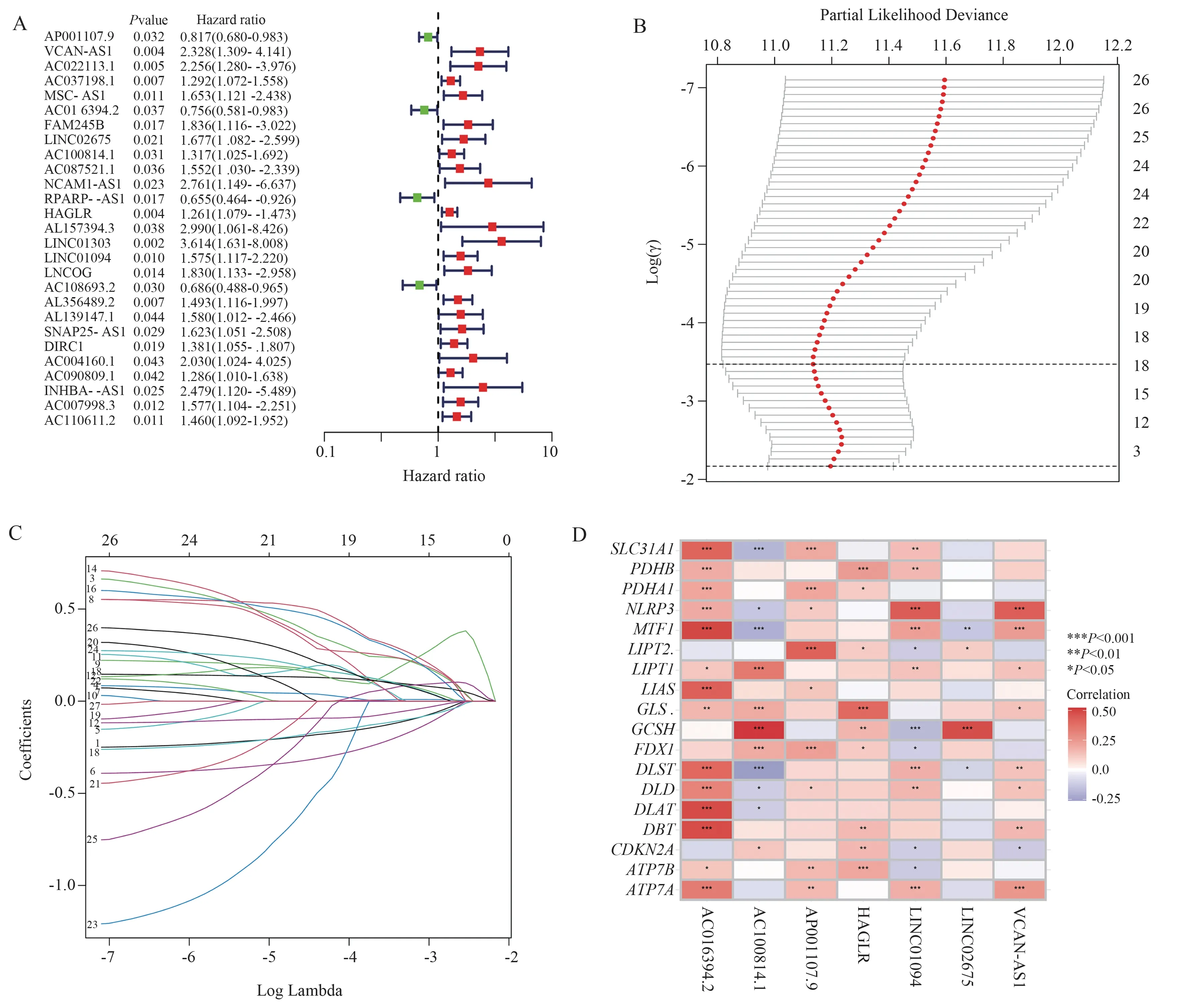
图2 风险模型的构建Fig 2 Construction of the risk model
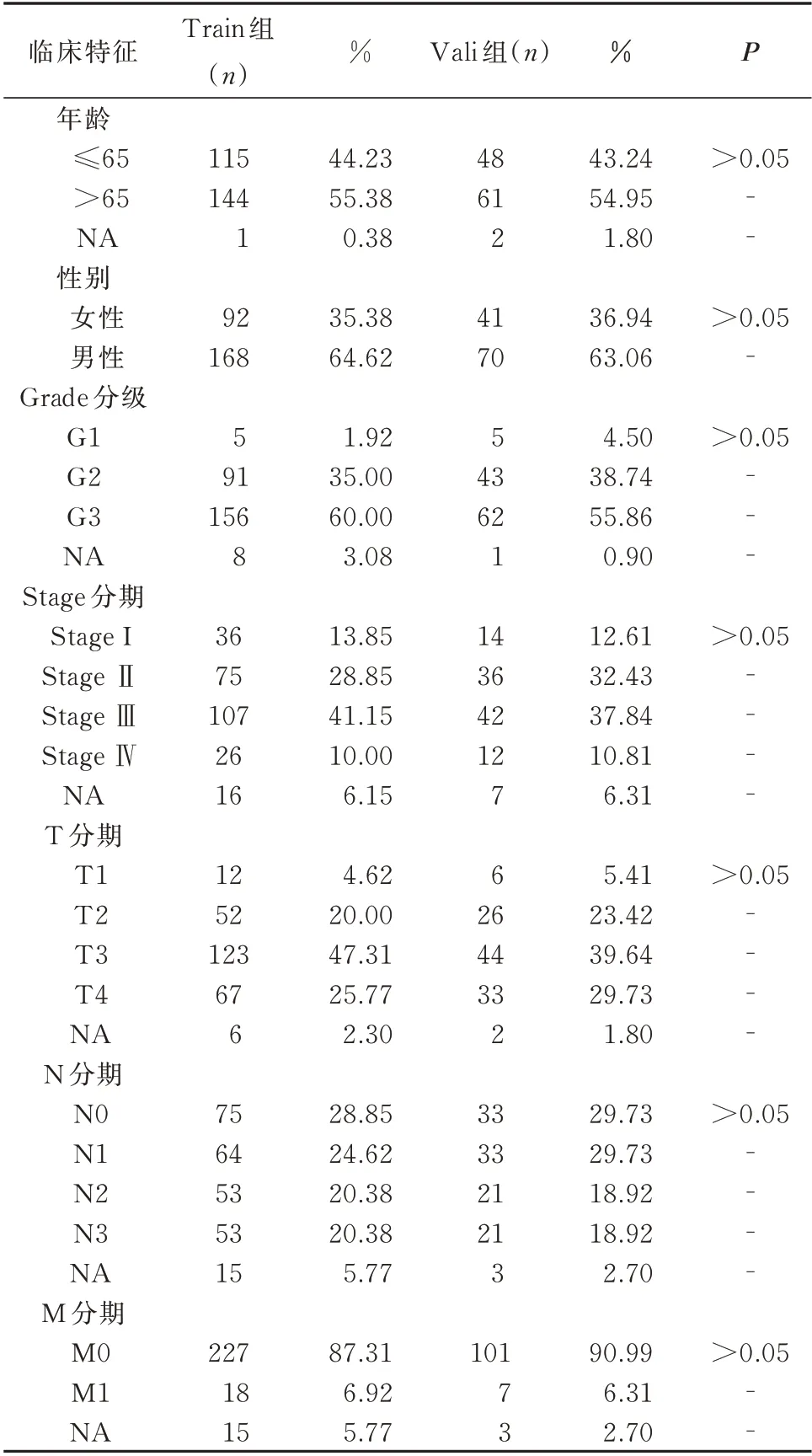
表2 Train 组和Vali 组GC 患者的临床特征比较Tab 2 The comparison of clinical characteristics of GC patients between the Train and Vali groups
通过计算7 个CRLs 的风险评分构建风险模型,风险评分通过以下公式计算:风险分数=(-0.215× AP001107.9 的 表 达 水 平)+(0.688 ×VCAN-AS1 的 表 达 水 平)+(- 0.416 ×AC016394.2 的表达水平)+(0.459 × LINC02675的表达水平)+(0.253 × AC100814.1 的表达水平)+(0.196 × HAGLR 表达水平)+(0.583 ×LINC01094 的表达水平)。根据中位风险分数,将Train 组(图3A)和Vali 组(图3B)的GC 患者分别分为高危组和低危组。两组中高危组死亡人数均显著高于低危组(图3C、D)。Train 组(图3E)和Vali 组(图3F)中高、低危组间的CRLs 的表达量存在差异,2 个 保 护 性lncRNAs(AP001107.9 和AC016394.2)在低危组的表达量增加,5 个风险lncRNAs(VCAN-AS1、LINC02675、AC100814.1、HAGLR、LINC01094)在高危组增加。生存分析显示高危组OS 和PFS 显著差于低危组(图3G~J,P<0.05)。风 险 模 型 预 测Train 组1、3、5 年 生 存 率 的AUC 为0.720、0.682 和0.711(图3K),预测All 组1、3、5 年生存率的AUC 为0.713、0.620 和0.676(图3M)。
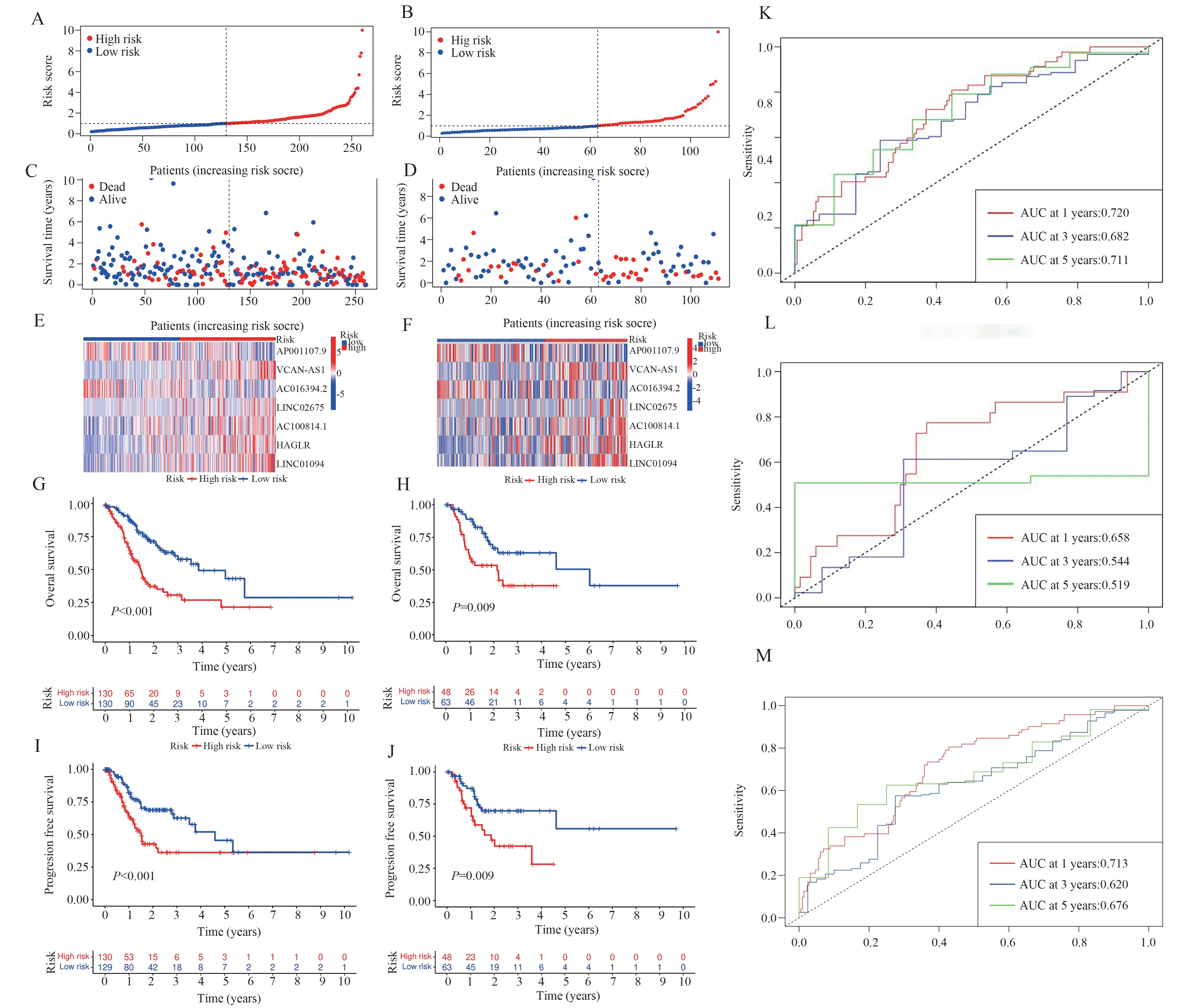
图3 风险模型的预后效能Fig 3 Prognostic efficacy of the risk model
2.3 风险模型的独立预后分析和列线图构建
通过单因素Cox 回归分析和多因素Cox 回归分析检验风险模型的独立预后效能。结果显示,风险模型可以独立于其他临床特征评估GC 的预后(P<0.001)(图4A、B)。结合临床特征和风险评分进一步构建列线图。如图所示,假如患者总分为310 分,其在未来1、3、5 年内存活的概率分别是75%、39%和24.9%(图4C)。1、3、5 年的校准曲线表明列线图具有准确的预后能力(图4D)。风险模型比年龄、性别、TNM 分期、Grade 分级的预后效能更准确(图4E)。在Train 组(图4F)和Vali 组(图4G)中,基于列线图预测GC 患者的OS 明显高于其他预测因子。因此,结合临床特征的风险模型可以更好的预测GC 患者的生存预后。
2.4 临床亚组分析和PCA 分析
将 GC 患者按Stage 分期分组后,在Ⅰ-Ⅱ期和Ⅲ-Ⅳ期亚组中,高危组GC 的生存率显著低于低危组(P<0.05)(图5A、B),表明风险模型评估预后的能力可独立于临床分期。另外,PCA 分析显示,基于所有基因(图5C)、CRGs(图5D)或CRLs(图5E)的表达量不能明显区分高危组和低危组。然而,根据风险模型中7 个CRLs 的表达,可以将GC 患者显著区分为高危组和低危组(图5F)。因此,风险模型可以更好的对GC 进行预后风险评估。
2.5 差异基因的GO 富集分析
共获得304 个差异基因,差异基因的GO 富集分析显示,生物学过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)均显著富集在细胞外基质(extracellular matrix,ECM)。见图6。
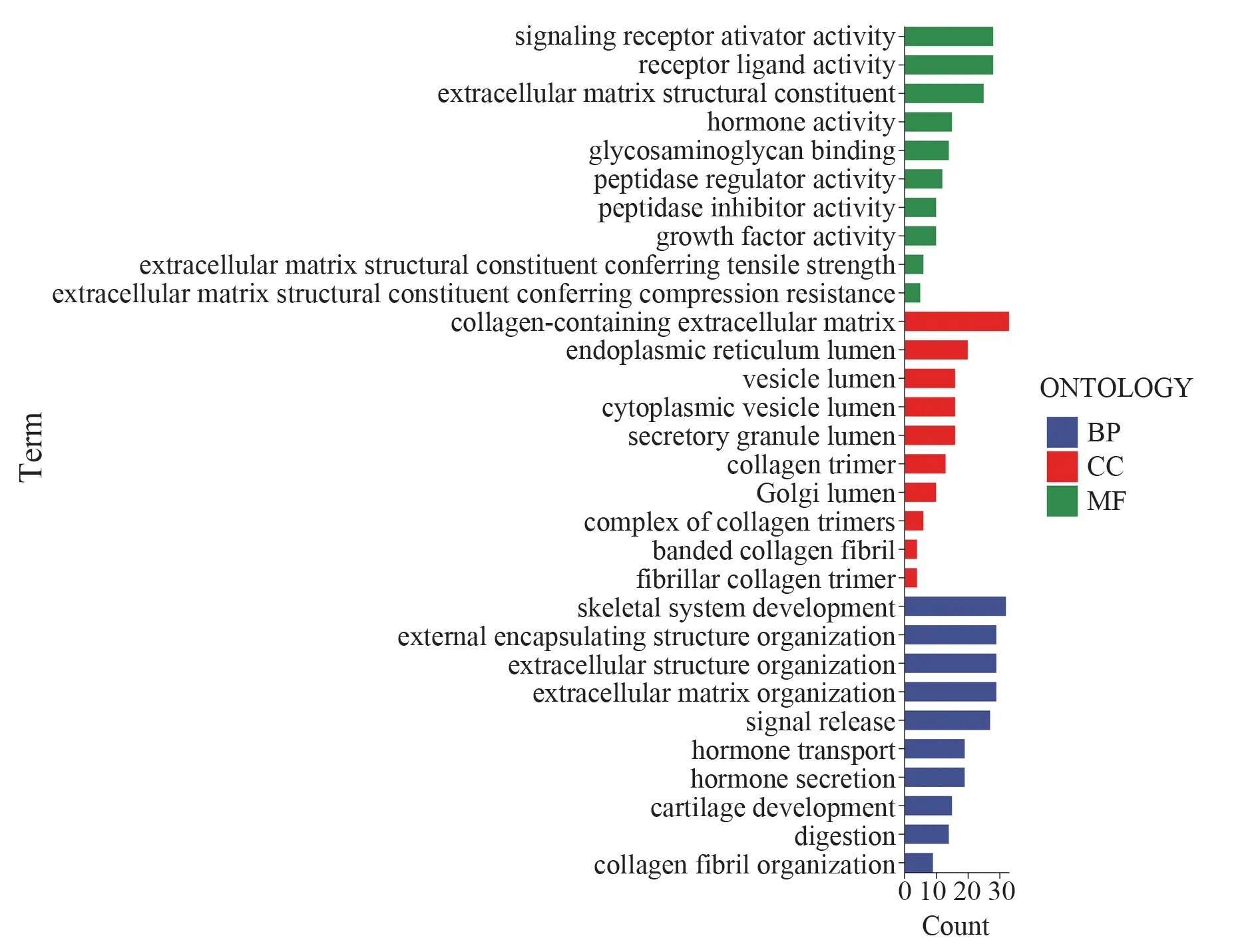
图6 差异基因的GO 富集分析Fig 6 GO enrichment analysis of differential genes
2.6 风险模型的综合免疫浸润分析
ssGSEA 分析显示,高危组抗体药物偶联物(aDCs)、巨 噬 细 胞(Macrophages)、中 性 粒 细 胞(Neutrophils)、浆细胞样树突细胞(pDCs)、T 辅助细胞(T helper cells)、肿瘤浸润的淋巴细胞(TIL)、调节性T 细胞(Treg)评分显著高于低危组(P<0.05)(图7A)。免疫功能差异分析显示,抗原呈递细胞共刺激(APC costimulation)、副炎症(parainflammation)、趋化因子受体(CCR)等在高危组显著上调(P< 0.05)(图7B)。另外,22 个免疫检查点基因在高危组中显著高表达(P< 0.05)(图7C)。总之,高危组的免疫细胞评分、免疫功能评分和免疫检查点基因的表达均高于低危组,风险模型可以用于预测GC 患者的免疫状况。

图7 风险模型与肿瘤免疫微环境的关系Fig 7 Relationship between risk model and tumor immune microenvironment
2.7 癌症相关基因突变和药物敏感性分析
高、低危组中前20 个突变基因见图8,高危组(图8A)中突变频率最高的前五个基因是TNN(47%)、TP53(46%)、MUC16(24%)、CSMD3(24%)和LRP1B(23%)基因。TNN(53%)、TP53(38%)、MUC16(36%)、ARID1A(32%)和LRP1B(30%)是低风险组(图8B)中突变频率最高的前五个基因。高危组中仅抑癌基因TP53 的突变率较高(46%对38%),而低危组中其他癌症相关基因的突变率相对较高。
两组间138 种化疗/靶向药物的敏感性显示,13种药物在组间表现出差异性(图9A~M,图10A~M),高危组对TAK1 抑制剂((5Z)-7-Oxozeaenol)、IPI3K/mTOR 抑 制 剂(BEZ235)、CDKs 和PKC 抑制剂(CGP-60474)、阿糖胞苷(Cytarabine)、达 沙 替 尼(Dasatinib)和 LCK/SRC 抑 制 剂(WH-4-023)更加敏感;低危组对HSP 抑制剂(AUY922)、HER2 抑 制 剂(CP724714)、Wnt/β-catenin /PPAR 抑 制 剂(FH535)、AKT 抑 制 剂(GSK690693)、重组人肿瘤坏死因子相关凋亡诱导配体变体(rTRAIL)、HSP90 抑制剂(SNX-2112)和 p38 MAPK 抑制剂(TAK-715)更加敏感。
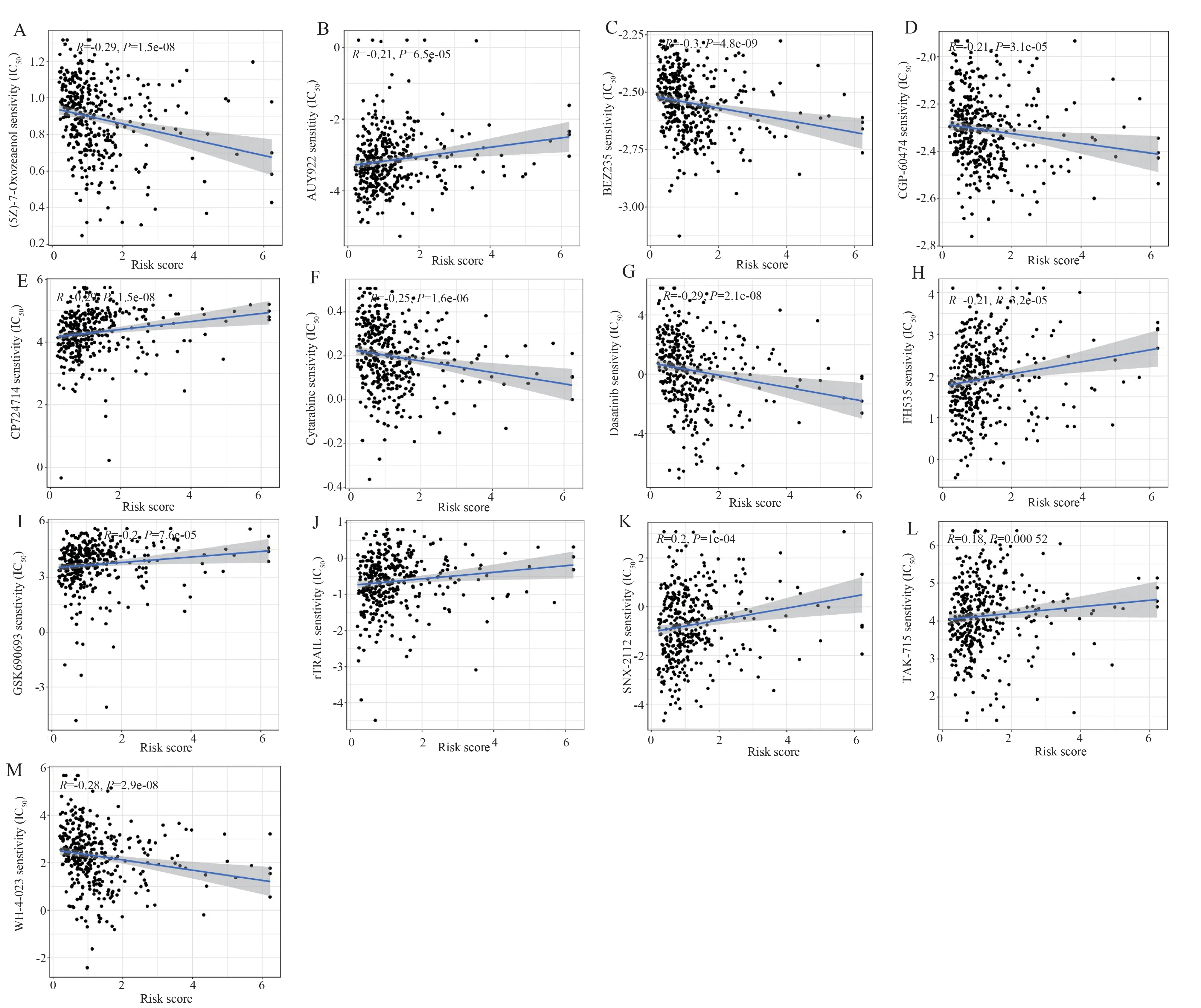
图9 13 种药物IC50值与风险评分的相关性散点图Fig 9 Scatter plot of correlation between IC50 values and risk scores for 13 drugs
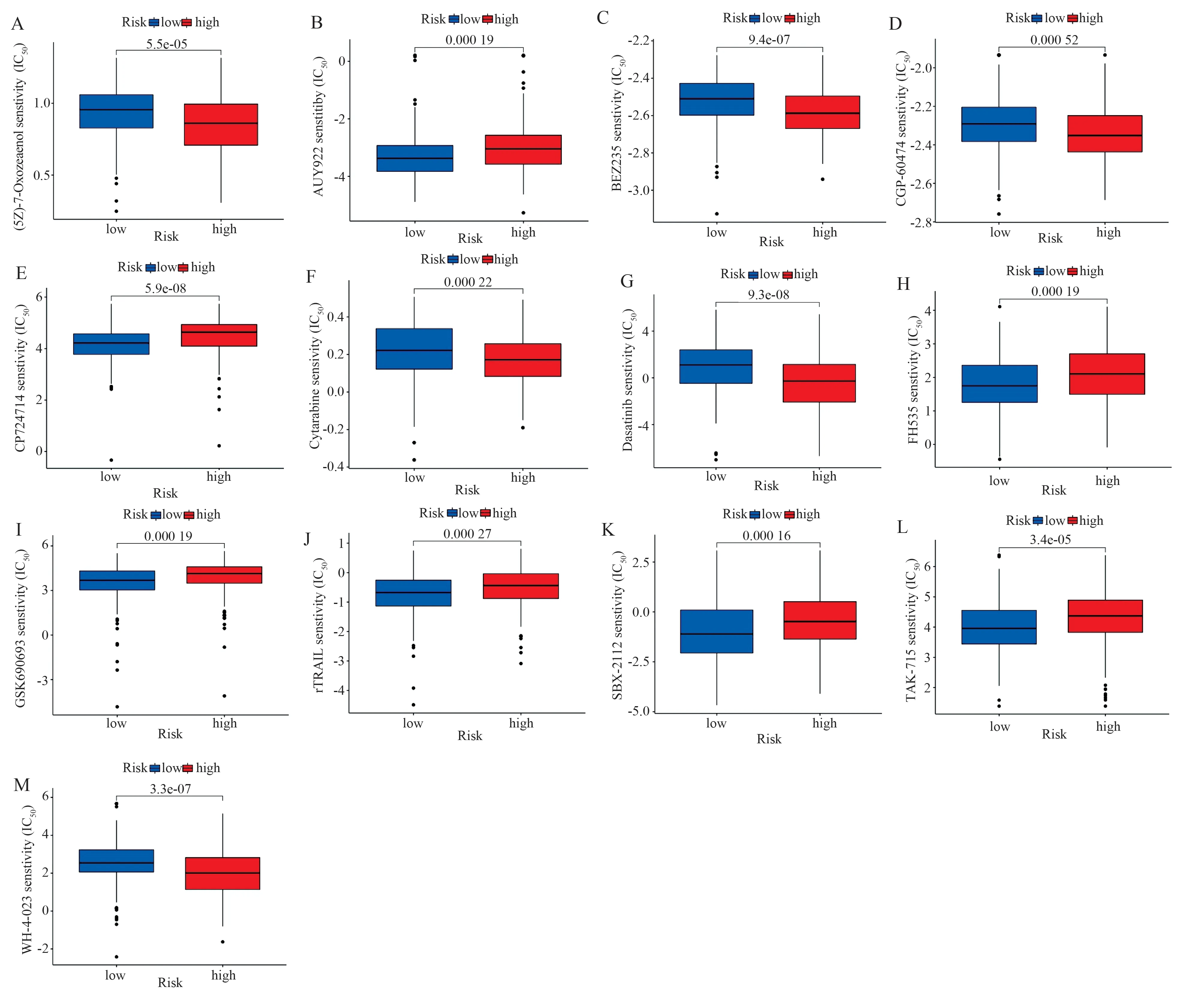
图10 高、低风险组之间13 种药物敏感性差异的箱线图Fig 10 Boxplot of differences in sensitivity to 13 drugs between high and low risk groups
2.8 CRGs 的中药预测
共获得13 个CRGs 映射出的58 味中药,见表3,上述中药对CRGs 具有潜在调节作用。调控CRGs的中药药性主要偏寒(图11A),药味偏甘、苦、平(图11B),主归肝、脾、肺经(图11C),功效以清热解毒、活血止痛(图11D)为主。

表3 CRGs 的中药预测Tab 3 Prediction of copper death genes in Chinese medicine
3 讨论
细胞死亡可分为意外性细胞死亡(accidental cell death,ACD)和调节性细胞死亡(regulated cell death,RCD),后者又分为凋亡性RCD 和非凋亡性RCD[22-24]。近三十多年来,临床肿瘤学一直致力于研发通过诱导细胞死亡来消除癌细胞的治疗策略。现有研究表明,癌细胞凋亡抵抗是导致癌症治疗失败的主要原因,通过非凋亡性RCD 途径来消除癌细胞比凋亡性RCD 途径更加有效[22-25]。铜死亡是一种新发现的死亡方式,与线粒体呼吸能密切相关,属于非调节性RCD 的一种[2]。基于线粒体呼吸调节对GC 细胞的重要作用[3],通过铜死亡机制诱导GC 细胞凋亡似乎是有前景的研究策略,因此深入探索铜死亡机制在GC 中的作用具有重要价值。
本研究基于TCGA 数据库433 例GC 患者的临床和转录组数据,最终确定7 个与预后显著相关的CRLs (AP001107.9、VCAN-AS1、AC016394.2、LINC02675、AC100814.1、HAGLR、LINC01094),根据每个CRL 的表达水平和相关回归系数计算风险评分构建风险模型,风险模型可以更好的预测GC 生存预后。风险模型中部分CRLs 对GC 的预后效能在先前的研究中已被证实。如Li 等[29]研究发现,lncRNA VCAN-AS1 在GC 细胞中显著高表达并与GC 不良预后显著相关,与野生型p53 表达呈负相关。VCAN-AS1 与eIF4A3 结合后可显著下调TP53 表 达 促 进GC 细 胞 增 殖 和 转 移[26]。LncRNA HAGLR 在GC 组织和细胞中表达水平均升高,并与较差的生存期相关[27]。其通过影响乳酸脱氢酶a 的代谢导致GC 细胞对5-Fu 耐药。同时,HAGLR 在乳腺癌、肝癌、食管癌等多种肿瘤的增殖和转移中也发挥了重要作用[28-30]。另外两项基于自噬相关LncRNAs 建立的GC 预后模型中同样纳入了HAGLR 和LINC01094[31,32],这 表 明 自 噬 和 铜 死亡之间可能存在联系。Polishchuk 等[33]的研究证实了这一观点,敲低ATP7B 可激活自噬相关基因保护细胞免受铜诱导的凋亡,因此自噬与铜死亡的关系值得进一步深入研究。然而,AP001107.9、AC016394.2、LINC02675 和AC100814.1 在GC 中的作用尚未报道,上述LncRNs 在GC 中的潜在作用仍需进一步探索,其有望成为评估GC 治疗和预后的生物标志物。
肿瘤免疫微环境对GC 免疫治疗敏感性和预后评估十分重要。本研究综合免疫浸润分析显示,高危组GC 患者存在丰富的免疫细胞浸润,如肿瘤浸润淋巴细胞、巨噬细胞、中性粒细胞、调节性T 细胞等。一方面,高危组较差的生存预后可能与肿瘤免疫微环境有关。肿瘤免疫微环境大致可分为三种类型[34,35]:(1)免疫炎症型:肿瘤内部有大量免疫细胞浸润;(2)免疫排斥型:虽然有丰富的免疫细胞存在,但免疫细胞位于肿瘤细胞间质,不能穿透间质到达肿瘤实质;(3)免疫沙漠型:肿瘤内部和周围缺乏免疫细胞浸润。结合GO 富集分析结果,两组间差异基因显著富集在ECM,因此高危组患者体内可能为免疫排斥型肿瘤微环境,此环境下丰富富集的免疫细胞无法穿透基质到达肿瘤实质对癌细胞进行有效的免疫清除,从而使其生存预后更差。另一方面,高危组GC 肿瘤浸润淋巴细胞、巨噬细胞、中性粒细胞、调节性T 细胞水平升高预示着较差的生存预后。肿瘤浸润淋巴细胞包括CD8+T 细胞、CD4+T 细胞、调节性T 细胞、肿瘤相关巨噬细胞和肿瘤相关中性粒细胞等[36]。研究发现,肿瘤患者高水平的巨噬细胞、中性粒细胞和调节性T 细胞常提示较差的生存预后[36]。Thompson 等[37]发现预后较差的GC 患者CD8+T 细胞浸润水平较高。本研究同样显示高危组患者CD8+T 细胞浸润程度更高,但两组之间的差异并无统计学意义。就调节性T细胞而言,同样有研究表明其外周血水平的升高预示着GC 患者较差的生存期[38]。此外,本研究发现高危组患者中性粒细胞浸润显著增加,这可能归因于中性粒细胞高表达免疫抑制分子程序性死亡配体1 (PD-L1),使肿瘤逃避免疫监视而促进肿瘤进展[39]。在免疫功能方面,高危组副炎症水平显著升高。副炎症是一种低度炎症,位于典型炎症和稳态之间,由于组织应激或功能障碍引起的适应性反应。Aran 等[40]发现,肿瘤中高水平的副炎症与p53缺失呈正相关,副炎症可能是使p53 途径失活的主要驱动力之一,并且高副炎症水平的癌症预后不良。本研究中癌症相关基因突变频率同样表明高危组(即高副炎症水平)TP53 突变频率高于低危组(46%vs38%)。另外,22 个免疫检查点基因在高危组中呈现出高表达,部分基因已被发现是GC 的潜在免疫治疗靶点。LAG3 是FDA 批准第三种免疫检查点抑制剂的靶点。先前的研究也提供了ICOS[41]、CD28[42]和NRP1[43]是GC 潜在免疫治疗靶点的证据,高风险评分的GC 可能从上述22 个免疫检查点抑制剂的治疗中获益更多。
在调控CRGs 的58 味中药中,功效以清热解毒、活血止痛为主。其中,FDX1[2]是调控铜死亡机制的关键基因,作用于FDX1 的潜在中药为螺旋藻、蛇床子。螺旋藻主要成分螺旋藻晒多糖具有抗氧化损伤、调节免疫等功能,可显著抑制GC 细胞增殖[44,45]。蛇床子的主要活性成分蛇床子素具有抗氧化应激、抗血栓、抗癌等作用,其可作用于磷脂酰肌醇3 激酶/Akt 蛋白激酶 B 通路[46]、胱天蛋白酶-3 依赖的凋亡通路[47]诱导GC 细胞凋亡。然而,上述中药是否可通过调控FDX1基因调控铜死亡机制诱导癌细胞死亡的研究尚未报道,螺旋藻及蛇床子对铜死亡机制的调控作用值得深入探索。
综上所述,本研究基于7 个CRLs 建立了GC 的预后模型,该模型预后GC 的效能优异,并且可评估GC 患者免疫功能、免疫检测点基因表达及其对13种化疗药物的敏感性,螺旋藻及蛇床子等中药可能对铜死亡机制的调节具有潜在作用。
作者贡献度说明:
贠张君、沈洋:文章设计、数据分析及手稿撰写;米虽才、刘铸、范秋月、刘爱琪:相关文献搜集与整理,数据分析;翟苗杰:文章格式检查;侯丽:提供整体思路和修改意见。
所有作者声明不存在利益冲突关系。

