佛甲草正丁醇提取物抗炎镇痛作用的实验研究
石 烽,付琼安,蔡佳婷,郑崇博,麻海娟,吴丽珍,曹性玲
(1. 赣南医学院第一临床医学院;2. 赣南医学院基础医学院机能实验室,江西 赣州 341000)
炎症是因损伤或感染引起的一种非特异性先天免疫,涉及体感、免疫细胞、分子介质、血管系统等,可导致多种疾病。疼痛是炎症的主要特征之一,强度随着炎症程度的增加而增加,尽管疼痛与炎症之间相互作用的神经生物学机制尚未完全了解,但炎症因子在疼痛中的作用已得到明确证实,损伤会引起炎症细胞活化,大量致炎因子的释放,致使疼痛加重[1-2]。
炎症可分为急、慢性炎症,以红、肿、热、痛为主要表现,甚者可引起功能障碍,严重影响患者生活质量。目前临床对于炎症的治疗仍是药物治疗,非甾体类抗炎药、阿片类药物等为主,虽有疗效,但不良反应多,且易引起耐受。与当前临床上常用的镇痛药物相比,传统中草药具有不良反应少,作用持续等优点[3]。
佛甲草(Sedum lineareThunb.,SLT)是景天科植物,味甘、寒、无毒,具有清热、解毒、消肿、利胆等功效,可用于治疗咽喉肿痛、痈肿、疔疮、烫伤、蛇咬伤、痢疾、黄疸等[4]。前期研究结果证实佛甲草提取物可有效缓解弗氏完全佐剂(Complete freund's adjuvant,CFA)诱导大鼠的足趾肿胀,且可能与SLT 抑制炎症因子,调节免疫功能有关[5]。但佛甲草正丁醇提取物(Sedum lineareThunb. n-butanol phase, SLNP)是否具有抗炎、镇痛作用,其可能的机制是什么?我们尚且不知,需进一步探究。因此,本研究拟在前期研究的基础上,通过二甲苯致小鼠耳廓肿胀、棉球致小鼠肉芽增生、结扎大鼠坐骨神经、弗氏完全佐剂诱导的大鼠踝关节炎、冰醋酸致小鼠疼痛(扭体法)及热辐射致痛(甩尾法)等多种典型炎症模型探讨佛甲草正丁醇提取物是否具有抗炎镇痛的作用,并测定炎症因子和氧化应激的相关分子的表达初步探讨其可能的机制。现报告如下。
1 材料与方法
1.1 材料
1.1.1 药物佛甲草正丁醇提取物:佛甲草全草(干的)用体积分数70%乙醇水溶液浸提24 h,过滤、浓缩。浓缩液再经等体积的石油醚、乙酸乙酯、正丁醇萃取,分别得到佛甲草石油醚提取物、佛甲草乙酸乙酯提取物、佛甲草正丁醇提取物,剩余为浸提后的水相。正丁醇提取物再浓缩后经真空干燥及冷冻干燥后得到佛甲草正丁醇提取物。吗啡购自东北制药集团(批号:H20057384)。地塞米松磷酸钠注射液(Dexamethasone, DXMS)购于天津药业焦作有限公司(批号:09112411)。
1.1.2 动物Sprague-Dawley(SD)大鼠,SPF 级,雄性,体质量(180±20) g;昆明种小鼠,SPF级,雌性,体质量(20±2) g,均由湖南斯莱克景达实验动物有限公司提供,动物合格证号:SCXK(湘)2009-0004。实验前适应性饲养1周。
1.1.3 试剂弗氏完全佐剂(CFA)购自Sigma 公司产品。白细胞介素-6(Interleukin-6, IL-6)酶联免疫试剂盒;白细胞介素-10(Interleukin-10, IL-10)酶联免疫试剂盒;超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)、丙二醛(Malondialdehyde,MDA)检测试剂盒均购自南京建成生物工程研究所;二甲苯、冰醋酸购自天津市福晨化学试剂厂。
1.1.4 仪器足趾容积测量器(Ugo basile,意大利);动态足底触觉仪(Ugo basile,意大利);BS224S电子天平(北京赛多利斯天平有限公司);连续光谱多功能酶标仪(美国热电);中佳KLC-2046型低速冷冻离心机(科大创新股份有限公司中佳分公司);自制辐射热测痛仪。
1.2 方法
1.2.1 抗炎作用
1.2.1.1 二甲苯致小鼠耳廓肿胀模型采用二甲苯诱导小鼠耳廓肿胀法,取雄性小鼠50 只,体质量18~22 g,随机分为5组,每组10只,分别为:模型对照组(Vehicle 组)、地塞米松阳性对照组(DXM 组)、30 mg·kg-1SLNP组、100 mg·kg-1SLNP组和300 mg·kg-1SLNP 组,各组按0.1 mL·(10 g)-1给药,除模型对照组、阳性对照组外其余各组分别灌胃相应药物,地塞米松阳性对照组腹腔注射2.5 mg kg-1地塞米松,模型对照组灌胃等量生理盐水,每日1次,连续给药3 d。末次给药30 min 后,用二甲苯50 μL 均匀涂布在小鼠右耳背腹两侧,1 h 后处死小鼠,剪下左右两耳,在两耳同一部位打下直径为8 mm的圆形耳片组织块称重,计算小鼠耳廓的肿胀率。同时取出小鼠的脾脏和胸腺,计算脾脏及胸腺指数。计算公式为:肿胀率(%)=(致炎后的右耳片质量-对照的左耳片质量)/对照的左耳片质量×100。脏器指数=脏器重量(mg)/体重(g)。
1.2.1.2 小鼠棉球肉芽肿模型制作重量为10 mg的棉球,高压灭菌。取雄性小鼠50只,体重(20±2) g,分组和给药方法同1.2.1.1。将小鼠腹腔注射0.1 mL·(10 g)-15%水合氯醛麻醉,背部切口,将2个精密称定重量的灭菌棉球,分别植入小鼠两侧腋窝皮下。术后次日灌胃给药,各组按0.1 mL·(10 g)-1分别给药,除模型对照组(Vehicle 组)、地塞米松阳性对照组(DXM 组)外其余各组分别灌胃相应药物,阳性对照组腹腔注射地塞米松2.5 mg·kg-1,模型对照组灌胃给予等体积的生理盐水,每天1次,连续3 d,第3天给药后1 h,处死小鼠剥离出肉芽肿棉球,剔除脂肪组织,于60 ℃烘干6 h,精密称重,其重量减去原棉球重量即为肉芽肿胀质量,比较各组肉芽肿胀质量。同时取出小鼠的脾脏和胸腺计算脾脏和胸腺指数。计算公式:脏器指数=脏器重量(mg)/体重(g)
1.2.1.3 弗氏佐剂关节炎模型取SD 大鼠45 只,体质量(180±20) g,随机分为5 组,每组9 只,分别为:正常对照组(Ctrl 组)、模型对照组(Vehicle 组)、30 mg·kg-1SLNP组、100 mg·kg-1SLNP组和300 mg·kg-1SLNP 组。除正常对照组大鼠左后足跖皮内注射等容积生理盐水外,其他大鼠左后足跖皮内注射CFA 100 μL致炎,于致炎后一天各组按0.1 mL·(100 g)-1分别灌胃给药,正常对照组与模型对照组灌胃等体积生理盐水,连续7 d。采用肢体肿胀测量仪测定足趾肿胀度,在大鼠脚踝处用记号笔画上标记,待大鼠安静后将其后爪缓慢放入标准测量水杯中,当记号线与液面平齐且水面较稳定时,踩下脚踏板并记录数值,重复记录3 次测量数值。测定给药后第7 d的足趾容积。
1.2.2 镇痛作用
1.2.2.1 坐骨神经分支选择性损伤(Spared nerve injury, SNI)模型于大鼠后肢上缘切开皮肤,分离肌肉,暴露坐骨神经主干及其下的分支——胫神经、腓总神经和腓肠神经,结扎并剪断胫神经和腓总神经,保留细小的腓肠神经,应避免任何损伤。取SD大鼠40只,体质量(180±20) g,随机分为5组,每组8只,分别为:假手术组(Sham组)、模型对照组(Vehicle组)、30.0 mg·kg-1SLNP 组、100.0 mg·kg-1SLNP 组、300 mg·kg-1SLNP 组。术后第1 天开始灌胃给药。假手术组与模型对照组分别给予1 mL·(100 g)-1的生理盐水;每天固定时间给药1次,连续14 d。
采用动态足底触觉仪测定大鼠机械缩足反射阈值(机械痛敏)。将大鼠置于拱形的塑料罩中,先适应15 min。使动态足底触觉仪的探头由下往上穿过铁丝网垂直刺激大鼠左后足足底皮肤,均速增加刺激强度,记录大鼠出现缩足反应(如舔足、抬腿等)时的刺激强度即机械缩足反射阈值(Pawchanical withdrawl threshold, PWT),设定最大刺激强度为50 g,即使大鼠无缩足反应,亦不再增加强度(以免损伤大鼠足底皮肤)。每只大鼠重复测试3次,每次间隔5 min,结果取3 次的平均值。分别于术前1 d及术后1、3、7、14 d 测定机械性痛阈并计算机械缩足反射阈值(Paw withdrawl threshold, PWT)。
1.2.2.2 醋酸致小鼠扭体模型取雄性小鼠50只,体质量(20±2) g,随机分为5组:正常对照组(Ctrl组),10 mg·kg-1吗啡阳性对照组(Mor组),30 mg·kg-1SLNP组, 100 mg·kg-1SLNP 组,300 mg·kg-1SLNP 组。各组按0.1 mL·(10 g)-1体重分别给药,吗啡阳性对照组腹腔注射10 mg·kg-1,给药组分别灌胃给药,正常组灌胃给予等量生理盐水,给药l h 后,各组小鼠按0.1 mL·(10 g)-1体重腹腔注射0.6%冰醋酸溶液(当天临时配制)。观察并记录注射冰醋酸溶液后30 min内小鼠出现扭体反应的次数。
1.2.2.3 热辐射致痛(甩尾法)模型保持室内温度(21±1) ℃,将小鼠置于小鼠器中,尾巴由后盖的洞中引出,洞应稍大,使鼠尾能自由下垂,不致因受压太大影响结果,待小鼠安静后进行实验。用辐射热测痛仪照射于悬垂下的小鼠尾尖1/3处,记录小鼠尾端皮肤接受热辐射刺激到其自动从刺激点甩开的时间,测3 次取平均值作为基础痛阈。选择基础痛阈3~10 s的雄性小鼠50只,体质量(20±2) g,随机分为5 组,每组10 只,分组和给药方法同1.2.2.2,分别测定给药后60 min、120 min,180 min,240 min 小鼠痛阈,设置20 s为最大照射时间,以免灼伤小鼠皮肤。
1.2.3 棉球致肉芽肿小鼠血清中炎症细胞因子IL-10、IL-6 含量测定小鼠眼眶取血后,静置,3 000× g,4 ℃离心10 min,分离血清于-80 ℃保存,严格按试剂盒说明,采用酶联免疫吸附试验方法(Enzyme-linked immunosorbent assay,ELISA)检测血清IL-10、IL-6含量。
1.2.4 棉球致肉芽肿小鼠血清中抗氧化物质SOD、GSH-Px、MDA 水平测定采用化学比色法测定小鼠血清中SOD、GSH-Px、MDA水平,具体操作严格按试剂盒说明,用酶标仪测定其吸光度值。
1.3 统计学方法采用Prism 8.0 软件进行分析,实验数据以均数±标准差表示。两组间比较用t检验;组间比较采用单因素方差分析(One-way ANOVA)检验。P<0.05为差异有统计学意义。
2 结果
2.1 SLNP 对肉芽肿小鼠、耳廓肿胀小鼠、CFA 大鼠炎性痛的影响如图1所示,与模型对照组相比,给药组的耳廓肿胀度(图1A)、肉芽肿大小(图1B)都有明显下降,30 mg·kg-1SLNP 在给药后第7 天佐剂性关节炎大鼠足趾肿胀度明显降低(P<0.05),100 mg·kg-1SLNP 以及300 mg·kg-1SLNP 也有抑制CFA 大鼠足趾肿胀的趋势(图1C),但尚无统计学意义,提示SLNP能很好的抑制炎症的发展。
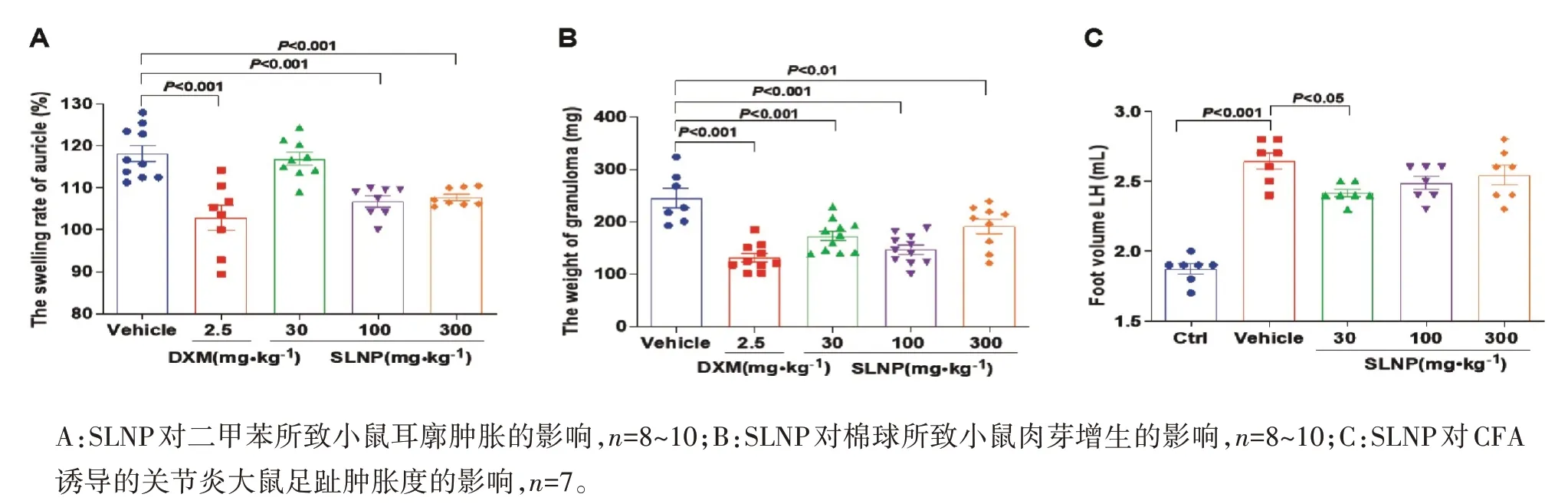
图1 SLNP的抗炎作用
2.2 SLNP 对SNI 大鼠机械痛、醋酸致小鼠扭体及辐射热引起甩尾的影响如图2 所示,与模型对照组相比,100 mg·kg-1SLNP 能升高机械痛阈值(P<0.01,图2A),与正常对照组相比,100 mg·kg-1SLNP能减少扭体次数(P<0.01,图2B)和甩尾次数(P<0.001,图2C)。说明SLNP对坐骨神经损伤引起的神经病理性疼痛、醋酸引起的化学性刺激疼痛、辐射热引起的物理性刺激疼痛均有很好的缓解作用,以100 mg·kg-1SLNP的镇痛效果最为显著。

图2 SLNP的镇痛作用
2.3 SLNP对炎性小鼠炎症因子的影响如图3所示,与模型对照组相比,100 mg·kg-1及300 mg·kg-1SLNP能显著下调棉球致肉芽肿增生小鼠血清中IL-6的蛋白表达(P<0.001,图3A),其中100 mg·kg-1SLNP 还可上调小鼠血清中IL-10 的蛋白表达(P<0.01,图3B)。说明SLNP 对炎性痛的抑制过程中会促进抑炎因子的表达,抑制促炎因子的释放。

图3 SLNP对炎性小鼠炎症因子的影响
2.4 SLNP对炎性小鼠免疫功能的影响如图4所示,100 mg·kg-1SLNP能显著下调二甲苯致耳廓肿胀模型小鼠胸腺指数(P<0.01,图4A)、脾指数(P<0.001,图4B);如图5所示,100 mg·kg-1SLNP明显下调棉球致肉芽肿增生模型小鼠胸腺指数(P<0.01,图5A)、脾指数(P<0.001,图5B)。说明SLNP 能增强炎症过程中的免疫反应,达到抑制炎症反应发生的效果。
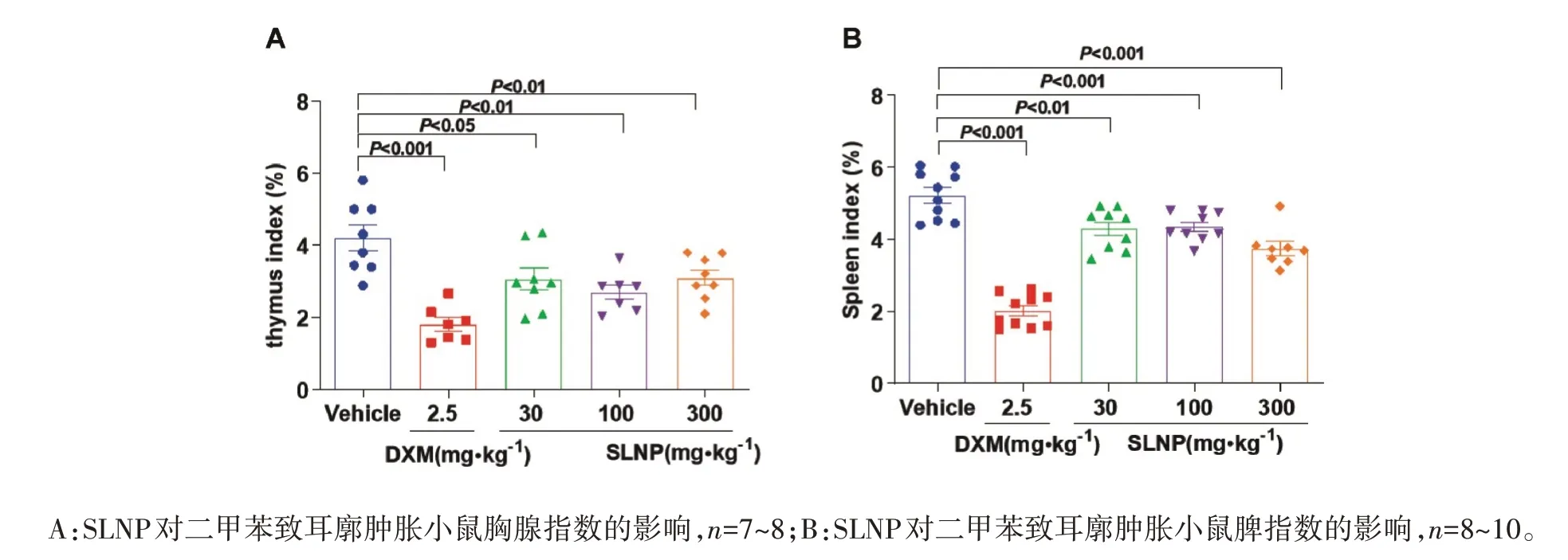
图4 SLNP对炎性小鼠免疫功能的影响
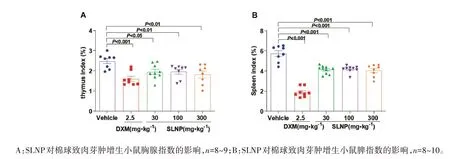
图5 SLNP对炎性小鼠免疫功能的影响
2.5 SLNP 对炎性小鼠氧化应激反应的影响如图6所示,SLNP可提高小鼠清除自由基能力,减少自由基产物。100 mg·kg-1、300 mg·kg-1SLNP 可有效提高棉球致肉芽肿小鼠血清SOD含量(P<0.05);100 mg·kg-1SLNP 可有效提高GSH-PX 含量(P<0.05);SLNP 可减少MDA 生成,以100 mg·kg-1SLNP最为显著(P<0.001)。说明SLNP 能加强小鼠对自由基的清除能力,有效抑制氧化应激反应的进程。
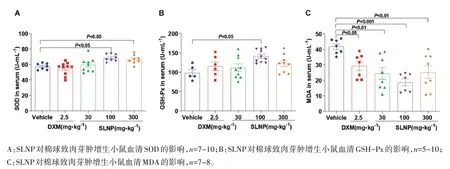
图6 SLNP对炎性小鼠氧化应激反应的影响
3 讨论
炎症是具有血管系统的活体组织对疾病发生发展过程中各种损伤因子刺激做出的以防御反应为主的重要的病理过程,多种理化因素和组织坏死都会引起炎症。根据炎症的持续时间可分为急性期炎症、亚急性期炎症、慢性期炎症。急性期主要表现为:变质、渗出、增生,亚急性期主要表现为:淋巴细胞及炎症介质的浸润,慢性期主要表现为:增生、实变、坏死[6]。本研究选用了二甲苯致小鼠耳廓肿胀模型、棉球致小鼠肉芽肿增生模型、完全弗氏佐剂诱导的大鼠类风湿性关节炎模型探讨SLNP 的抗炎镇痛作用。研究结果显示,SLNP能显著减轻小鼠的耳廓肿胀、抑制棉球所致的小鼠肉芽肿增生、缓解佐剂性关节炎模型大鼠的患侧足趾肿胀,说明SLNP对急、慢性炎症有很好的治疗作用。
同时,为了进一步探究SLNP 的镇痛作用,本研究选取了大鼠坐骨神经损伤、醋酸致小鼠扭体、小鼠热辐射致甩尾模型。大鼠SNI模型是通过结扎大鼠一侧坐骨神经进而引起大鼠神经病理性疼痛损伤。醋酸致小鼠扭体模型是经化学刺激造成小鼠腹腔的急性炎性痛,可见小鼠出现扭体反应。甩尾模型则是经热源照射引起小鼠反射性甩尾,属于脊髓反射性测痛实验。研究结果显示其能明显升高外周神经损伤引起的神经病理性疼痛大鼠的机械痛痛阈,提高小鼠热刺激体表的痛阈;显著延长小鼠对于辐射热引起甩尾反射的甩尾潜伏期;也能缓解小鼠因醋酸刺激腹腔黏膜引起的疼痛反应,表现为扭体次数减少,说明SLNP 镇痛效果明显。佛甲草可以持效120 min,药效与吗啡类似。以上结果说明SLNP 对周围神经损伤、化学性和物理性刺激引起的炎症性疼痛均有很好的缓解效果。
炎性痛的发生发展非常复杂,当机体受到损伤出现炎症时,局部免疫防御反应发生,炎症因子的释放与炎性痛的发展有关,炎症反应常伴有炎症因子释放增多,抗炎因子释放减少[7-8]。IL-6 是一种常见的促炎因子,可由单核巨噬细胞、成纤维细胞、内皮细胞等分泌,在局部炎症反应和炎症损伤中,刺激炎症细胞的分化和增长,炎症反应发生,机体展开免疫防御机制以修复损伤[9-10]。IL-10作为一种重要的多功能抗炎因子,可直接延缓炎性反应进程,抑制促炎细胞因子的释放,还可以诱导体内炎症因子拮抗剂的合成分泌,参与到炎症反应的各个环节,是作用广泛的细胞因子[11-12]。胸腺和脾脏是非常重要的免疫器官,分别参与了机体的细胞免疫和体液免疫过程,胸腺指数和脾脏指数是衡量机体免疫功能状态的重要指标[13]。同时有研究[14]证实,在炎症反应中氧化应激反应也参与在内。氧化应激是由氧化还原稳态失衡引起的,氧自由基以及脂质过氧化物过度产生。有证据表明,氧自由基以及脂质过氧化物的过度产生可使得胶质细胞活化,促炎介质进一步产生,从而使得炎症加重[15]。氧自由基的大量产生进一步推动了炎症反应的进程,活性氧(Reactive oxygen species,ROS)是氧化应激反应的关键信号分子,具有强氧化能力,氧化蛋白质和脂质成分并破坏DNA,其主要来源于线粒体氧化呼吸链和体内NADPH 酶系,ROS 的大量产生是氧化应激反应发生的罪魁祸首,过量的ROS 可通过激动TLR4/NF-κB途径引起大量致炎因子产生,加重炎症反应[16-17]。SOD、GSH-Px 和MDA 是衡量机体抗氧化能力的重要指标[18]。SOD 可有效清除氧自由基[19];谷胱甘肽过氧化物酶(GSH-Px)是机体内广泛存在的一种重要的过氧化物分解酶,它以谷胱甘肽为共底物,对有机氢过氧化物具有还原作用,可增加机体的抗氧化能力[20],MDA 是体内脂质被自由基攻击所产生的脂质过氧化物,其含量变化是衡量氧自由基损伤的重要参照[21]。本研究结果证实,SLNP具有显著的抗炎镇痛作用,但该作用效果是通过何种途径发生尚不得而知。因此我们采用ELISA实验测定了小鼠血清中IL-6、IL-10 的含量,用试剂盒测定了血清中SOD、GSH-Px、MDA水平,同时测定了小鼠的胸腺指数和脾脏指数。本研究结果显示,SLNP能显著降低二甲苯致耳廓肿胀小鼠及棉球致肉芽肿小鼠的胸腺指数与脾指数,说明其能有效增强炎症过程的免疫反应,缓解炎性痛。下调棉球致肉芽肿小鼠血清IL-6 的表达而上调IL-10 的表达,提示SLNP对炎性痛的抑制作用是通过抑制促炎因子释放、促进抑炎因子释放完成的。同时SLNP 显著提高血清中抗氧化分子SOD 及GSH-Px 表达,而降低MDA 表达,说明SLNP 对在炎症反应过程中发生的氧化应激也有一定程度的抑制效果,可促进体内抗氧化体系对自由基脂质过氧化物的清除。
综上所述,SLNP能有效清除炎症反应过程中产生的氧自由基和炎性介质,抑制炎症损伤。提示SLNP有很好的抗炎和镇痛作用,且其机制可能与调节细胞因子表达,增强机体免疫与抗氧化功能有关。

