褪黑素通过JAK2/STAT3 信号通路对糖尿病大鼠肺缺血再灌注损伤的作用机制研究
屈银辉 ,陈聪杰 ,王丽娟
河北省定州市人民医院1麻醉科,2药剂科 河北省定州市,073000
糖尿病(diabetes mellitus,DM) 的患病率在全世界所有年龄组中急剧上升。研究发现,DM 是肺缺血/再灌注(ischemia/reperfusion,I/R) 损伤后发病和死亡的独立危险因素,尤其是在2 型糖尿病患者中[1]。DM 伴随许多严重的并发症,肺是其靶器官之一[2],因此,在糖尿病存在的情况下,应更加重视预防肺外科手术中的肺损伤。肺I/R 损伤可在许多临床情况下发生,如肺移植、休克、体外循环和单肺通气,可导致严重的器官衰竭,增加患者的死亡率[3]。氧化应激损伤可导致细胞内产生活性氧(reactive oxygen species,ROS),这是导致肺I/R 损伤的重要因素[4]。此外,以前的研究表明,持续的高血糖会产生过量的ROS,从而导致糖尿病性肺损伤[5]。ROS 是核因子-κB(nuclear factor kappa B,NF-κB) 激活的刺激信号,通过上调肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α) 而加重炎症反应[6]。因此,抑制氧化应激损伤和炎症反应对减轻糖尿病患者肺I/R 损伤至关重要。褪黑素主要由松果体产生,是一种天然的抗氧化剂和自由基清除剂[7]。研究发现褪黑素可以通过调节胰岛素分泌和清除ROS 来降低糖尿病相关代谢紊乱。以往的研究证明褪黑素对I/R 损伤具有保护作用,其作用机制可能与抑制氧化应激和炎症反应有关[8]。但褪黑素对糖尿病大鼠肺I/R 损伤的影响尚不清楚。因此,本研究拟探讨褪黑素对糖尿病大鼠肺I/R 损伤的作用及其分子机制。
1 材料和方法
1.1 实验动物
雄性Sprague-Dawley 大鼠(购自河北省实验动物中心,SCXK(冀) 2022-001),200~250 g,8周龄,饲养在温度为22 ℃~24 ℃,湿度为50 %~65 %,光照/黑暗周期为12 h/12 h 的动物房中,所有动物均可自由获得食物和水。所有动物实验方案由我院伦理委员会批准。
1.2 主要试剂仪器
链脲佐菌素和褪黑素均购自美国Sigma 公司;苏木精-伊红(H-E) 染色试剂盒购自上海碧云天生物技术有限公司;酶联免疫吸附试验(ELISA)试剂盒购自上海恒远生物科技有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX) 活性、总抗氧化能力(total antioxidant capacity,TAOC) 水平、超氧化物歧化酶(superoxide dismutase,SOD) 活性和丙二醛(malonaldehyde,MDA) 检测试剂盒均购自南京碧波生物科技有限公司;Janus 蛋白酪氨酸激酶2(Janus protein tyrosine kinase 2,JAK2)、磷酸化JAK2(phosphorylated-JAK2,p-JAK2)、信号转导和转录活化因子3(signal transducer and activator of transcription 3,STAT3)、磷酸化STAT3(phosphorylated-STAT3,p-STAT3) 蛋白均购自美国Cell Signaling Technology 公司。多功能酶标仪购自美国Biotek 公司;显微镜购自德国Leica 公司。
1.3 实验动物分组
将Sprague-Dawley 大鼠随机分为5 组: 对照+假手术组(Control+Sham 组)、糖尿病+假手术组(DM+Sham 组)、对照+缺血再灌注组(Control+IR 组)、糖尿病+缺血再灌注组(DM+IR 组)、糖尿病+缺血再灌注+褪黑素组(DM+IR+MT组),每组8 只。DM +IR +MT 组在肺I/R 损伤模型建立前,链脲佐菌素治疗3 d 后,每天大鼠腹腔注射褪黑素(10 mg/kg),连续4 周。
1.4 糖尿病大鼠模型构建
通过给予高脂饮食(15 %猪油、5 %芝麻油、20 %蔗糖、2.5 %胆固醇和57.5 %正常饲料) 4周,然后腹腔内注射链脲佐菌素(35 mg/kg) 建立DM 大鼠模型。注射链脲佐菌素72 h 后空腹血糖水平≥11.1 mmol/L,提示为糖尿病。喂食标准饮食的大鼠作为非糖尿病对照组(Control 组)。随后,本研究通过腹腔葡萄糖耐量试验(intraperitoneal glucose tolerance test,IPGTT) 和口服葡萄糖耐量试验(oral glucose tolerance test,OGTT) 检测各组的糖耐量,以确认糖尿病动物模型的构建是否成功。大鼠空腹12 h 后腹腔注射或灌胃给予葡萄糖2 g/kg。分别于葡萄糖负荷前、葡萄糖负荷后30、60、90、120 min 检测血糖水平。
1.5 大鼠肺I/R 模型
大鼠腹腔注射戊巴比妥钠进行麻醉。麻醉后,在喉镜下进行气管插管。气管插管连接小动物呼吸机进行机械通气,潮气量为8 mL/kg。调整呼吸频率以维持动脉血二氧化碳分压(PaCO2) 在35~45 mmHg。分别插管股动脉和股静脉进行血压监测和给药。在左侧开胸手术后,在给药肝素(50 IU/只) 5 min 后,用无创微血管夹夹住左肺门。夹紧时调整潮气量为6 mL/kg。左肺门夹紧90 min 阻断血流后,松开血管夹,再灌注4 h,潮气量恢复至10 mL/kg。在实验过程中,用加热毯将体温保持在37.5 ℃至38.5 ℃之间。假手术组大鼠除左肺门阻塞外,其余步骤相同。
1.6 肺组织湿重/干重(W/D) 比值测量
大鼠安乐死后,用生理盐水清洗肺组织,再用滤纸干燥肺组织的表面。此时,肺组织的重量是湿重。然后将肺组织置于80 ℃的烘箱中24 h,肺组织干燥后的重量为干重。最后测量肺组织W/D 比值。
1.7 苏木精-伊红(H-E) 染色
大鼠安乐死后,将肺组织置于多聚甲醛中固定,然后脱水并用石蜡包埋。将包埋的组织切成5 μm 厚的切片,在室温下用苏木精染色5 min,然后在室温下用伊红染色3 min,最后在光学显微镜下观察并拍照。根据以下标准评估肺损伤评分: ①中性粒细胞浸润,②气道上皮细胞损伤,③间质水肿,④透明膜形成,⑤出血。肺损伤程度采用0~4 的半定量量表进行评分,正常=0,微小变化=1,轻度变化=2,中度变化=3,重度变化=4。
1.8 蛋白质印迹
肺组织在裂解缓冲液中匀浆以收集蛋白质。用BCA 试剂盒测定蛋白浓度后,50 μg 蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,转移到PVDF 膜上。将膜在5 %脱脂牛奶中封闭后,用一抗孵育,4 ℃过夜。PBS 洗涤后,将膜与二抗继续孵育1 h。最后,用增强的化学发光试剂对蛋白进行可视化,使用Image J 软件分析条带的灰度值。
1.9 炎症因子水平检测
将肺组织在生理盐水中清洗,冰上匀浆。随后离心,收集上清液。然后,根据说明书使用酶联免疫吸附试验(ELISA) 试剂盒检测上清液中炎症因子白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6) 和肿瘤坏死因子-α(tumor necrosis factor-a,TNF-α) 的浓度。
1.10 氧化应激水平检测
大鼠安乐死后,将一部分肺组织在冰预冷的生理盐水中匀浆,根据说明书使用相应的商业试剂盒检测肺组织中GSH-PX、T-AOC、SOD 和MDA 活性的水平。
1.11 1 统计学分析
2 结果
2.1 各组大鼠血糖水平的比较
腹腔葡萄糖耐量和口服葡萄糖耐量试验结果显示,与Control 组比较,DM 组各个时间段的血糖水平均显著升高(P<0.01),表明2 型糖尿病模型建立成功(图1)。

图1 各组大鼠血糖水平的比较(n=8)
2.2 褪黑素对糖尿病大鼠肺IR 损伤后肺组织湿重/干重(W/D) 比值的影响
通过给予高脂饮食、腹腔内注射链脲佐菌素(35 mg/kg) 联合手术建立糖尿病大鼠肺IR 损伤模型,治疗组大鼠每天腹腔注射褪黑素(10 mg/kg),连续4 周。实验结束后处死大鼠,通过称量法检测各组大鼠W/D 比值。与Control+Sham 组比较,Control+IR 组和DM+Sham 组中肺W/D 比值升高(P<0.05);与Control +IR 组和DM +Sham组比较,DM+IR 组中肺W/D 比值显著升高(P<0.05);与DM+IR 组比较,DM +IR +MT 组中肺W/D 比值显著降低(P<0.05)(图2)。
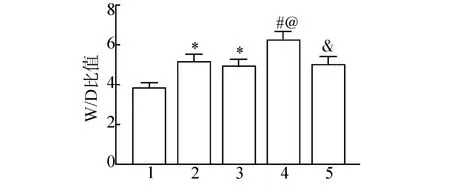
图2 褪黑素对糖尿病大鼠肺IR 损伤后肺湿重/干重比值的影响(n=8)
2.3 褪黑素对糖尿病大鼠肺IR 损伤后肺组织病理学改变的影响
实验结束后处死大鼠,采用HE 染色检测各组小鼠肺病理损伤程度。结果显示,Control+Sham组的肺形态保持完整;与Control +Sham 组比较,Control+IR 组和DM +Sham 组肺泡间隔和间隙水肿,间质增厚,肺泡内出血和白细胞浸润,肺损伤评分较高(P<0.05)。
与Control+IR 组和DM+Sham 组比较,DM +IR 组的肺组织学改变更为严重,肺损伤评分进一步升高(P<0.05);而褪黑素治疗后DM+IR +MT 组明显减轻糖尿病大鼠肺IR 损伤,肺损伤评分降低(P<0.05)(图3)。

图3 褪黑素对糖尿病大鼠肺IR 损伤后肺组织病理学改变的影响(n=8)
2.4 褪黑素对糖尿病大鼠肺IR 损伤后氧化应激水平的影响
实验结束后处死大鼠,取出一部分肺组织在预冷的生理盐水中匀浆,采用商业试剂盒检测肺组织中GSH-PX、T-AOC、SOD 和MDA 的活性水平。与Control+Sham 组比较,Control +IR 组和DM +Sham 组GSH-PX、SOD、T-AOC 活性降低,MDA水平升高(P<0.05);与Control +IR 组和DM +Sham 组比较,DM+IR 组GSH-PX、SOD、T-AOC活性显著降低,MDA 水平显著升高(P<0.05);与DM+IR 组比较,DM+IR+MT 组GSH-PX、SOD、T-AOC 活性显著升高,MDA 水平显著降低(P<0.05)(图4)。
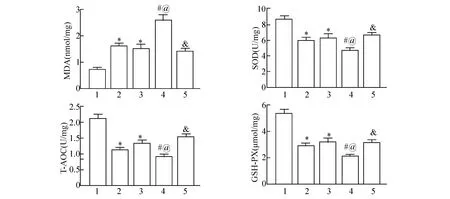
图4 褪黑素对糖尿病大鼠肺IR 损伤后氧化应激水平的影响(n=8)
2.5 褪黑素对糖尿病大鼠肺IR 损伤后炎症因子水平的影响
实验结束后处死大鼠,取出一部分肺组织在预冷的生理盐水中匀浆,采用ELISA 试剂盒检测上清液中炎症因子IL-1β、IL-6、TNF-α 的浓度。
与Control+Sham 组比较,Control+IR 组和DM+Sham 组炎症因子IL-1β、IL-6、TNF-α 表达水平升高(P<0.05)。
与Control+IR 组和DM+Sham 组相比较,DM+IR 组IL-1β、IL-6、TNF-α 表达水平显著升高(P<0.05)。
与DM+IR 组比较,DM+IR+MT 组IL-1β、IL-6、TNF-α 表达水平显著降低(P<0.05)(图5)。
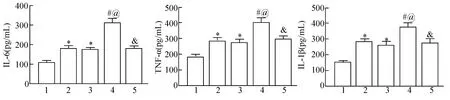
图5 褪黑素对糖尿病大鼠肺IR 损伤后炎症因子水平的影响(n=8)
2.6 褪黑素对糖尿病大鼠肺IR 损伤后JAK2/STAT3 通路蛋白的表达
实验结束后处死大鼠,提取肺组织蛋白,通过蛋白质印迹检测肺组织中p-JAK2 和p-STAT3 蛋白水平。
与Control+Sham 组比较,Control+IR 组和DM+Sham 组p-JAK2 和p-STAT3 蛋白水平升高(P<0.05),说明高血糖或肺IR 损伤后均会引起JAK2/STAT3 通路蛋白被激活;与Control+IR 组和DM+Sham 组比较,DM+IR 组p-JAK2 和p-STAT3蛋白水平显著升高(P<0.05),说明高血糖下引发肺IR 损伤会进一步激活JAK2/STAT3 通路蛋白;与DM+IR 组比较,DM+IR+MT 组p-JAK2 和p-STAT3蛋白水平显著降低(P<0.05),说明褪黑素治疗后可以缓解高血糖和肺IR 损伤引起的JAK2/STAT3 通路蛋白的激活(图6)。

图6 褪黑素对糖尿病大鼠肺IR 损伤后JAK2/STAT3 通路蛋白的表达(n=8)
3 讨论
DM 是一种常见的慢性终身性疾病,临床上以高血糖和多种慢性并发症并存为特征,具有高度的遗传易感性,危害人类健康。糖尿病作为一种代谢性疾病,其发病机制涉及多种因素,如基因异常、细胞因子过量等,最终以胰岛素分泌缺乏和功能障碍导致的糖代谢异常为特征。糖尿病患者在长期慢性高血糖状态下,肾、眼、心等器官受损甚至衰竭。虽然肺是糖尿病并发症研究较少的器官,但研究已证实肺也是糖尿病损伤的靶器官[9]。近期研究表明,糖尿病是肺移植受者发病和死亡的主要危险因素[10]。在糖尿病条件下,长时间的高血糖会导致ROS 的过量产生,进而增强氧化应激、炎症反应和细胞凋亡,最终加重再灌注损伤。在糖尿病条件下,肺组织的特点是有大量的氧自由基,同时其抗氧化能力下降[11]。此外,糖尿病促进各种促炎细胞因子的释放,进一步加剧肺功能下降和肺损伤。研究表明,抑制肺部炎症反应和减少氧化应激可以减轻糖尿病患者的肺损伤[12]。MDA 是膜脂过氧化的重要产物之一,SOD 是一种抗氧化金属酶,T-AOC 是总抗氧化水平的指标,GSH-PX 是保护细胞膜免受过氧化物损伤的重要过氧化物酶。本研究通过以上指标来评估氧化应激水平,结果发现Control +IR 组和DM +Sham 组的GSH-PX、SOD、T-AOC 活性均降低,MDA 水平均升高。而DM +IR 组的抗氧化能力下降更显著。此外,Control +IR 组和DM+Sham 组的大鼠肺组织湿重/干重比值升高,肺损伤评分升高,以及炎症细胞因子水平增加。与上述研究一致,DM +IR 组的氧化应激和炎症水平显著升高。以上结果表明糖尿病在肺I/R 损伤的基础上进一步加重了氧化应激和炎症反应。
褪黑素具有抗炎、抗氧化和降低内质网应激的作用。研究报道褪黑素可通过激活SIRT1/SGK1/Nedd4-2 信号通路降低脓毒症诱导的急性肺损伤[13]。此外,褪黑素通过减少氧化应激损伤和炎症反应来减少肺I/R 损伤[14]。鉴于褪黑素的抗氧化和抗炎作用,本研究推测褪黑素也可能在糖尿病模型中发挥有益作用。因此,本研究通过褪黑素处理肺I/R 损伤的糖尿病大鼠,结果发现,褪黑素处理后,肺组织病理学评分降低,肺组织湿重/干重比值下降,抗氧化能力升高以及炎症细胞因子水平降低。表明褪黑素可显著改善糖尿病肺I/R 损伤的氧化应激水平和炎症反应。
虽然褪黑素对糖尿病大鼠肺I/R 损伤有保护作用,但其机制尚不清楚。JAK-STAT 通路是许多参与细胞生长、造血和免疫调节的细胞因子受体系统的特定组成部分。该通路主要由酪氨酸激酶JAK、酪氨酸激酶相关受体和转录因子STAT3 组成。当细胞因子与相应的受体结合时,激活与受体偶联的JAK 激酶,导致受体上的酪氨酸残基磷酸化,从而激活STAT 蛋白,最终STAT 蛋白以二聚体的形式进入细胞核[15]。有研究报道,JAK2/STAT3 信号通路在IR 诱导的肺损伤中发挥重要作用,具有明显的促炎和促氧化作用[16]。另外一项研究证实,褪黑素通过调节JAK2/STAT3 信号通路减轻脓毒症所导致的心肌损伤[17]。本研究发现,Control +IR 组和DM+Sham 组的p-JAK2 和p-STAT3 蛋白表达均显著升高,DM +IR 组p-JAK2 和p-STAT3 蛋白表达进一步升高。而褪黑素治疗显著抑制了p-JAK2和p-STAT3 蛋白表达。以上结果表明JAK2/STAT3信号通路在褪黑素对糖尿病大鼠肺I/R 损伤的保护作用中可能发挥重要作用。
综上所述,本研究结果表明,褪黑素治疗可显著缓解IR 诱导的糖尿病大鼠肺功能障碍、氧化应激和炎症反应,其机制主要是通过抑制JAK2/STAT3 信号通路发挥作用。本研究为开发新的治疗糖尿病合并缺血性肺病的治疗策略提供了新的理论依据。

