白桦脂酸对RANKL 诱导的MC3T3-E1 细胞成骨分化的影响及机制研究
李宗蔚,王家洪,卿泉
绵阳市骨科医院足踝科 四川省绵阳市,621000
骨质疏松症(osteoporosis,OP) 伴有骨量减少与骨组织微结构恶化,导致骨骼脆弱、骨折易感[1]。正常情况下,骨吸收与骨生成过程处于平衡状态,而当这一骨代谢平衡失调时引起骨丢失发生[2-4]。因此调控成骨细胞与破骨细胞功能的平衡是骨质疏松治疗的关键。目前用于治疗骨质疏松症的药物多以抑制骨吸收而维持骨量,然而此类药物在增加或恢复骨量方面作用有限。参与骨形成的细胞事件包括成骨前体细胞的增殖和分化,对骨形成至关重要。研究显示,慢性炎症会干扰骨代谢,抑制成骨分化,引起骨质流失[5-6]。白桦脂酸(betulinic acid,BA) 是一种天然植物三萜,存在于杜仲和白桦树皮等的具有抗骨质疏松特性的天然产物中。BA 表现出抗炎、抗氧化等诸多药理活性,被认为是重要的药物先导化合物,但其是否具有促成骨活性仍不清楚[7]。因此,本研究利用NF-κB 受体活化因子配体(receptor activator of nuclear factorκb ligand,RANKL) 诱导炎症微环境,观察BA 对MC3T3-E1 细胞分化的作用,并研究其作用机制,以期为中医药治疗OP 提供理论依据。
1 材料与方法
1.1 细胞及主要试剂
MC3T3-E1 细胞系(武汉普诺赛生命科技有限公司),白桦脂酸(成都曼思特),RANKL(Sigma-Aldrich 公司),PI3K 激活剂740Y-P(美国APExBIO 公司),姜黄素(美国Sigma 公司),α-MEM 培养基(美国Gibco 公司),P65、p-P65、OCN、OPN、CollagenⅠ、MEK、p-MEK、ERK、p-ERK、PI3K、p-PI3K 一抗(美国CST 公司),IL-6 ELISA 试剂盒、ALP 活性检测试剂盒(南京建成),CCK-8 试剂盒、ALP 染色试剂盒(上海碧云天),全自动酶标免疫分析仪(Biotex 公司)。
1.2 细胞培养
将MC3T3-E1 细胞接种于含10 % FBS、1 %双抗及1 %谷氨酰胺的α-MEM 完全培养基中,置于37 ℃5 % CO2培养箱中培养,待细胞汇合率达80 %以上传代。进行成骨诱导时更换诱导培养基,即在含10 %胎牛血清、1 %双抗及1 %谷氨酰胺的α-MEM 完全培养液中加入10 mmol/L β-甘油磷酸纳、10 nmol/L 地塞米松,50 μg/mL 维生素C 配制成成骨分化诱导培养基。
1.3 CCK-8 检测细胞活力
待各组MC3T3-E1 细胞生长至对数生长期,消化后离心、PBS 冲洗,重悬后以3 000 个/孔接种于96 孔板中常规培养,待细胞基本融合后加入不同浓度BA(0、5、10 和20 μmol/L) 干预,分别于培养24、48 h 后使用10 μL CCK-8 溶液处理,继续培养2 h 后采用酶标仪测定450 nm 处各孔的吸光度值(A450nm)。
1.4 ELISA 检测IL-6 表达
取生长良好MC3T3-E1 细胞,以1 ×105个细胞/孔接种于24 孔板中,放入温度为37 ℃5 % CO2培养箱中培养24 h,实验分为Control 组和RANKL 组,Control 组加入加入不同浓度BA(0、5、10 和20 μmol/L) 干预,RANKL 组同时加入不同浓度白桦脂酸和100 ng/mL RANKL 处理,继续培养6、12 和24 h后取上清液,离心并使用ELISA 法检测上清中IL-6 水平,操作严格按照ELISA 试剂盒说明进行。
1.5 ALP 染色及ALP 活性检测
取生长良好的MC3T3-E1 细胞,以1 ×105个细胞/孔接种于24 孔板中,放入温度为37 ℃CO2浓度为5 %的培养箱中培养24 h。将细胞分为4 组:RANKL、BA、RANKL +BA +740Y-P 及RANKL +BA+Curcumin。除RANKL 外其余各组同时加入10 μmol/L 白桦脂酸处理,其中RANKL +BA +740YP 和RANKL+BA +Curcumin 在加入BA 前分别加入20 μmol/L 740Y-P 和20 μmol/L 姜黄素预处理2 h,然后加入100 ng/ml RANKL。经上述处理后加入分化培养基继续培养7 d,每2 天更换培养基。分别使用ALP 染色试剂盒和ALP 检测试剂盒检对MC3T3-E1 细胞进行ALP 染色和ALP 活性测定,严格按照说明书操作。
1.6 蛋白质印迹检测蛋白表达
收集处理后各组细胞,PBS 冲洗后冰上充分裂解提取总蛋白。BCA 法定量蛋白样品后,取40 μg蛋白经SDS-PAGE 电泳转印至PVDF 膜,5 %脱脂牛奶室温封闭2 h,加入P65、p-P65、OCN、OPN、CollagenⅠ、MEK、p-MEK、ERK、p-ERK、PI3K、p-PI3K 一抗4 ℃孵育过夜,洗膜后加二抗室温下孵育2 h,ECL 法显色,Image J 分析条带灰度值,内参为GAPDH。
1.7 统计学方法
使用SPSS 20.0 统计数据,GraphPda Prism5 作图,以表示计量资料,多组间比较使用单因素方差分析,两两比较使用SNK 法。
2 结果
2.1 BA 对MC3T3-E1 细胞活力的影响
BA(5~20 μmol/L) 处理24 h 后MC3T3-E1细胞活力无显著变化(P>0.05)。BA(5~ 10 μmol/L) 处理48 h 后细胞活力无显著差异(P>0.05),而BA(20 μmol/L) 处理48 h 后细胞活力较Control 组下降(P<0.05)(图1)。在后续试验中采用10 μmol/L BA 研究其对MC3T3-E1 细胞成骨分化的作用。
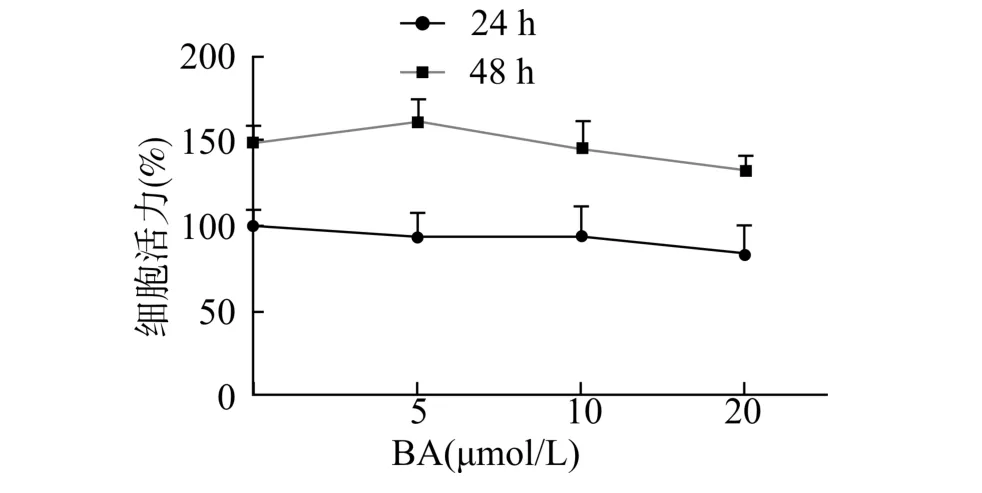
图1 BA 对MC3T3-E1 细胞活力的影响
2.2 BA 对RANKL 诱导的MC3T3-E1 细胞IL-6 生成的影响
单独使用不同浓度BA(0、5、10 和20 μmol/L) 处理24 h 后,IL-6 水平无显著差异(P>0.05);加入100 ng/mL RANKL 处理显著增加IL-6生成(P<0.05),10 μmol/L BA 处理12、24 h 后显著抑制了RANKL 诱导的IL-6 生成(P<0.05),处理6、12、24 h 后显著降低p-P65/P65 比值(P<0.05)(图2);提示BA 能显著抑制RANKL 诱导的NF-κB 活化并减少IL-6 生成。

图2 BA 对RANKL 诱导的MC3T3-E1 细胞IL-6 生成的影响
2.3 BA 对RANKL 诱导的MC3T3-E1 细胞成骨标记蛋白表达的影响
与Control 组比较,RANKL 组OCN、OPN、CollagenⅠ蛋白表达均显著降低(P<0.05);与RANKL 组比较,RANKL +BA 组OCN、OPN、CollagenⅠ蛋白表达均显著增加(P<0.05)(图3);提示BA 能显著上调MC3T3-E1 细胞成骨标记蛋白表达。
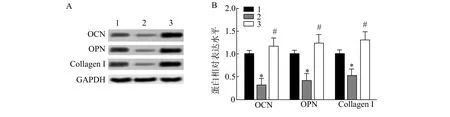
图3 BA 对RANKL 诱导的MC3T3-E1 细胞成骨标记蛋白表达的影响
2.4 BA 对MEK/ERK 和PI3K 信号通路的影响
与Control 组比较,RANKL 组p-MEK/MEK、p-ERK/ERK 及p-PI3K/PI3K 比值均显著升高(P<0.05);与RANKL 组比较,RANKL+BA 组p-MEK/MEK、p-ERK/ERK 及p-PI3K/PI3K 比值均显著降低(P<0.05)(图4);提示BA 能显著抑制MEK/ERK 和PI3K 信号激活。
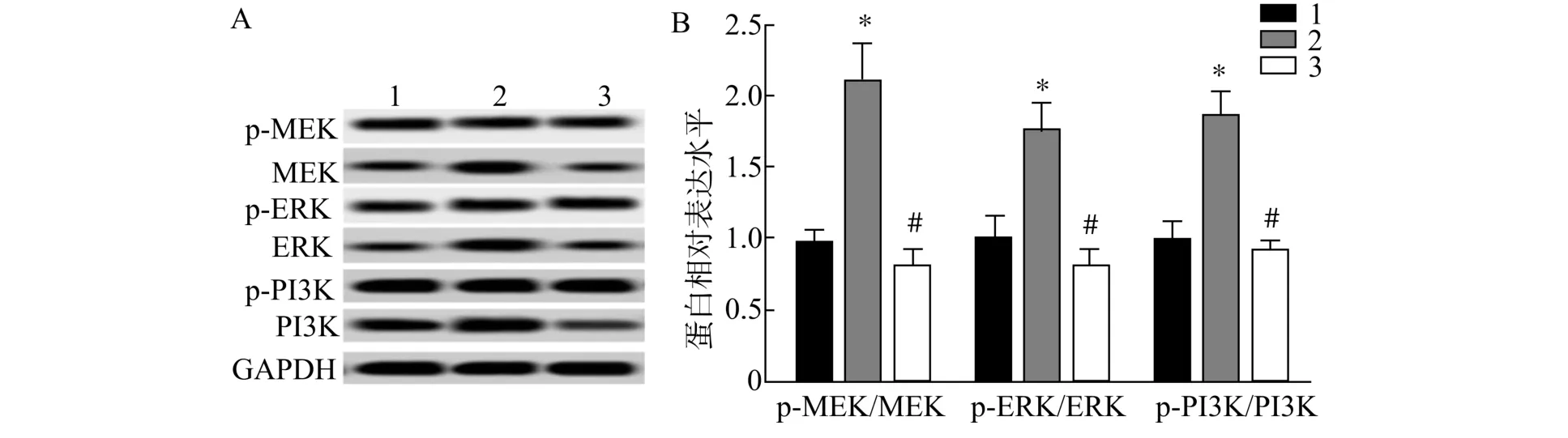
图4 BA 对MEK/ERK 和PI3K 信号通路的影响
2.5 BA 对MC3T3-E1 细胞成骨分化的影响
与RANKL 组比较,RANKL+BA 组OCN、OPN、Collagen Ⅰ蛋白表达,ALP 染色阳性性及ALP 活性均显著增加(P<0.05);与RANKL +BA组比较,RANKL +BA +740Y-P 组和RANKL +BA +Curcumin 组OCN、OPN、Collagen Ⅰ蛋白表 达,ALP 染色阳性率及ALP 活性均显著下降(P<0.05)(图5)。
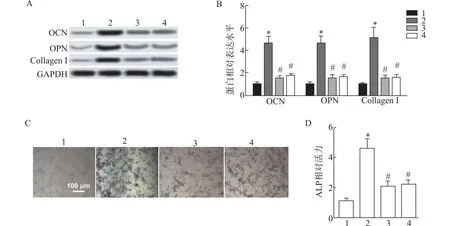
图5 BA 对MC3T3-E1 细胞成骨分化的影响
上述提示BA 能促进MC3T3-E1 成骨分化,其作用被PI3K 激动剂(740Y-P)、MEK/ERK 激动剂(姜黄素) 抑制。
3 讨论
成骨细胞的增殖与分化是骨形成的中心环节,增加了细胞外骨基质生成。近年来,炎症微环境被发现影响骨稳态的调节,骨微环境炎症失衡会导致骨形成/骨吸收平衡被破坏[8]。在类风湿关节炎患者,炎性介质促进破骨细胞功能,同时抑制成骨细胞功能,从而引起局部或全身性骨丢失[9]。在骨重塑过程中RANKL 信号具有重要作用,其与RANK 受体结合,引起NF-κB 激活,进而诱导IL-6等的表达[10];IL-6 是是炎症级联反应中的关键细胞因子,成骨细胞产生的IL-6 能进一步促进破骨细胞的前体细胞分化成熟,诱导骨吸收。有研究表明,敲除小鼠IL-6 基因可显著减轻其在接受卵巢切除术后的骨微结构恶化[11]。RANKL 信号传导对破骨细胞生成至关重要,Chen等[12]研究证实RANKL 信号通过抑制BMSCs 的成骨分化和促进破骨细胞生成来调节破骨细胞和成骨细胞平衡。因此本研究采用RANKL 处理MC3T3-E1 细胞以诱导炎症微环境,结果显示100 ng/mL RANKL 处理显著激活NF-κB,增加IL-6 的生成,与此同时OPN、OCN 及Collagen-Ⅰ的表达被明显抑制。这些结果表明100 ng/mL RANKL 处理能明显诱导炎症微环境、抑制MC3T3-E1 分化,而BA 预处理能明显抑制NF-κB/P65 的磷酸化,减少IL-6 生成。
在本研究中,BA 具有刺激成骨细胞分化的能力,但不能促进成骨细胞增殖。在体外前成骨细胞向成骨细胞分化过程中伴随一系列生理过程发生,包括胶原基质积累、ALP 表达、OPN 和OCN 的分泌、最后骨结节矿化[13-14]。在本研究中,10 μmol/L BA 干预能显著提高成骨分化过程中ALP 活性,蛋白质印迹实验结果提示BA 干预明显上调了骨基质蛋白OPN、OCN 及Collagen-Ⅰ的表达水平,这些数据提示BA 具有促成骨性分化作用。众多研究表明PI3K 信号通路及MEK/ERK 通路参与骨代谢调节[15-16]。在一项研究中,淫羊藿总黄酮主要活性成分淫羊藿苷通过靶向PI3K/Akt 通路对OP 模型小鼠的骨质疏松症状具有改善作用[16]。在本研究中,笔者进一步研究发现PI3K 激动剂740Y-P 和MEK/ERK 激动剂姜黄素能明显抑制BA 的上述促成骨分化作用。在蛋白质印迹实验中,BA 能明显抑制MEK、ERK、PI3K 的磷酸化过程。而PI3K、MEK 和ERK 磷酸化则是PI3K/Akt 与MEK/ERK 信号通路激活的标志性信号,提示PI3K 和MEK/ERK 信号通路参与了BA 促MC3T3-E1 成骨分化过程。然而BA 如何调控MEK/ERK 和PI3K 信号通路,其机制仍有待进一步明确。
综上所述,BA 能通过抑制NF-κB 活化及IL-6的分泌,改善炎症微环境,同时抑制MEK/ERK 和PI3K 信号通路,促进成骨分化。然而BA 是如何调节MEK/ERK 和PI3K 信号通路,其机制有待进一步研究。另外本研究仅基于细胞水平探讨BA 促成骨分化作用及其机制,后续仍需通过动体内实验进一步验证。

