KIF20A 基因对肝癌Huh7 细胞放射敏感性的影响及作用机制的研究
汪超 ,杨健睿 ,李治君 ,吴林 ,张军
三二○一医院1医学检验科,2肝胆胰腺外科 陕西省汉中市,723000
驱动蛋白家族成员20A(kinesin family member 20A,KIF20A) 是驱动蛋白超家族的成员之一,是细胞分裂所需的微管运动相关蛋白。以往研究显示,KIF20A 在多种恶性肿瘤中过度表达,包括卵巢癌、乳腺癌和神经胶质瘤等,促进肿瘤的发生、发展、侵袭、转移和血管生成,并导致患者预后不良[1-3]。近期Xiu等[4]发现,KIF20A 参与调控肺癌细胞的放射敏感性。KIF20A 在肝癌组织和细胞系中表达上调,并与肝癌的临床分期及患者预后不良密切相关[5]。然而,KIF20A 参与肝癌的放射敏感性很少被报道。因此,本研究旨在探究KIF20A 基因对肝癌Huh7 细胞放射敏感性的影响,并探究其可能的作用机制,以期为增加肝癌对放射治疗的敏感性提供新的途径。
1 材料和方法
1.1 细胞和主要试剂
人肝癌细胞株Huh7(中国科学院上海细胞研究所);青链霉素混合溶液、胎牛血清、杜氏改良伊格尔培养基(DMEM)、胰蛋白酶(美国Gibco公司);KIF20AsiRNA(KIF20AsiRNA1 正义链为5′-GGCCAGGUUUCUGCCAAAATT-3′,反义链为5′-UUUUGGCAGAAACCUGGCCTT-3′;KIF20AsiRNA2正义链为5′-AGCCGCAGAGCACAACTC-3′,反义链为5′-CCGCCTCCCTCTTAGCATAA-3′;KIF20AsiRNA3 正义链 为5′-GCCAACTTCATCCAACACCT-3′,反义链为5′-GTGGACAGCTCCTCCTCTTG-3′;后续实验选择干扰效率最高的KIF20AsiRNA1 进行探究) 和非特异性siRNA 对照(上海生工生物工程有限公司);pLKO.1 puro 慢病毒载体(深圳市宝珠生物科技有限公司);Trizol 抽提RNA 试剂(北京索莱宝生物科技有限公司);逆转录试剂盒、SYBR Green PCR Master Mix 检测试剂盒(日本TaKaRa 公司);二喹啉甲酸(bicinchoninic acid,BCA) 蛋白浓度测定试剂盒、电化学发光(electrochemi-Luminescence,ECL) 化学发光试剂(美国Thermo 公司);聚偏二氟乙烯(polyvinylidene fluoride,PVDF) 膜(美国Millipore 公司);细胞计数试剂盒8(cell counting kit 8,CCK-8) 细胞活性检测试剂(日本同仁化学研究所);放射免疫沉淀(radio immuno precipitation assay,RIPA) 细胞裂解液(碧云天生物技术研究所);磷脂酰肌醇-3 激酶(phospoinositide 3-kinase,PI3K)、蛋白激酶B(protein kinase B,Akt) 和磷酸化蛋白激酶B(phosphorylation protein kinase B,p-AKT) 单克隆抗体(美国CST公司,4292、9272、9271);KIF20A、辣根过氧化物酶标记的二抗(英国Abcam公司,ab70791、ab6721);Transwell小室(美国Corning 公司);Matrigel 基质胶(美国BD 公司)。
1.2 细胞培养
肝癌细胞株Huh7 常规复苏后,在含10 %胎牛血清的DMEM 培养液中培养,于37 ℃5 % CO2细胞培养箱中孵育。观察Huh7 细胞生长状况,细胞贴壁后待汇合度在90 %以上时,用胰蛋白酶消化并传代。取处于对数生长期的Huh7 细胞用于后续实验研究。
1.3 构建稳定沉默KIF20A 的Huh7 细胞株
KIF20AsiRNA 和非特异性siRNA 分别克隆到慢病毒载体pLKO.1 puro 上并完成包装(该部分实验由上海生工生物工程有限公司完成)。将对数期的Huh7 细胞分为空白对照(Blank) 组、阴性对照(si-NC) 组和KIF20A沉默(si-KIF20A) 组。si-NC 组和si-KIF20A 组Huh7 细胞按照MOI 值为50 分别感染非特异性siRNA和KIF20AsiRNA 慢病毒重组载体质粒,Blank 组不做感染处理。细胞感染后于37 ℃培养箱继续培养,并使用0.5 g/L 嘌呤霉素进行筛选,获得稳定沉默KIF20A 的Huh7细胞株。
1.4 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR) 实验
按照Trizol 试剂抽提总RNA,取2 μL RNA 以超微量核酸检测仪测定纯度,按照逆转录试剂盒合成cDNA。以cDNA 为模板,β-actin 为内参,使用SYBR Green PCR Master Mix 试剂盒行qPCR。KIF20A 上游引物5′-ACTTTGCGGCTATGCGAGGAT-3′,下游引物5′-TGAGAAGATGCTGTGACTGCG-3′。β-actin 上游引物5′-CATGTACGTTGCTATCCAGGC-3′,下游引物5′-CTCCTTAATGTCACGCACGAT-3′。设20 μL 反应体系: 2 × SYBR Green PCR Master Mix 10 μL,上下游引物各1 μL,cDNA 2 μL,ddH2O 6 μL。分别获取目的基因和内参基因的Ct值,并采用2-ΔΔCt法分别计算目的基因KIF20AmRNA 相对表达量。
1.5 蛋白质印迹实验
采用RIPA 法提取细胞中总蛋白,并按BCA 试剂盒测定蛋白浓度,以适量上样缓冲液混合,加热变性。取40 μg 蛋白样品,行电泳分离蛋白,电转至PVDF 膜上,浸入5 %脱脂奶粉室温封闭1 h,洗膜后加入相应稀释的一抗(KIF20A 一抗稀释比为1∶1 000、PI3K 一抗稀释比为1∶800、AKT 一抗稀释比为1 ∶800、p-AKT 一抗稀释比为1 ∶800),4 ℃过夜孵育,再加入稀释比为1∶2 000 的二抗,室温孵育2 h,采用ECL 化学发光显影,采用成像系统曝光并获取图像,以GAPDH 进行标定,采用Image J 分析软件对目的蛋白相对表达量进行分析。
1.6 X 射线照射及CCK-8 法检测
对数增殖期的肝癌Huh7 细胞以胰酶消化,制成1 ×105个/mL 的单细胞悬液,以5 ×103个/孔接种到96 孔板中,于37 ℃常规培养箱继续培养。采用ELEKTA Synergy 直线加速器照射装置分别给予不同剂量(0、2、4、6、8 Gy) 的X 射线照射24 h,剂量率为200 cGy/min,源距为100 cm,每照射剂量设置3 个平行复孔。每孔加入10 μL CCK-8溶液,37 ℃孵育4 h,使用酶标仪测定450 nm 波长处吸光度值。
1.7 集落形成实验
将接受剂量为4 Gy 照射的si-NC 组和si-KIF20A 组Huh7 细胞分别记为si-NC+4 Gy 组和si-KIF20A+4 Gy 组。将si-NC 组、si-KIF20A 组、si-NC+4 Gy 组和si-KIF20A+4 Gy 组Huh7 细胞以胰酶消化,计数后制成单细胞悬液,分别接种在10 cm 组织培养皿中的软琼脂中,37 ℃下培养至集落形成。取出培养皿用4 %多聚甲醛固定,用吉姆萨染色,并用肉眼或显微镜计数集落形成数。集落形成率(%)=(形成的菌落数/接种的细胞数) ×100 %。
1.8 流式细胞术实验
将si-NC 组、si-KIF20A 组、si-NC +4 Gy 组和si-KIF20A+4 Gy 组Huh7 细胞以预冷的PBS 洗涤,加入胰酶消化,离心收集细胞,将细胞密度调整为1 ×106个/mL,取100 μL 细胞悬液加入到流式检测管中,向管中分别加入5 μL AnnexinⅤ-FITC 和5 μL PI,避光反应15 min,加入400 μL 1 ×Binding Buffer 缓冲液,以流式细胞仪检测细胞凋亡情况。
1.9 Transwell 侵袭实验
将Matrigel 基质胶于4 ℃冰箱溶解,使用不含血清的DMEM 培养液进行稀释,加入到Transwell小室的每个上室进行包被。将si-NC 组和si-KIF20A 组Huh7 细胞以3 ×104个/孔接种Transwell上室,在下室中加500 μL 含血清的DMEM 培养液,于37 ℃培养箱过夜培养,行X 射线照射,37 ℃继续培养48 h。取出小室,擦去上室未穿膜的细胞,固定、染色,分别计算各组穿膜细胞数。
1.10 划痕愈合实验
在6 孔板背面用记号笔每隔0.5~1 cm 划横线,将si-NC 组和si-KIF20A 组Huh7 细胞以3 ×103个/孔接种6 孔板中,于37 ℃培养箱过夜培养,待细胞密度约为90 %时,用灭菌的枪头垂直背面横线进行划痕,随后行4 Gy 剂量X 射线照射,37 ℃继续培养48 h,观察各组Huh7 细胞迁移情况,划痕宽度(%)=(0 h 划痕宽度-48 h 划痕宽度)/0 h 划痕宽度×100 %。
1.11 统计学分析
采用版本为SPSS 21.0 统计学软件对实验数据进行统计分析,以上实验均至少独立重复3 次,计量资料以表示,采用单因素方差分析多组间差异,采用SNK-q检验分析两两组间差异。
2 结果
2.1 X 射线照射诱导肝癌Huh7 细胞中KIF20A mRNA 的上调表达
肝癌Huh7 细胞中KIF20A的mRNA 表达水平随着X 射线照射剂量(0、2、4、6、8 Gy) 的增加而增加(P<0.05)。照射剂量为4 Gy时KIF20AmRNA 的表达水平差异显著,因此后续实验选择4 Gy 为实验照射剂量(图1)。
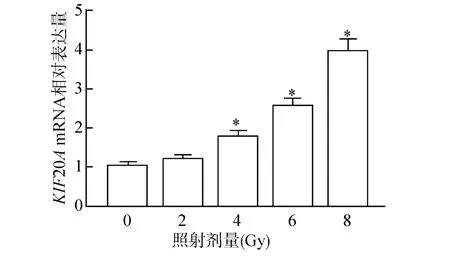
图1 不同照射剂量对肝癌Huh7 细胞中KIF20A mRNA表达的影响
2.2 构建稳定沉默KIF20A 的Huh7 细胞株
与si-NC 组比较,si-KIF20A 组Huh7 细胞中KIF20AmRNA 和蛋白表达量均显著降低(P<0.05)(图2)。
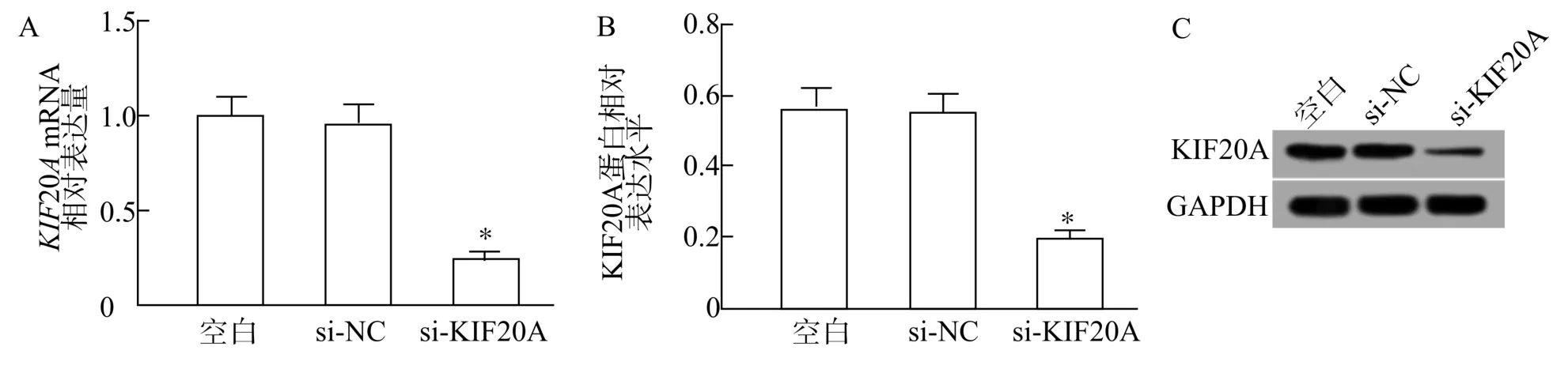
图2 各组Huh7 细胞中KIF20A mRNA 和蛋白表达量比较
2.3 沉默KIF20A 抑制Huh7 细胞存活
si-KIF20A 组Huh7 细胞存活率明显低于si-NC组(P<0.05),细胞集落形成率明显低于si-NC 组(P<0.05);si-KIF20A +4 Gy 组Huh7 细胞集落形成率明显低于si-NC+4 Gy 组(P<0.05)(图3 和表1)。
表1 各组Huh7 细胞集落形成率比较()
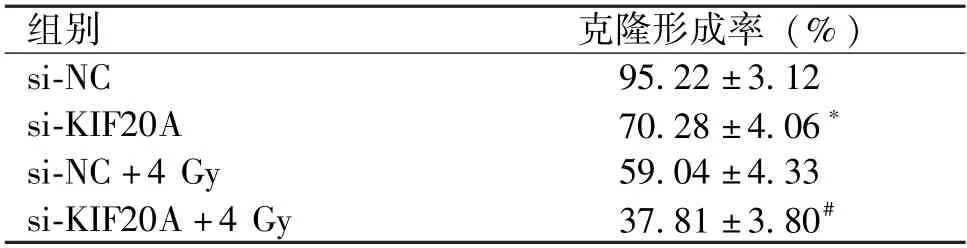
表1 各组Huh7 细胞集落形成率比较()
与si-NC 组比较,∗P<0.05;与si-NC+4 Gy 组比较,#P<0.05
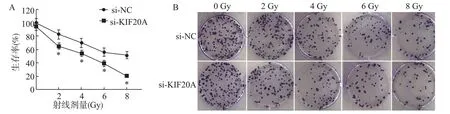
图3 不同处理对肝癌Huh7 细胞存活和集落形成能力的影响
2.4 沉默KIF20A 促进Huh7 细胞凋亡
si-KIF20A 组Huh7 细胞凋亡率明显高于si-NC组(P<0.05),si-KIF20A +4 Gy 组Huh7 细胞凋亡率显著高于si-NC+4 Gy 组(P<0.05)(图4 和表2)。
表2 各组Huh7 细胞凋亡率比较()

表2 各组Huh7 细胞凋亡率比较()
与si-NC 组比较,∗P<0.05;与si-NC +4 Gy 组比较,#P<0.05

图4 不同处理对肝癌Huh7 细胞凋亡的影响
2.5 沉默KIF20A 抑制Huh7 细胞侵袭和迁移
si-KIF20A 组Huh7 细胞相对划痕宽度和穿膜细胞数均明显低于si-NC 组(P<0.05),si-KIF20A+4 Gy 组Huh7 细胞相对划痕宽度和穿膜细胞数显著低于si-NC+4 Gy 组(P<0.05)(图5 和表3)。
表3 各组Huh7 细胞相对划痕宽度和穿膜细胞数比较()

表3 各组Huh7 细胞相对划痕宽度和穿膜细胞数比较()
与si-NC 组比较,∗P<0.05;与si-NC+4 Gy 组比较,#P<0.05
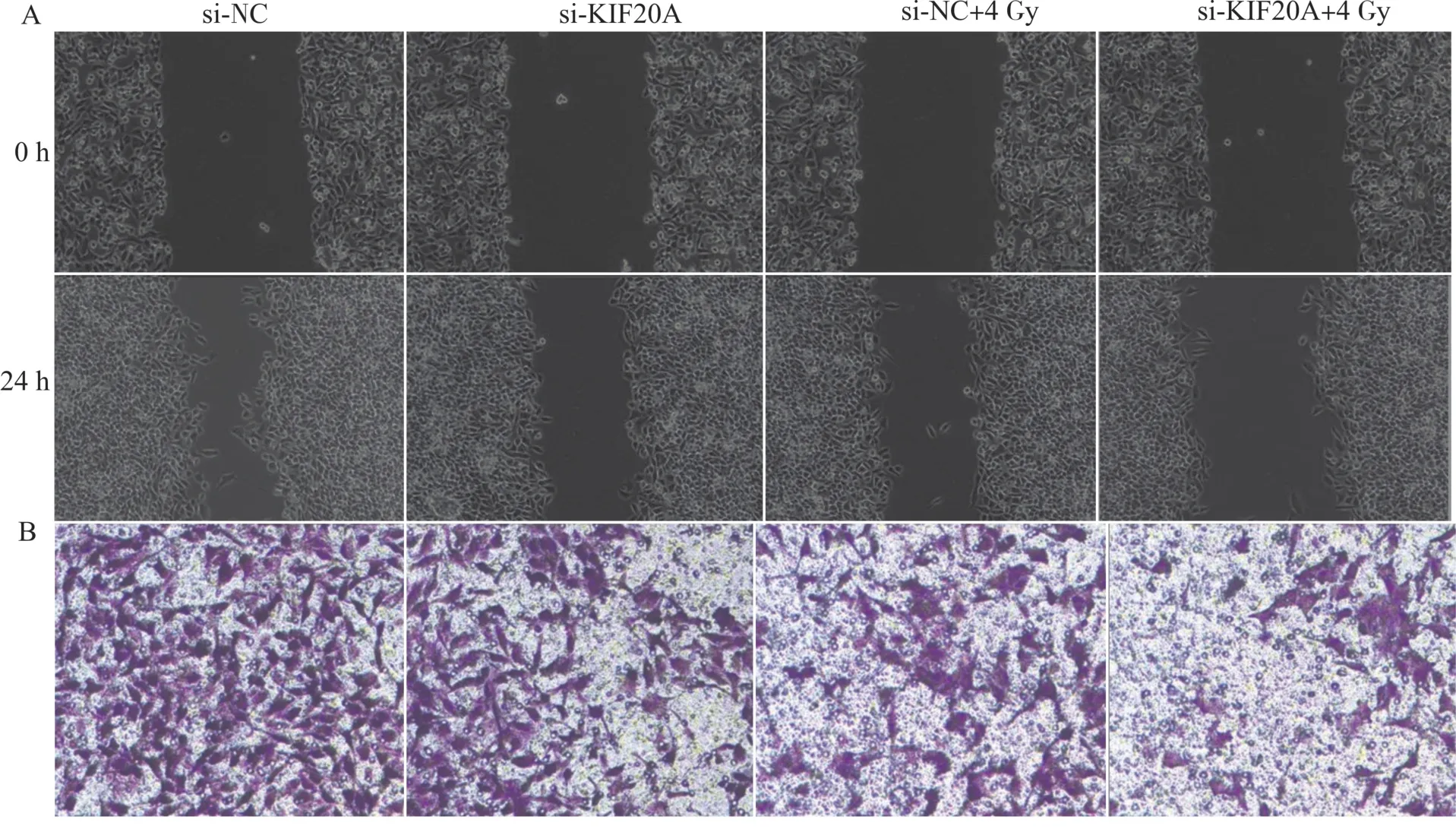
图5 各组Huh7 细胞侵袭和迁移能力
2.6 沉默KIF20A 抑制Huh7 细胞中PI3K/AKT 信号通路的激活
si-KIF20A 组PI3K 和p-AKT 蛋白表达明显低于si-NC 组(P<0.05),si-KIF20A +4 Gy 组Huh7细胞中PI3K 和p-AKT 蛋白表达明显低于si-NC +4 Gy 组(P<0.05)(图6)。
3 讨论
近年来,肝癌发病率和死亡率呈逐年上升的趋势,严重影响着人类的健康和生命[6]。放射治疗是晚期肝癌的一种非侵入性疗法。然而,肝癌的放射抗性仍然是影响治疗效果的一个关键障碍[7]。据报道,KIF20A在肝癌、胰腺癌和结肠癌等组织中表达升高,其异常表达促进肿瘤迁移和侵袭,与预后不良和耐药性密切相关[8-11]。然而,KIF20A与肿瘤放疗之间的关系至今尚不十分清楚。
本研究发现,随着X 射线照射剂量的增加,肝癌Huh7 细胞中KIF20AmRNA 的表达量逐渐升高,提示KIF20A基因可能与肝癌Huh7 细胞的放射敏感性有关。为进一步探究KIF20A基因对肝癌Huh7 细胞放射敏感性的影响及可能的机制,本实验通过慢病毒感染法将KIF20AsiRNA 转染至Huh7细胞,结果显示转染KIF20AsiRNA 能够显著下调Huh7 细胞中KIF20A的表达,表明成功构建了稳定沉默KIF20A的Huh7 细胞株。进一步研究发现,沉默KIF20A表达显著抑制Huh7 细胞存活、集落形成、侵袭和迁移,并促进细胞凋亡,与相关研究结果一致[12-14]。在暴露于X 射线后,KIF20A沉默的Huh7 细胞侵袭和迁移能力明显减弱,凋亡能力明显增加,提示siRNA 介导的KIF20A基因沉默可以增强肝癌细胞对放疗的敏感性。
PI3K/AKT 信号通路与肿瘤(包括肝癌) 的发生和进展密切相关[15-16]。PI3K/AKT 信号途径的激活可以导致对放疗和化疗的抗性,并且抑制该途径可以增加癌细胞对治疗的敏感性[17-19]。最后,本实验还表明,在KIF20A沉默后,PI3K/AKT 信号通路相关蛋白因子PI3K 和p-AKT 水平明显下调,提示KIF20A可能通过PI3K/AKT 信号通路影响肝癌细胞放射敏感性。
综上所述,KIF20A可通过PI3K/AKT 信号通路影响肝癌细胞对放疗的敏感性。因此,靶向KIF20A及其相关信号轴是一种新颖且有前途的治疗策略,以增强肝癌的放射敏感性。然而本实验尚存在不足之处,本实验未检测该信号通路上下游分子的变化,亦未添加信号通路激动剂或抑制剂加以验证,并且是否涉及其他信号通路尚不清楚,后续实验将对该部分进行深入探究。此外,本实验未涉及动物体内实验,后续研究将对此补充并验证本实验结果。

