白细胞介素家族在系统性硬化症中的作用
郭容宏,温鸿雁
作者单位:030001 太原,山西医科大学第二医院风湿免疫科
系统性硬化症(systemic sclerosis,SSc)是一种以异常的免疫激活、血管损伤导致的新生血管生成及重塑受损、皮肤和内脏器官纤维化为主要特征的自身免疫性疾病[1]。SSc通常分为局限性皮肤型系统性硬化症、弥漫性皮肤型系统性硬化症。SSc的发病机制复杂,迄今为止尚未完全了解,但众多研究表明异常的免疫功能激活分泌多种细胞因子等影响疾病进展[2]。白细胞介素(interleukins,ILs)是一类具有免疫调节功能的细胞因子,根据序列同源性、功能以及受体链相似性,白细胞介素可分为IL-1家族、γc家族(common γ chain family,γc)、趋化因子家族、IL-10家族、IL-6/IL-12家族、IL-17家族[3](表1)。ILs的功能复杂多样,通过参与固有免疫应答、促进特异性免疫细胞增殖分化、招募炎性细胞等方式调节免疫反应。ILs在SSc中发挥着重要作用[4](图1)。本文系统地综述白细胞介素家族成员在SSc中的表达及作用。
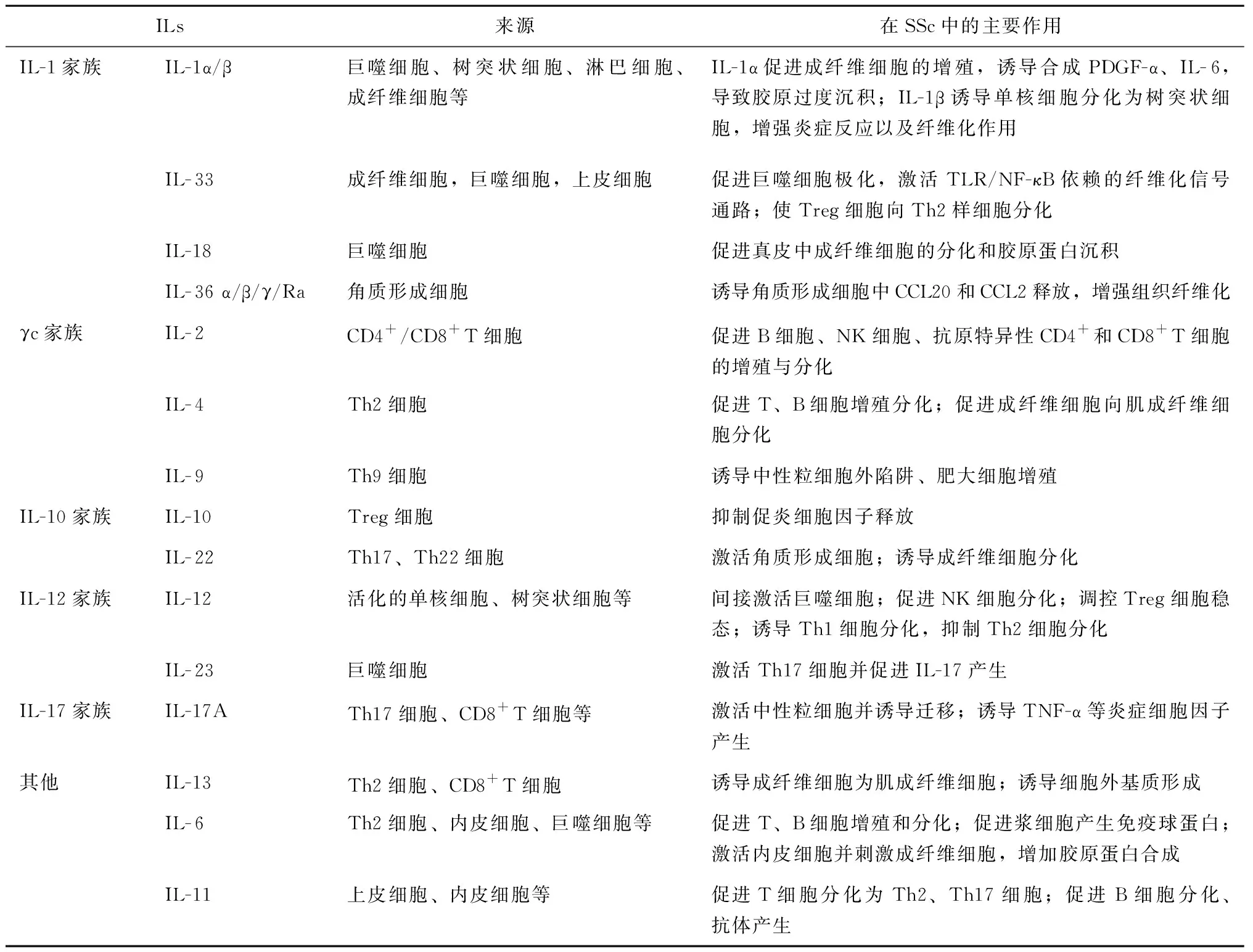
表1 白细胞介素家族成员、来源细胞及在SSc中的主要作用Table 1 Interleukin family members,source cells,and their major roles in SSc

图1 白细胞介素家族参与系统性硬化症的发病机制Fig 1 Interleukin family involved in the pathogenesis of systemic sclerosisILs:白细胞介素;PDGF-α:血小板衍生生长因子;Treg细胞:调节性T细胞;Th细胞:辅助性T细胞;CCL20:趋化因子配体20;TNF-α:肿瘤坏死因子-α;TGF-β:转化生长因子-β
1 白介素家族在SSc的表达及作用
1.1 白细胞介素-1家族
白细胞介素-1家族又称淋巴细胞刺激因子,包括IL-1α、IL-1β、IL-1Ra、IL-18、IL-33、IL-36α、IL-36 β、IL-36 γ、IL- 36Ra、IL-37和IL-38,其由多种类型细胞分泌,生物学功能通常是促进炎症反应及纤维化进程[5]。
1.1.1 IL-1α、IL-1β:研究发现SSc患者血清中IL-1α以及IL-1β水平明显高于健康对照组,支气管肺泡灌洗液中IL-1β浓度也明显升高[6],且IL-1α水平升高的SSc患者中关节挛缩患病率明显低于正常水平的患者[7]。SSc患者受损皮肤中IL-1α的表达增加,可促进成纤维细胞的增殖并诱导成纤维细胞合成PDGF-α、IL-6,进而导致胶原过度沉积[8]。最新研究表明SSc患者中IL-1β可激活微血管内皮细胞并诱导单核细胞分化为树突状细胞,增强炎症反应以及纤维化作用,且与SSc患者的早期疾病表现和肺部受累相关[6]。
1.1.2 IL-33:IL-33通过激活其可溶性受体(ST2)参与T细胞介导的免疫应答。SSc患者血清及受损皮肤组织中IL-33和ST2水平均升高[9-10],合并肺间质纤维化的SSc患者支气管肺泡灌洗液中IL-33水平也显著升高。此外,研究表明IL-33与皮肤硬化的程度、肺间质纤维化的严重程度呈正相关[11]。Kurowska-Stolarska[12]等发现在SSc中IL-33/ST2通过促进巨噬细胞M2极化,并产生IL-13和TGF-β,从而激活TLR/NF-κB依赖的纤维化信号通路来增强TGF-β依赖的纤维化过程。此外,MacDonald等认为在皮肤受累的SSc患者中,IL-33/ST2通路使Treg细胞功能丧失并向Th2样细胞分化,加重皮肤组织的炎症反应。IL-33抑制剂可能为治疗SSc患者纤维化提供新疗法[13]。
1.1.3 IL-18:IL-18主要由巨噬细胞产生,Mosaad等[14]发现SSc患者血清IL-18水平显著升高,且与肾脏受累相关。IL-18可促进SSc真皮中成纤维细胞的分化和胶原蛋白沉积。IL-18发挥促纤维化的机制可能受到上游细胞因子的诱导,其机制仍需进一步深入研究。
1.1.4 IL-36:IL-36(IL-36α、β、γ和IL-36Ra)主要由角质形成细胞产生。Steven O’Reilly的研究表明SSc患者血清IL-36α水平显著升高,IL-36α诱导角质形成细胞中CCL20和CCL2的释放,增强组织纤维化[15]。
1.2 γc家族
γc家族的成员有:IL-2、IL-4、IL-7、IL-9、IL-15和IL-21,均与γc受体结合发挥生物学作用,其主要是通过调节各种免疫细胞的增殖及分化来参与SSc的发病机制中的免疫反应。
1.2.1 IL-2:IL-2能够促进抗原特异性CD4+和CD8+T细胞的增殖。IL-2基因位点影响SSc的遗传易感性[16]。SSc患者外周血中IL-2及可溶性IL-2受体水平较高[17]。IL-2对Treg细胞的发育至关重要;可作为B细胞的生长因子并刺激抗体产生;可促进NK细胞的增殖和分化,并增加其细胞杀伤功能[3]。
1.2.2 IL-4:IL-4主要由Th2细胞产生[3],多项研究结果表明SSc患者血清及受损皮肤中IL-4水平较高,其促进成纤维细胞增殖并产生细胞外基质加重组织纤维化[18]。IL-4激活JNK/ERK通路,诱导成纤维细胞中胶原蛋白的基因表达,并促进成纤维细胞向肌成纤维细胞分化;IL-4还可控制T及B细胞增殖分化,加重组织炎症反应[19]。
1.2.3 IL-9:IL-9主要由Th9细胞产生[3],Guggino等[20]研究发现SSc患者受损皮肤中Th9细胞增加,IL-9/IL-9R表达也随之上调;在伴有肾危象的SSc患者肾活检标本中检测到IL-9表达也增加。这可能与IL-9能够诱导中性粒细胞外陷阱、促进B细胞产生SSc特异性自身抗体以及肥大细胞增殖有关。
1.3 白细胞介素-10家族
白细胞介素-10家族包括IL-10、IL-19、IL-20、IL-22、IL-24、IL-26、IL-28和IL-29[3]。IL-10是由T细胞、NK细胞和树突状细胞等多种细胞产生的抗炎细胞因子,能够抑制促炎细胞因子的释放。SSc患者血清中IL-10水平增高,且在关节受累的SSc患者中显著增加[17]。这可能是增加了IL-6等炎症细胞因子的反馈回路,其通过调控T细胞共刺激因子的信号通路直接影响T细胞活化,并促进B细胞的产生、增殖和分化,增加相关抗体的产生[21]。IL-22由Th17、Th22细胞等多种细胞类型产生,SSc患者血清及受累皮肤中IL-22水平显著升高,IL-22促进角质形成细胞的活化,并诱导成纤维细胞分化,加重组织纤维化[22]。
1.4 白细胞介素-12家族
白细胞介素-12家族包括IL-12、IL-23、IL-27、IL-35。IL-12是由活化的单核细胞、巨噬细胞等细胞产生的促炎细胞因子。SSc患者血清中IL-12水平显著升高,且与肾血管损伤有关[23],其间接激活巨噬细胞,促进NK细胞的分化和增强细胞杀伤功能,并调控Treg细胞的稳态,可与IFN-γ结合诱导Th1细胞分化,抑制Th2细胞分化。SSc患者血清中IL-23水平均显著升高通过激活Th17细胞来刺激IL-17的产生,发挥免疫调节作用;并能够刺激成纤维细胞的增殖和胶原合成来加重组织纤维化[24]。
1.5 白细胞介素-17家族
白细胞介素-17家族是由 IL-17A 至IL-17F 组成,与多种自身免疫性疾病有关[3]。IL-17A主要是由Th17细胞产生的促炎细胞因子,能够激活中性粒细胞并诱导其迁移,刺激一氧化氮、前列腺素的产生;此外,可以诱导其他炎症细胞因子的产生,如TNF-α,IL-1,IL-6等。SSc患者血清以及受损皮肤中Th17细胞和IL-17水平升高,与疾病严重程度、肺部病变和胶原蛋白过度产生相关[25]。
1.6 其他细胞因子
1.6.1 IL-13:IL-13主要由Th2细胞分泌,其序列、结构和功能与IL-4类似。SSc患者血清中IL-13水平升高。IL-13诱导成纤维细胞分化为肌成纤维细胞,进而诱导细胞外基质的形成和组织纤维化[18]。Furuse等[26]证实SSc患者外周血中的CD8+T细胞也产生了高水平的IL-13,在活动性弥漫性皮肤型SSc患者中表现更为明显。IL-4及IL-13具有协同作用,IL-4/IL-13介导T细胞和成纤维细胞之间的相互作用,有助于将SSc疾病进展从炎症期过渡到纤维化期。
1.6.2 IL-6:IL-6由Th2细胞、成纤维细胞等多种细胞产生,参与调节免疫反应、急性期反应、造血。IL-6刺激肝细胞合成C反应蛋白、纤维蛋白原、血清淀粉样蛋白A等;还促进T细胞、B细胞增殖和分化,以及浆细胞产生IgG、IgA和IgM来调节免疫反应,因此参与了各种免疫介导的炎性疾病[3]。IL-6基因多态性与SSc的易感性具有相关性[27]。大量研究表明SSc患者受损皮肤以及血清中检测出高水平的IL-6。此外,从SSc患者受损皮肤区域分离出成纤维细胞上清液中IL-6浓度是正常皮肤组织的6-30倍的。IL-6水平与改良Rodnan皮肤评分(mRSS)相关[17,21]。在SSc疾病早期,IL-6水平升高,激活内皮细胞、活化T细胞、刺激成纤维细胞,增加胶原蛋白的合成加重纤维化。最近的临床研究表明使用托珠单抗(抗人IL-6R的单克隆抗体)治疗可改善SSc患者的肺功能[28]。
1.6.3 IL-11:IL-11由基质细胞产生,与IL-11Ra和gp130结合发挥生物学功能。IL-11促进T细胞分化为Th2、Th17细胞表型;促进B细胞分化、抗体的产生。IL-11在SSc患者血清中升高,且患者的皮肤成纤维细胞以及肺成纤维细中高表达。IL-11在SSc中的致病作用尚未确定,可能是通过TGF-β介导的[29]。
2 展望
系统性硬化症的发病机制是一个复杂的过程,参与其发病机制的细胞因子众多,除上述白介素家族外,还涉及干扰素、内皮素、肿瘤坏死因子等。各种细胞因子形成复杂的细胞因子网络,相互调节、相互作用。本文概述目前常见的白介素家族与系统性硬化症的相关性研究,并阐述其参与发病可能机制,总结白介素家族可能作为SSc的潜在的生物标志物,基于细胞因子所研发的生物制剂有望为SSc的治疗提供新的思路和方法。

