6-N杂环取代血根碱衍生物的合成、结构表征、生物活性与构效关系
贾长青, 马瑞, 钱玺丞, 覃兆海, 许厚强
6-杂环取代血根碱衍生物的合成、结构表征、生物活性与构效关系
贾长青1,3, 马瑞1, 钱玺丞1, 覃兆海2, 许厚强3
(1. 铜仁职业技术学院, 国家工程研究中心, 铜仁 554300;2. 中国农业大学理学院, 北京 100193; 3. 贵州大学生物学博士后科研流动站, 贵阳 550000)
以血根碱为先导, 通过活性基团拼接方法, 设计合成了一类结构新颖的6-杂环取代血根碱衍生物. 目标化合物的结构均通过核磁共振波谱(NMR)、 红外光谱(IR)和高分辨质谱(HRMS)确证. 采用生长速率法测定了目标化合物的体外抑菌活性, 并对其构效关系进行了分析. 初步抑菌活性测试结果表明, 目标化合物3a-06, 3a⁃07, 3b⁃01, 3c-07和3c-08对10种供试病原菌表现出相对广谱的抑菌活性, 在50 μg/mL浓度下, 对多数供试病原菌抑制率在72%以上. 精密毒力测定结果显示, 部分目标化合物表现出优良的抑菌活性. 化合物3b-01对茶叶炭疽病菌和棉花立枯病菌的半最大效应浓度(EC50值)分别为8.52和9.77 μg/mL; 化合物3c-08对茶叶炭疽病菌和茶叶轮斑病菌的EC50值分别为9.17和8.83 μg/mL, 具有在茶叶病害防治方面应用的潜力. 与先导化合物血根碱盐酸盐相比, 多数目标化合物表现出较优的抑菌活性. 杀虫活性初步测定结果表明, 在400 μg/mL浓度下该类化合物对桃蚜的杀虫活性一般. 本文为血根碱衍生物的进一步开发利用提供了一定依据.
博落回; 血根碱衍生物;杂环; 生物活性; 构效关系
博落回是中国传统药用资源植物之一, 广泛分布于河南、 山东、 贵州及云南等地区, 现已在兽药、 饲料添加剂、 医药和化妆品等领域广泛应用[1,2]. 现有研究表明, 博落回富含多种生物碱, 主要功能活性成分为血根碱、 白屈菜红碱、 原阿片碱和别隐品碱等异喹啉类生物碱[3]. 血根碱(1)是博落回生物碱的主要有效成分之一, 以博落回果实中含量最高. 生物活性研究结果表明, 血根碱表现出多种生物学特性, 包括抗细菌、 抗真菌、 抗炎、 抗艾滋病病毒、 抗肿瘤或作为生物农药防治病虫害等[4~9].
基于天然产物的农药研究的最主要策略是以天然产物分子为母体进行结构衍生, 因此选择合适的天然产物作为先导化合物尤为重要. 血根碱因其具有多样的生物活性且来源于传统药用植物而备受关注. 对于血根碱的结构衍生, 已有文献[10~12]报道了利用血根碱或白屈菜红碱分子中亚胺键(C=N+)与烷氧基、 胺、 唑类及一些氢氧化物进行亲核加成反应得到的多种血根碱衍生物. 目前, 只有少量工作对这类血根碱衍生物的生物活性进行了研究, 结果表明血根碱或白屈菜红碱分子中C6位有烷氧基、 胺类、 氢氧化物取代的衍生物具有抗菌、 抗肿瘤及杀螨等活性[5,13,14]. 但对血根碱分子中C6位(Scheme 1)有唑类基团取代的血根碱衍生物的生物活性和构效关系尚未见文献报道. 另一方面, 氮杂环结构作为重要的功能基团, 广泛存在于农药和医药药物分子中[15]. 鉴于上述原因, 为进一步寻找具有优异活性的血根碱衍生物, 本文设计合成了目标化合物3(结构见Scheme 1), 并对其生物活性和构效关系进行了研究.

Scheme 1Design of the title compounds and atomic position number of sanguinarine
1 实验部分
1.1 试剂与仪器
四氢呋喃(THF, 分析纯)、 氢化钠(NaH, 纯度60%)、 对照药剂多菌灵、 吡虫啉和吡唑醚菌酯原药(纯度>97%), 国药集团化学试剂有限公司; 取代-1-杂环类化合物(2, 结构见Scheme 1, 纯度>97%), 上海阿拉丁化学试剂; 血根碱盐酸盐(1, 结构见Scheme 1, 纯度>98%)为本实验室利用高速逆流色谱法从博落回果荚中分离得到[16].
Bruker Avance NEO 500和NEO 600型核磁共振波谱仪(NMR), 德国Bruker公司; Hermo Scientific LTQ Orbitrap Discovery型高分辨质谱仪(HRMS), 德国Bremen公司; SGW X-4型显微熔点测定仪, 上海仪电物理光学仪器有限公司; iCAN9型傅里叶变化红外光谱仪(IR), 天津市能谱科技有限公司.
1.2 实验过程
目标化合物的合成路线如Scheme 2所示.
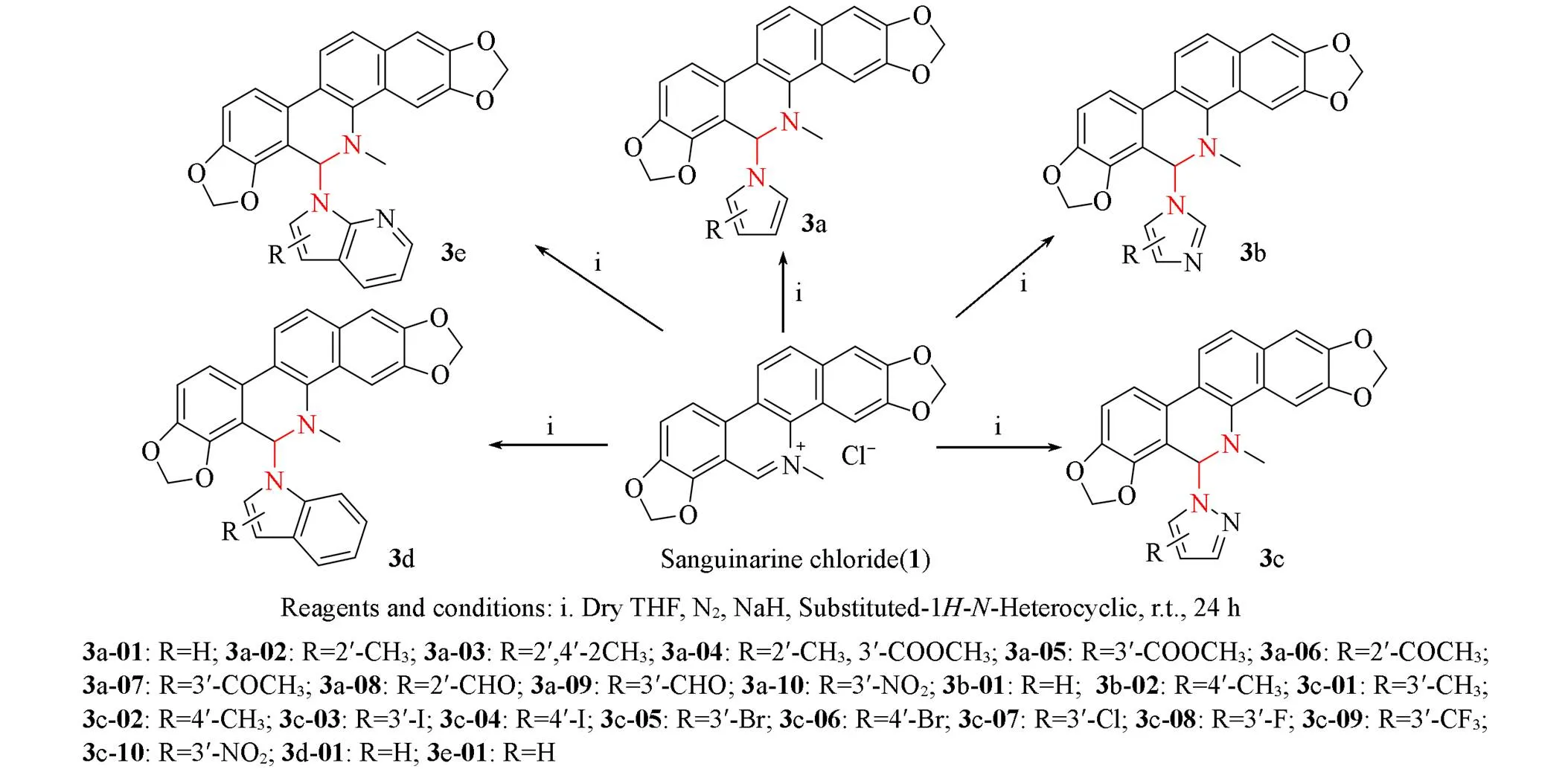
Scheme 2Preparation of the title compounds
将0.0033 mol取代-1-杂环类化合物2和30 mL干燥的四氢呋喃加入到100 mL干燥的三口烧瓶 中; 在N2气保护下, 向体系中加入0.0042 mol NaH, 室温下搅拌反应0.5 h; 在N2气保护下, 加入干 燥的血根碱盐酸盐(1)粉末(0.003 mol), 室温下剧烈搅拌反应18~24 h; 待反应较完全后, 加100 mL水淬灭反应. 用乙酸乙酯萃取, 合并有机相, 经干燥后浓缩得到粗品; 使用乙酸乙酯/石油醚(体积比 1∶3)或三氯甲烷/石油醚(体积比1∶3)混合溶液多次重结晶, 得到目标化合物3. 通过核磁共振氢谱、 碳谱、 红外光谱和高分辨质谱对目标化合物的结构进行了确认. 目标化合物3的物性数据列于表1和表2.

Table 1 Physico-chemical constants of title compound 3
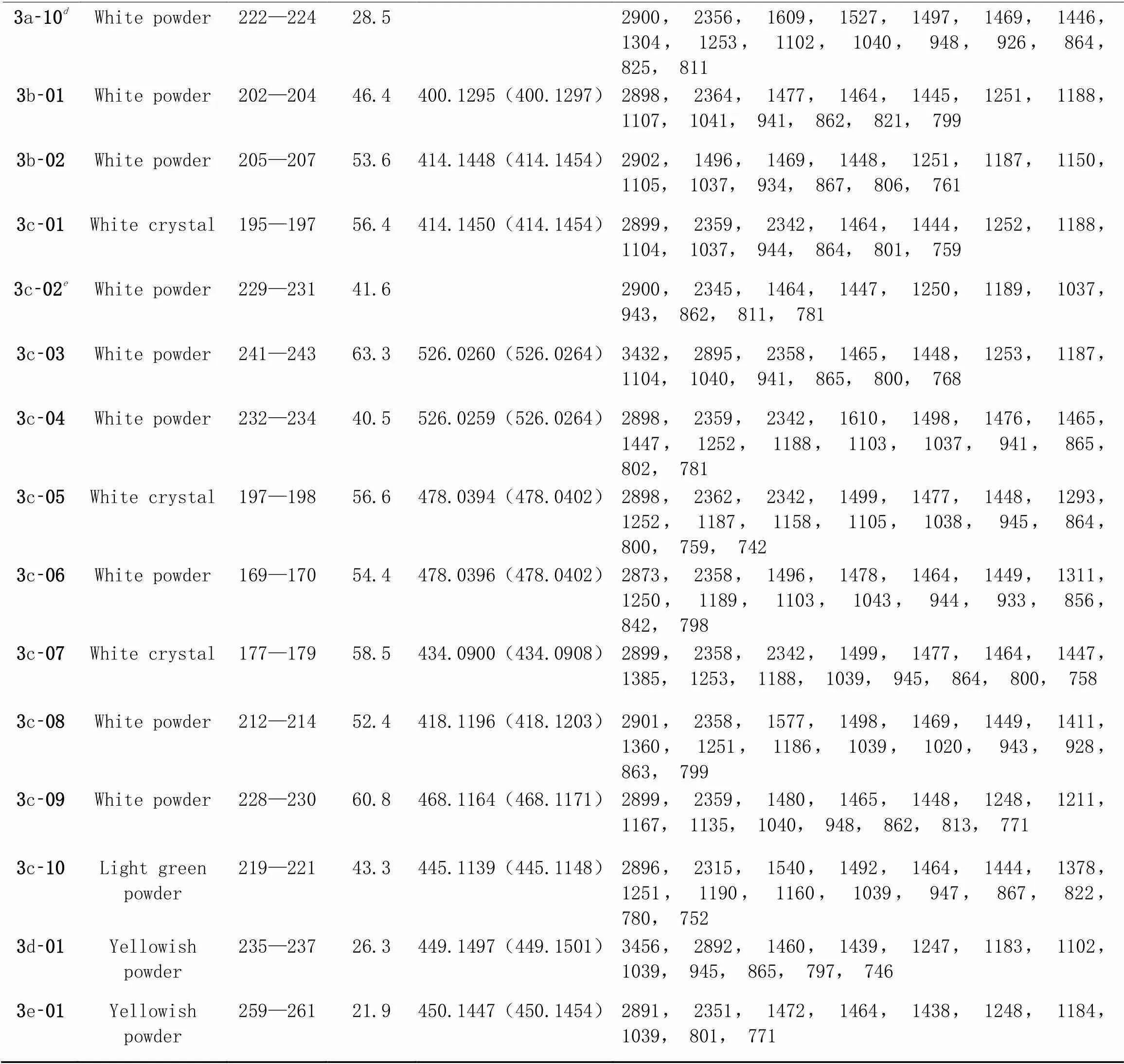
3a⁃10dWhite powder222—22428.52900, 2356, 1609, 1527, 1497, 1469, 1446, 1304, 1253, 1102, 1040, 948, 926, 864, 825, 811 3b⁃01White powder202—20446.4400.1295(400.1297)2898, 2364, 1477, 1464, 1445, 1251, 1188, 1107, 1041, 941, 862, 821, 799 3b⁃02White powder205—20753.6414.1448(414.1454)2902, 1496, 1469, 1448, 1251, 1187, 1150, 1105, 1037, 934, 867, 806, 761 3c⁃01White crystal195—19756.4414.1450(414.1454)2899, 2359, 2342, 1464, 1444, 1252, 1188, 1104, 1037, 944, 864, 801, 759 3c⁃02eWhite powder229—23141.62900, 2345, 1464, 1447, 1250, 1189, 1037, 943, 862, 811, 781 3c⁃03White powder241—24363.3526.0260(526.0264)3432, 2895, 2358, 1465, 1448, 1253, 1187, 1104, 1040, 941, 865, 800, 768 3c⁃04White powder232—23440.5526.0259(526.0264)2898, 2359, 2342, 1610, 1498, 1476, 1465, 1447, 1252, 1188, 1103, 1037, 941, 865, 802, 781 3c⁃05White crystal197—19856.6478.0394(478.0402)2898, 2362, 2342, 1499, 1477, 1448, 1293, 1252, 1187, 1158, 1105, 1038, 945, 864, 800, 759, 742 3c⁃06White powder169—17054.4478.0396(478.0402)2873, 2358, 1496, 1478, 1464, 1449, 1311, 1250, 1189, 1103, 1043, 944, 933, 856, 842, 798 3c⁃07White crystal177—17958.5434.0900(434.0908)2899, 2358, 2342, 1499, 1477, 1464, 1447, 1385, 1253, 1188, 1039, 945, 864, 800, 758 3c⁃08White powder212—21452.4418.1196(418.1203)2901, 2358, 1577, 1498, 1469, 1449, 1411, 1360, 1251, 1186, 1039, 1020, 943, 928, 863, 799 3c⁃09White powder228—23060.8468.1164(468.1171)2899, 2359, 1480, 1465, 1448, 1248, 1211, 1167, 1135, 1040, 948, 862, 813, 771 3c⁃10Light greenpowder219—22143.3445.1139(445.1148)2896, 2315, 1540, 1492, 1464, 1444, 1378, 1251, 1190, 1160, 1039, 947, 867, 822, 780, 752 3d⁃01Yellowish powder235—23726.3449.1497(449.1501)3456, 2892, 1460, 1439, 1247, 1183, 1102, 1039, 945, 865, 797, 746 3e⁃01Yellowish powder259—26121.9450.1447(450.1454)2891, 2351, 1472, 1464, 1438, 1248, 1184, 1039, 801, 771
. HRMS (ESI),: calcd. for C26H20N2NaO5(M+Na)+: 463.1270, found 463.1264;. HRMS(ESI),: calcd. for C26H20N2NaO5(M+Na)+: 463.1270, found 463.1264;. HRMS(ESI),: calcd. for C25H18N2NaO5(M+Na)+: 449.1113, found 449.1107;. HRMS (ESI),: calcd. for C24H17N3NaO6(M+Na)+: 466.1015, found 466.1010;. HRMS(ESI),: calcd. for C24H18N3O4(M‒H)‒: 412.1297, found 412.1290.

Table 2 1H and 13C NMR data of title compound 3


3a⁃047.86(d, J=8.7 Hz, 1H), 7.63(d, J=8.3 Hz, 1H), 7.59—7.51(m, 2H), 7.31(s, 1H), 7.20(d, J=8.2 Hz, 1H), 7.03(d, J=2.4 Hz, 1H), 6.52(d, J=1.2 Hz, 1H), 6.46(s, 1H), 6.25(d, J=0.8 Hz, 1H), 6.15(d, J=4.7 Hz, 3H), 4.02(dd, J=7.1, 2.8 Hz, 2H), 2.81(s, 3H), 1.95(s, 3H), 1.13(t, J=7.1 Hz, 3H)164.5, 148.7, 148.0, 147.8, 146.1, 137.9, 131.2, 126.4, 125.7, 125.0, 124.7, 122.7, 120.4, 120.1, 119.5, 117.5, 113.7, 110.2, 109.9, 104.8, 102.7, 101.9, 100.2, 68.6, 59.1, 42.0, 14.8, 12.2 3a⁃05*7.70(d, J=8.6 Hz, 1H), 7.65(s, 1H), 7.47(dd, J=8.4, 3.5 Hz, 2H), 7.18(t, J=1.8 Hz, 1H), 7.09(s, 1H), 7.06(d, J=8.2 Hz, 1H), 6.78—6.74(m, 1H), 6.38(dd, J=3.0, 1.7 Hz, 1H), 6.31(s, 1H), 6.16(d, J=1.3 Hz, 1H), 6.12—6.02(m, 3H), 3.68(s, 3H), 2.88(s, 3H)165.3, 148.5, 147.8, 147.5, 146.0, 137.5, 131.2, 126.6, 126.0, 124.6, 124.5, 122.8, 120.3, 119.9, 117.0, 115.3, 109.9, 109.7, 109.7, 104.6, 102.1, 101.2, 100.4, 69.5, 50.9, 41.9 3a⁃06*7.89(d, J=8.7 Hz, 1H), 7.66(d, J=8.3 Hz, 1H), 7.58—7.46(m, 1H), 7.26(s, 1H), 7.19(d, J=8.2 Hz, 1H), 7.11(s, 1H), 7.04(dd, J=3.8, 1.5 Hz, 1H), 6.28—5.98(m, 6H), 5.77—5.67(m, 1H), 2.81(s, 1H), 2.49(s, 1H)187.4, 148.1, 147.9, 147.6, 147.3, 139.4, 132.4, 130.9, 127.3, 125.7, 125.4, 124.5, 123.7, 120.5, 117.3, 116.6, 115.3, 110.1, 108.7, 104.7, 102.0, 101.7, 100.7, 66.4, 42.7, 26.0 3a⁃07*8.32(s, 1H), 7.86(d, J=8.7 Hz, 1H), 7.68—7.52(m, 1H), 7.22(dd, J=17.0, 5.9 Hz, 1H), 6.76—6.70(m, 1H), 6.54(s, 1H), 6.24—6.26(m, 2H), 6.18(s, 1H), 6.14—6.16(m, 2H), 2.83(s, 3H), 2.13(s, 3H)192.6, 148.7, 148.0, 147.8, 146.2, 137.8, 131.2, 126.4, 125.6, 125.5, 124.8, 124.4, 122.8, 121.3, 120.4, 117.5, 110.2, 109.9, 108.9, 104.8, 102.7, 101.9, 100.2, 68.9, 42.0, 27.3 3a⁃089.79(s, 1H), 7.89(d, J=8.7 Hz, 1H), 7.67(d, J=8.3 Hz, 1H), 7.60—7.49(m, 1H), 7.31(s, 1H), 7.26(s, 1H), 7.20(d, J=8.2 Hz, 1H), 7.15(s, 1H), 6.98(dd, J=3.8, 1.6 Hz, 1H), 6.21—6.05(m, 5H), 5.82(s, 1H), 2.83(s, 3H)179.6, 148.5, 148.0, 147.9, 145.7, 137.7, 131.2, 131.2, 128.4, 126.5, 126.4, 124.6, 123.7, 122.9, 120.3, 117.3, 111.0, 109.5, 108.7, 104.7, 102.7, 101.8, 99.9, 66.7, 42.4 3a⁃09*9.44(s, 1H), 7.85(d, J=8.4 Hz, 1H), 7.64(d, J=7.8 Hz, 2H), 7.56(d, J=8.4 Hz, 1H), 7.30(t, J=10.9 Hz, 2H), 7.21(d, J=8.1 Hz, 1H), 6.94(s, 1H), 6.58(s, 1H), 6.27(d, J=17.9 Hz, 2H), 6.20—6.14(m, 3H), 2.84(s, 3H)185.7, 148.7, 148.1, 147.9, 146.2, 137.6, 131.2, 128.6, 126.3, 126.1, 125.6, 124.8, 122.7, 122.7, 120.4, 117.5, 110.3, 109.7, 107.3, 104.8, 102.8, 101.9, 100.2, 69.0, 42.0 3a⁃107.86(d, J=8.6 Hz, 1H), 7.70—7.60(m, 2H), 7.57(d, J=8.9 Hz, 2H), 7.31(s, 1H), 7.23(d, J=8.2 Hz, 1H), 6.83(s, 1H), 6.65(s, 1H), 6.51(s, 1H), 6.28(s, 1H), 6.18(d, J=15.9 Hz, 3H), 2.86(s, 3H)148.8, 148.1, 148.0, 146.3, 137.2, 136.1, 131.3, 126.2, 125.5, 125.0, 122.6, 121.2, 120.8, 120.4, 117.6, 110.5, 108.9, 105.2, 104.9, 102.9, 101.9, 100.2, 69.5, 42.0 3b⁃017.84(d, J=8.5 Hz, 1H), 7.64—7.52(m, 3H), 7.38(s, 1H), 7.30(s, 1H), 7.18(d, J=8.1 Hz, 1H), 6.94(s, 1H), 6.67(s, 1H), 6.59(s, 1H), 6.18(dd, J=31.9, 15.5 Hz, 4H), 2.82(s, 3H)148.8, 148.0, 147.9, 145.9, 137.7, 135.8, 131.2, 128.5, 126.4, 125.5, 124.8, 122.8, 120.4, 118.2, 117.5, 110.2, 110.1, 104.8, 102.7, 101.9, 100.2, 67.2, 41.8 3b⁃027.84(d, J=8.7 Hz, 1H), 7.60(d, J=8.3 Hz, 1H), 7.56(d, J=8.0 Hz, 2H), 7.31(d, J=4.8 Hz, 1H), 7.27(d, J=7.5 Hz, 1H), 7.17(d, J=8.2 Hz, 1H), 6.60(s, 1H), 6.50(s, 1H), 6.23(s, 1H), 6.15(dd, J=13.0, 7.8 Hz, 3H), 2.80(s, 3H), 1.87(s, 3H)148.7, 148.0, 147.9, 145.9, 137.9, 136.8, 135.1, 131.2, 126.4, 125.5, 124.8, 122.8, 120.4, 117.4, 114.4, 110.3, 110.0, 104.8, 102.7, 101.9, 100.2, 67.1, 41.9, 14.0 3c⁃017.85(d, J=8.7 Hz, 1H), 7.59—7.54(m, 2H), 7.50(s, 1H), 7.30(s, 1H), 7.23(d, J=2.3 Hz, 1H), 7.14(d, J=8.2 Hz, 1H), 6.49(s, 1H), 6.21(s, 1H), 6.13(dd, J=14.4, 8.2 Hz, 3H), 5.79(d, J=2.2 Hz, 1H), 2.82(s, 3H), 1.99(s, 3H)148.5, 147.9, 147.7, 147.3, 146.1, 138.1, 131.1, 128.8, 126.3, 125.8, 124.5, 123.0, 120.4, 117.1, 111.0, 109.7, 105.5, 104.8, 102.4, 101.8, 100.3, 70.9, 42.3, 13.9 3c⁃027.84(d, J=8.7 Hz, 1H), 7.56(dd, J=17.3, 8.4 Hz, 2H), 7.49(s, 1H), 7.29(s, 1H), 7.23(s, 1H), 7.13(d, J=8.2 Hz, 1H), 7.03(s, 1H), 6.50(s, 1H), 6.19(s, 1H), 6.16—6.06(m, 3H), 2.82(s, 3H), 1.79(s, 3H)148.5, 147.9, 147.6, 146.1, 139.5, 138.1, 131.1, 126.7, 126.3, 125.9, 124.5, 123.0, 120.4, 117.0, 115.3, 111.0, 109.6, 104.8, 102.4, 101.8, 100.3, 71.0, 42.4, 9.0 3c⁃03*7.85(d, J=8.7 Hz, 1H), 7.57(dd, J=20.6, 8.4 Hz, 2H), 7.53(s, 1H), 7.40(d, J=2.4 Hz, 1H), 7.30(s, 1H), 7.16(d, J=8.2 Hz, 1H), 6.63(s, 1H), 6.26(d, J=2.4 Hz, 1H), 6.23(s, 1H), 6.17—6.11(m, 3H), 2.84(s, 3H)148.7, 148.0, 147.7, 146.3, 137.6, 131.2, 131.0, 126.2, 125.7, 124.7, 122.9, 120.4, 117.2, 114.8, 110.2, 110.0, 104.8, 102.5, 101.9, 100.2, 95.9, 71.4, 42.2 Compd.1H NMR(DMSO⁃d6, 500 MHz), δ13C NMR(DMSO⁃d6, 126 MHz), δ

3c⁃04*7.75(d, J=8.6 Hz, 1H), 7.62(s, 1H), 7.50(dd, J=16.7, 8.4 Hz, 2H), 7.44(s, 1H), 7.16(s, 1H), 7.12(s, 1H), 7.05(d, J=8.2 Hz, 1H), 6.59(s, 1H), 6.16(d, J=1.4 Hz, 1H), 6.08(dd, J=6.4, 2.5 Hz, 3H), 2.96(s, 3H)148.5, 147.9, 147.6, 146.0, 144.6, 137.5, 132.1, 131.3, 126.5, 125.7, 124.6, 122.5, 119.8, 116.7, 110.0, 109.8, 104.6, 102.2, 101.2, 100.6, 72.2, 56.4, 42.5 3c⁃05*7.85(d, J=8.5 Hz, 1H), 7.57(dd, J=22.1, 11.4 Hz, 4H), 7.31(s, 1H), 7.17(d, J=8.1 Hz, 1H), 6.62(s, 1H), 6.24(s, 1H), 6.20(s, 1H), 6.17—6.12(m, 3H), 2.85(s, 3H)148.7, 148.0, 147.7, 146.3, 137.5, 131.2, 131.2, 126.2, 125.7, 124.7, 124.7, 122.9, 120.4, 117.2, 110.0, 110.0, 108.7, 104.8, 102.5, 101.9, 100.2, 71.6, 42.2 3c⁃06*7.90(s, 1H), 7.83(d, J=8.6 Hz, 1H), 7.60—7.52(m, 3H), 7.31(d, J=14.2 Hz, 2H), 7.14(d, J=8.1 Hz, 1H), 6.62(s, 1H), 6.21(s, 1H), 6.14(dd, J=17.0, 5.5 Hz, 3H), 2.85(s, 3H)148.7, 148.0, 147.6, 146.4, 139.4, 137.5, 131.1, 128.8, 126.2, 125.8, 124.6, 122.9, 120.4, 117.0, 110.1, 109.9, 104.8, 102.5, 101.8, 100.3, 92.7, 71.7, 42.3 3c⁃07*7.84(d, J=8.7 Hz, 1H), 7.64(d, J=2.5 Hz, 1H), 7.57(dd, J=18.9, 8.0 Hz, 3H), 7.30(s, 1H), 7.16(d, J=8.2 Hz, 1H), 6.60(s, 1H), 6.24(s, 1H), 6.17—6.11(m, 4H), 2.85(s, 3H)148.7, 148.0, 147.7, 146.3, 137.6, 137.5, 131.2, 131.2, 126.2, 125.7, 124.7, 122.9, 120.4, 117.1, 110.0, 110.0, 105.4, 104.8, 102.5, 101.9, 100.2, 71.6, 42.2 3c⁃08*7.86—7.79(m, 2H), 7.60(s, 1H), 7.55(dd, J=13.4, 8.4 Hz, 2H), 7.29(s, 1H), 7.24(d, J=4.4 Hz, 1H), 7.14(d, J=8.2 Hz, 1H), 6.54(s, 1H), 6.21(s, 1H), 6.16—6.11(m, 3H), 2.83(s, 3H)148.7, 147.9, 147.6, 146.5, 137.5, 131.1, 126.3, 126.1, 126.0, 125.9, 124.6, 123.0, 120.4, 117.0, 115.1, 114.9, 110.2, 109.8, 104.8, 102.4, 101.8, 100.3, 71.9, 42.2 3c⁃09*7.85(d, J=8.8 Hz, 1H), 7.75(s, 1H), 7.60(d, J=8.3 Hz, 1H), 7.56(t, J=4.2 Hz, 2H), 7.30(s, 1H), 7.18(d, J=8.2 Hz, 1H), 6.76(s, 1H), 6.52(d, J=2.4 Hz, 1H), 6.23(s, 1H), 6.16—6.13(m, 3H), 2.88(s, 3H)148.7, 148.0, 147.8, 146.4, 140.8, 140.5, 137.3, 131.2, 130.8, 126.1, 125.7, 124.8, 122.9, 120.8, 120.4, 117.3, 110.2, 109.8, 104.8, 102.6, 101.9, 100.1, 72.0, 42.3 3c⁃10*8.03(d, J=2.3 Hz, 1H), 7.85(d, J=8.7 Hz, 1H), 7.61(d, J=10.8 Hz, 2H), 7.58—7.52(m, 1H), 7.31(d, J=4.7 Hz, 1H), 7.20(d, J=8.2 Hz, 1H), 6.89(s, 1H), 6.85(s, 1H), 6.25(s, 1H), 6.15(d, J=9.5 Hz, 3H), 2.91(s, 3H)155.2, 148.8, 148.0, 147.8, 146.6, 136.9, 132.4, 131.2, 126.0, 125.7, 125.0, 122.9, 120.4, 117.3, 110.4, 109.1, 104.9, 103.5, 102.7, 101.9, 100.2, 72.7, 42.3 3d⁃018.02(d, J=8.2 Hz, 1H), 7.90(d, J=8.8 Hz, 1H), 7.69(d, J=8.3 Hz, 1H), 7.53(d, J=8.6 Hz, 1H), 7.41(d, J=7.8 Hz, 1H), 7.32—7.17(m, 4H), 7.05(t, J=7.9 Hz, 1H), 6.81(s, 1H), 6.28(d, J=3.3 Hz, 1H), 6.13(s, 2H), 6.08—6.02(m, 2H), 5.99(s, 1H), 2.93(s, 3H)147.0, 146.4, 146.2, 144.0, 139.7, 135.9, 129.8, 126.1, 125.8, 125.3, 123.1, 122.8, 122.5, 120.5, 119.4, 119.0, 117.9, 116.0, 114.6, 114.1, 110.8, 106.9, 103.4, 100.8, 100.5, 99.4, 53.3, 41.7 3e⁃0111.12(s, 1H), 8.34—8.27(m, 1H), 8.11(dd, J=4.7, 1.6 Hz, 1H), 7.76(d, J=8.7 Hz, 1H), 7.54(s, 1H), 7.50(d, J=8.3 Hz, 1H), 7.44 (d, J=8.6 Hz, 1H), 7.19(s, 1H), 7.03—7.07(m, 2H), 6.39(dd, J=2.5, 1.0 Hz, 1H), 6.16 —6.05(m, 4H), 5.72(d, J=0.9 Hz, 1H), 2.79(s, 3H)149.2, 148.3, 147.6, 147.4, 145.2, 143.0, 140.6, 130.9, 128.3, 127.0, 126.3, 124.1, 123.7, 120.5, 119.1, 117.2, 115.6, 115.1, 114.2, 108.2, 104.6, 102.0, 101.6, 100.2, 54.3, 42.7
*1H NMR, DMSO-d6, 600 MHz;13C NMR, DMSO-d6, 151 MHz.
1.3 抑菌活性测定
1.3.1测试材料测试对象为化合物3a-1~3a-10; 3b-01, 3b-02; 3c-01~3c-10; 3d-01和3e-01. 选用多菌灵和吡唑醚菌酯作为对照药剂, 同时以先导化合物血根碱盐酸盐作为对比药剂. 供试菌种为番茄晚疫病菌[()]、 小麦赤霉病菌()、 茶叶轮斑 病菌[(]、 瓜果腐霉病菌()、 玉米大斑病菌[()]、 茶叶炭疽病菌()、 稻瘟病菌()、 苹果轮纹病菌()、 辣椒疫霉病菌()和棉花立枯病菌(), 均由中国农业科学院植物保护所提供. 实验用培养基均为马铃薯琼脂培养基(PDA).
1.3.2测试方法参照文献[17,18]方法, 将目标化合物用二甲基亚砜(DMSO)溶解, 配制成浓度为 1×104μg/mL的母液; 将供试药剂加入到已灭菌并冷却到约50 ℃的PDA培养基中混合均匀, 倒入培养皿中, 配制成含药浓度为50 μg/mL的平板. 实验设不含药剂处理的空白对照, 分别重复处理3次.
采用生长速率法测定抑菌活性. 在含药培养基平板中央分别接一块供试病菌的新鲜菌丝块菌碟, 在恒温光照培养箱中, 于28 ℃培养至空白对照菌落布满培养皿2/3以上时, 用十字交叉法测量处理的菌落直径, 重复3次, 以其平均值代表菌落的大小.
药剂处理对各种病原菌的菌丝生长抑制率(MIR, %)公式如下:
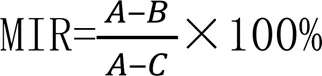
式中:(mm)表示空白对照菌落直径;(mm)表示药剂处理的菌落直径;(mm)表示接种时新鲜菌碟直径.
采用生长速率法测定精密毒力. 供试药剂为所有目标化合物和血根碱盐酸盐. 供试菌种为茶叶轮斑病菌[()]、 玉米大斑病菌[(.)]、 茶叶炭疽病菌()和棉花立枯病菌[()]. 每种供试药剂浓度梯度设定为1.562, 3.125, 6.25, 12.5, 25和50 μg/mL; 对照药剂多菌灵、 吡唑醚菌酯的浓度梯度设定为20, 10, 5, 2.5, 1.25和0.625 μg/mL, 每个梯度平行测定3次. 实验结果用SPSS软件进行统计分析, 计算半最大效应浓度(EC50)值、 误差与置信区间.
1.4 杀虫活性测定
实验用害虫为桃蚜(), 采自本地田间的种群; 对照药剂为吡虫啉. 先将供试药剂用,-二甲基甲酰胺(DMF)配制成母液(质量分数5%), 再用曲拉通(Triton X-100)水溶液(质量分数0.05%)稀释至测定浓度. 测定浓度为400 μg/mL, 每个处理重复3次. 杀虫活性测定方法采用浸虫浸叶法[18].
2 结果与讨论
2.1 目标化合物的合成
反应溶剂为预先经过无水无氧处理的四氢呋喃, 实验中用氢化铝锂处理四氢呋喃. 在反应过程中, 钠盐中富含电子的氮原子进攻血根碱亚胺键(C=N+)中缺乏电子的C6原子, 通过亲核加成得到目标化合物3[10]. 目标化合物的产率在21%~64%之间, 但在后处理过程中并未发现明显的副产物, 只检 测到一部分未反应的原料(血根碱). 延长反应时间或提升反应温度并不能提高产率. 在同等条件下, 1-1,2,4-三唑未与血根碱发生反应. 而且, 当反应底物为体积较大的杂环时, 反应产率显著降低(化合物3d-01和3e-01). 吡咯、 咪唑和吡唑等基团作为亲核试剂参与反应时, 亲核性较弱和空间位阻作用应是导致反应产率较低的主要原因. 由于本实验以得到产物为目标, 且没有明显副产物产生, 故未对反应条件做进一步优化.
2.2 目标化合物的抑菌活性
采用菌丝生长速率法测定了目标化合物在50 μg/mL浓度下对10种植物病原菌的室内抑菌活性. 由表3可见, 整体上多数目标化合物对茶叶轮斑病菌(PS)、 玉米大斑病菌(ET)、 茶叶炭疽病菌(CC)及棉花立枯病菌(TC)表现出优秀的抑菌活性. 部分化合物对这4种病原菌的抑制率均在85%以上, 接近或高于对照药剂多菌灵. 另一方面, 目标化合物对苹果轮纹病菌(PP)和辣椒疫霉病菌(PC)表现出较差的抑菌活性. 目标化合物3a-06, 3a-07, 3b-01, 3c-07和3c-08对10种供试病原菌表现出较广谱的抑菌活性; 且以上目标化合物对多数供试病原菌的抑菌活性明显高于对比药剂血根碱盐酸盐, 接近或高于对照药剂多菌灵或吡唑醚菌酯. 对比目标化合物3a-01, 3b-01, 3c-01, 3d-01和3e-01对10种供试病原菌的抑菌活性可知, 引入不同的氮杂环结构对化合物抑菌活性有明显影响, 引入体积较小的氮杂环结构有利于化合物抑菌活性的提高, 如咪唑和吡唑基团.

Table 3 Mycelium growth inhibitory rate(%) of in vitro fungicidal activity against the phytopathogens at 50 μg/mL*
SS=(); FG=; PS=(); PA=; ET=(); CC=; PO=; PP=; PC=; TC()
2.3 精密毒力测定
根据初步抑菌活性测试结果, 测试了目标化合物对茶叶轮斑病菌(PS)、 玉米大斑病菌(ET)、 茶叶炭疽病菌(CC)和棉花立枯病菌(TC)的精密毒力. 由表4~表7数据可知, 化合物3a-07和3c-08对茶叶轮斑病菌(PS)表现出较好的抑菌活性, EC50值分别为9.76和8.83 μg/mL(表4); 化合物3a-06, 3b-01和 3c-08对茶叶炭疽病菌(CC)的抑菌活性较好, EC50值分别为8.83, 8.52和9.17 μg/mL(表6); 化合物3a-08和3b-01对棉花立枯病菌表现出优良的抑菌活性, EC50值分别为7.89和9.77 μg/mL(表7). 通过比较以上几个目标化合物的结构发现, 除化合物3b-01外, 其余目标化合物在C6位取代杂环上均有吸电子取代基. 通过比较目标化合物3a-01~3a-10的抑菌活性(表3~表7)可知, 化合物3a-01, 3a-02和 3a-03对10种供试病原菌均表现出较差的抑菌活性; 当血根碱C6位为吡咯环取代且环上有吸电子取代基时, 目标化合物(3a-05~3a-10)表现出较好的抑菌活性. 但这一规律在血根碱C6位为吡唑环取代时(化合物3c)表现得并不明显. 通过整体对比血根碱盐酸盐(1)和目标化合物的抑菌活性(表3~表7)可知, 多数目标化合物表现出较优的抑菌活性.
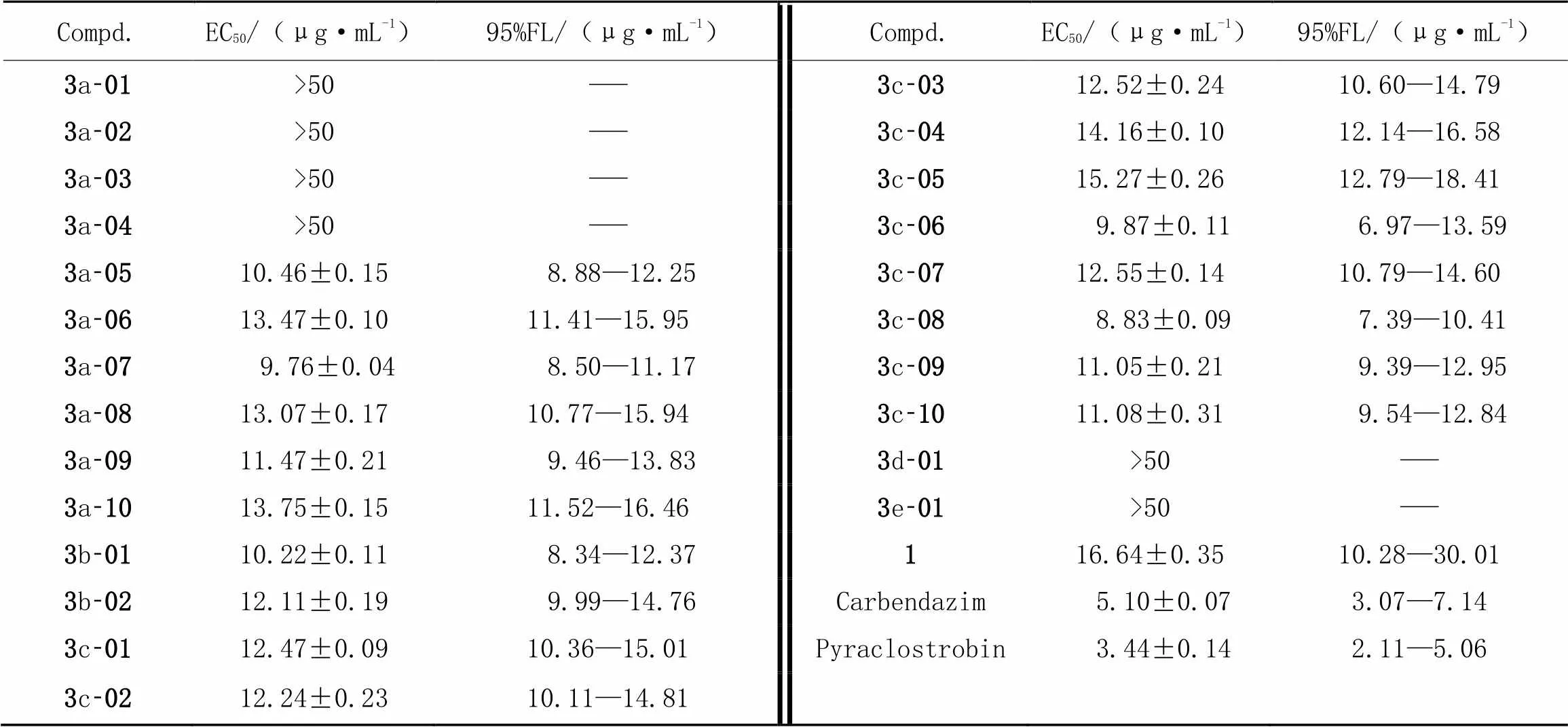
Table 4 In vitro fungicidal activity against Pestalotiopsis theae(Sawada) Steyaert

Table 5 In vitro fungicidal activity against Exserohilum turcicum(Pass.) Leonay et Suggs
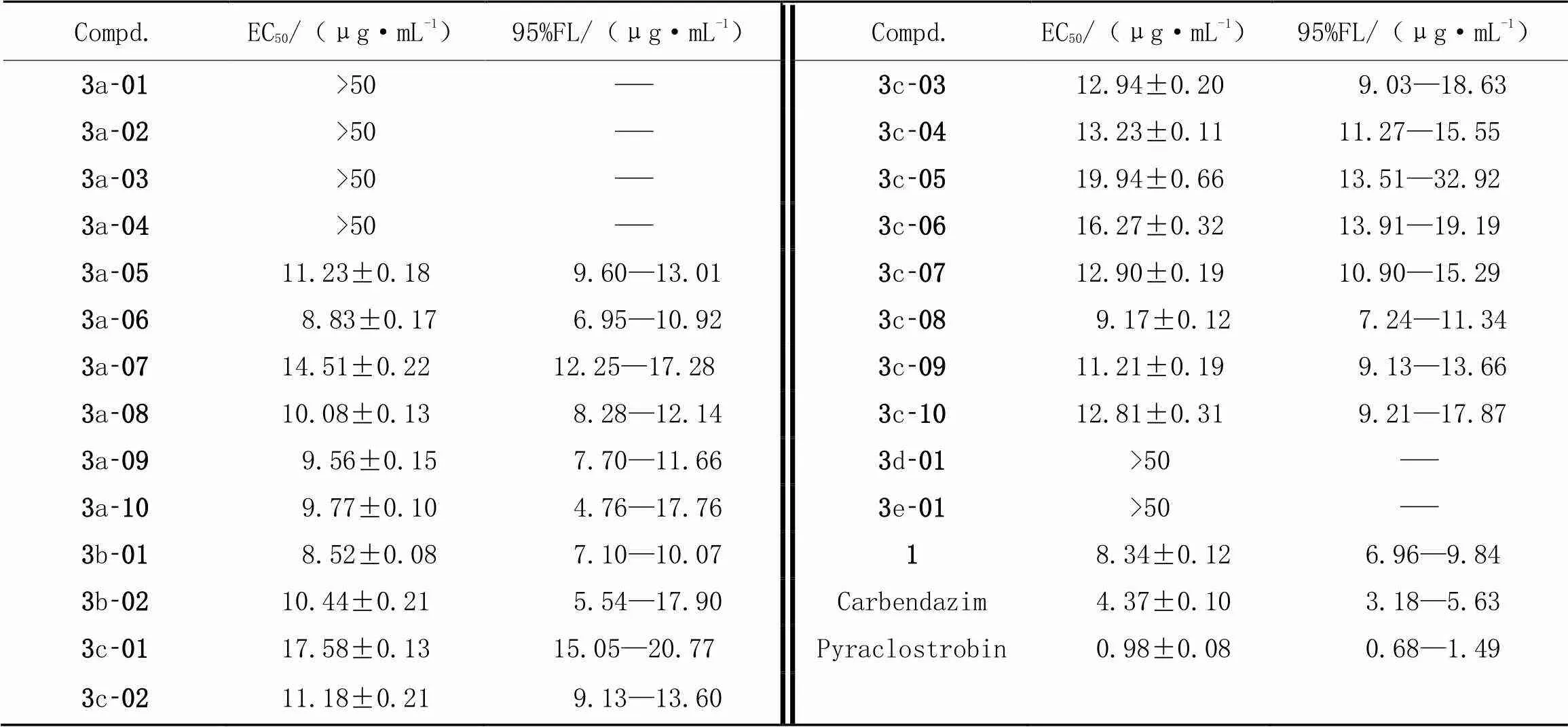
Table 6 In vitro fungicidal activity against Colletotrichum camalliae Massee
目前, 对血根碱药理活性的研究表明, 分子中亚胺键(C=N+)是其重要的功能基团[19,20]. 仅有少量文献和专利研究血根碱衍生物的生物活性和构效关系[13,14,20,21]. 另一方面, 对血根碱分子稳定性的研究结果表明, 分子中的亚胺键(C=N+)是其不稳定因素之一[22,23], 易受外界环境影响, 是限制血根碱推广应用的主要因素之一. 本文通过结构衍生, 变季铵盐为共价键, 得到的6-杂环取代血根碱衍生物减少了血根碱分子不稳定因素的同时仍表现出良好的抑菌活性. 对其构效关系的研究为血根碱衍生物的开发利用提供了一定依据.
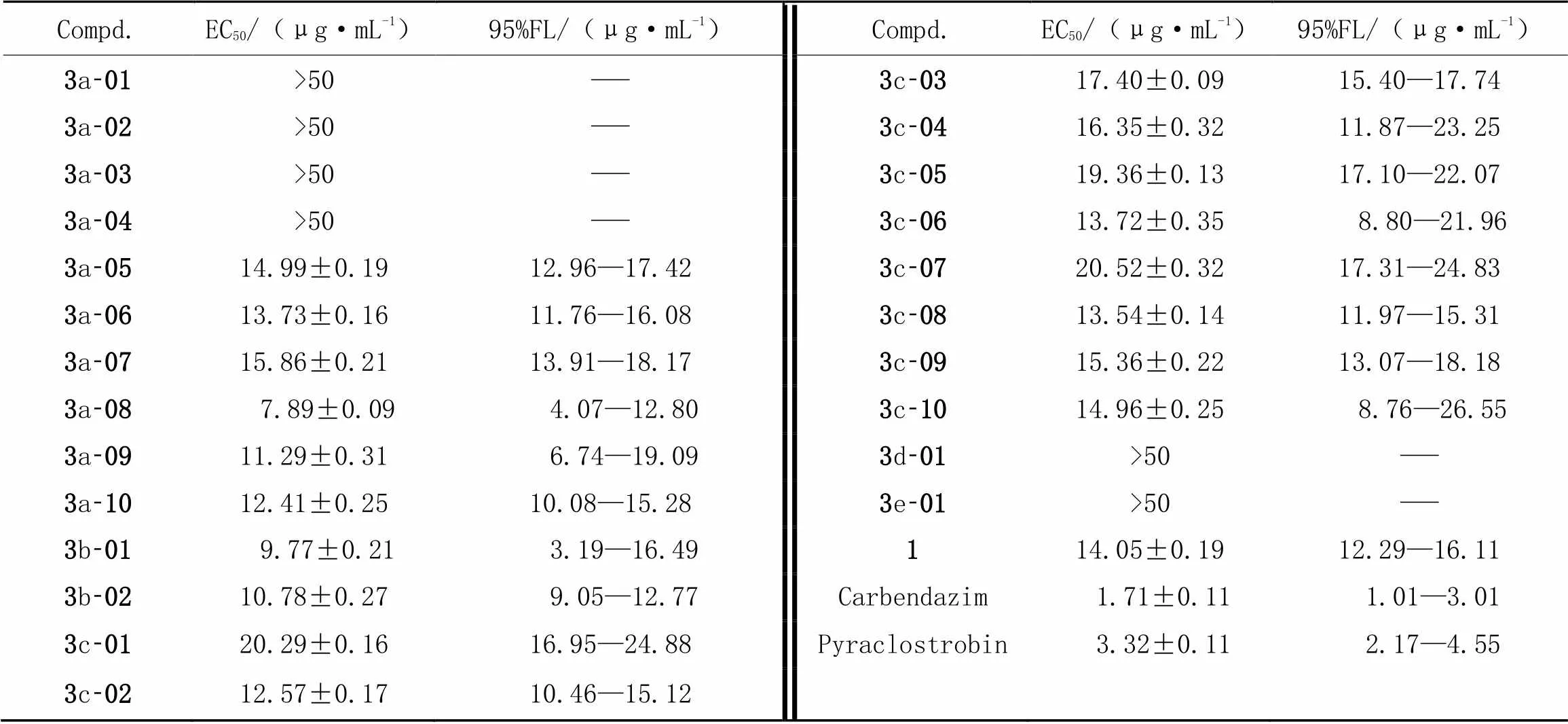
Table 7 In vitro fungicidal activity against Thanatepephorus cucumeris(Frank) Donk
2.4 杀虫活性
以桃蚜()为实验材料, 采用浸虫浸叶法测定了目标化合物在400 μg/mL浓度下对桃蚜的校正致死率. 表8结果表明, 在此浓度下, 目标化合物对桃蚜的杀虫活性较差, 致死率多低于75%. 仅化合物3b-01, 3c-07和3c-08表现出一定的杀虫活性, 致死率分别为74.4%, 74.2%和75.0%, 与先导化合物血根碱盐酸盐(1)对桃蚜致死率(74.9%)相当. 故未对目标化合物进行进一步精密毒力测定.
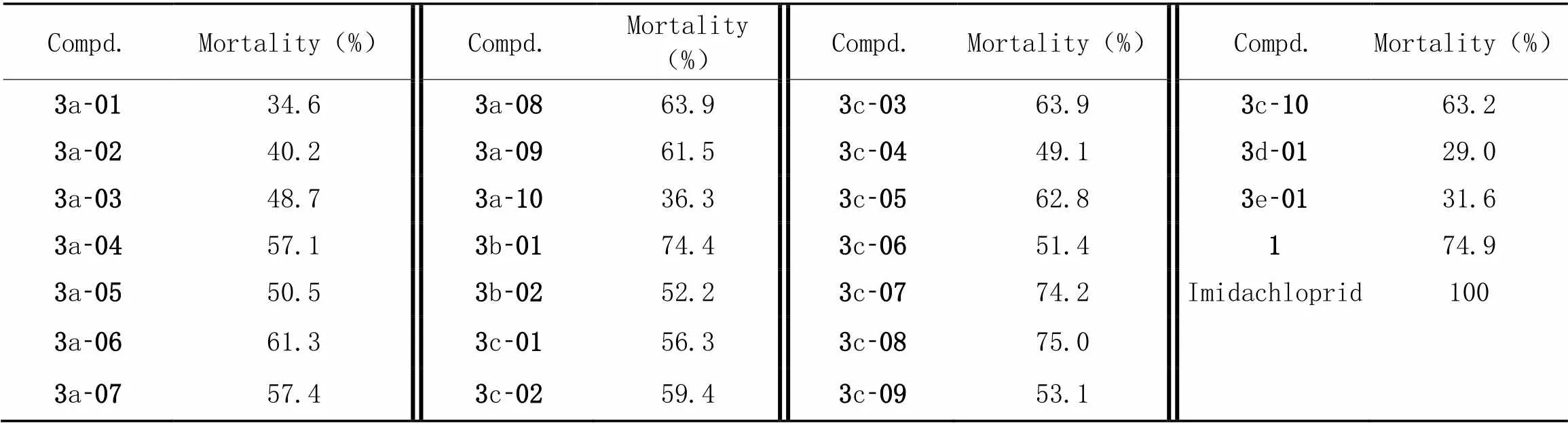
Table 8 Corrected mortality of title compounds to Myzus perscicaeSulzer at 400 μg/mL
3 结 论
利用活性基团拼接方法合成了一类未见报道的6-杂环取代血根碱衍生物, 并对其生物活性和构效关系进行了初步研究. 结果表明, 部分目标化合物对供试病原菌表现出良好的抑菌活性. 化合物 3c-08对茶叶轮斑病菌和茶叶炭疽病菌的EC50值分别为8.83和9.17 μg/mL, 稍逊于多菌灵, 但其为天然产物衍生而来, 在茶叶病虫害防治方面仍具有进一步研究开发的价值. 该类化合物的对桃蚜杀虫活性一般, 在400 μg/mL浓度下仅个别目标化合物表现出一定的杀虫活性. 构效关系分析结果表明, 当在血根碱分子中C6位引入含吸电子取代基且体积较小的杂环时, 目标化合物表现出较高的抑菌活性, 为下一步结构衍生工作指明了方向. 此外, 合成底物范围和目标化合物产率问题还需进一步研究优化.
[1] Sun M. S., Zhong X. H., Zhou L., Xu Z. X., Huang P., Zeng J. G.,,2022,(6), 110
[2] Hu N. X., Chen M., Liu Y. S., Shi Q., Yang B., Zhang H. C., Cheng P., Tang Q., Liu Z. Y., Zeng J. G.,, 2019,(2), 197—206
[3] Zhong M.,, Central South University, Changsha, 2011(钟明. 博落回主要生物碱的分离、 纯化及生物活性研究, 长沙: 中南大学, 2011)
[4] Faehnrich B., Pastor A., Heide C., Kroger S., Zentek J.,, 2019,(2), 661—667
[5] Miao F., Yang X. J., Ma Y. N., Zheng F., Song X. P., Zhou L.,, 2012,(12), 1508—1513
[6] Yang J., Chen M., Li M. H., Qin J. R., Wang Z. Q.,,2019,(12), 1057—1061(杨佳, 陈旻, 李明花, 钦敬茹, 王中奇. 肿瘤防治研究, 2019,(12), 1057—1061)
[7] Khan A. Q., Mohamed E. A. N., Hakeem I., Nazeer A., Kuttikrishnan S., Prabhu K. S., Siveen K. S., Nawaz Z., Ahmad A., Zayed H., Uddin S.,,2020,(5), 1229
[8] Hwang J. Y., Choi Y. H.,2015,(9), 984—992
[9] Lee T. K., Park C., Jeong S. J., Jeong M. J., Kim G. Y., Kim W. J., Choi Y. H.,, 2016,(5), 227—240
[10] Kadam S. S., Maier L., Solomek T., Necas M., Smejkal K., Dostal J., Sklenar V., Marek R.,, 2013,(10), 814—821
[11] Liu Z. Y., Huang Y. J., Xie H. Q., Liu W., Zeng J. G., Cheng P.,, 2016,(56), 50500—50505
[12] Qing Z. X., Cao H. L., Cheng P., Wang W., Zeng J. G., Xie H. Q.,, 2018,(3), 353—357
[13] Yang X. J., Miao F., Yao Y., Cao F. J., Yang R., Ma Y. N., Qin B. F., Zhou L.,, 2012,(11), 13026—13035
[14] Miao F., Yang X. J., Zhou L., Hu H. J., Zheng F., Ding X. D., Sun D. M., Zhou C. D., Sun W.,, 2011,(9), 863—875
[15] Vitaku E., Smith D. T., Njardarson J. T.,,2014,(24), 10257—10274
[16] Jia C. Q., Ma R., Qian X. C., Wang D. D., Yu J. S.,, 2022,(1), 39—46(贾长青, 马瑞, 钱玺丞, 王丹丹, 郁建生. 食品工业科技, 2022,(1), 39—46)
[17] Jia C. Q., Yuan X. Y., Liu X. L., Zhang L., Xiao Y. M., Fu B., Li J. Q., Qin Z. H.,,2019,(12), 3160—3166
[18] Jia C. Q., Yang D. Y., Che C. L., Ma Y. Q., Rui C. H., Yan X. J., Qin Z. H.,, 2016,(5), 892—901(贾长青, 杨冬燕, 车传亮, 马永强, 芮昌辉, 闫晓静, 覃兆海. 高等学校化学学报, 2016,(5), 892—901)
[19] Liu W., Cheng P., Qing Z. X., Wang B., Kang W. S., Zhou J., Zeng J. G.,,2014,(6), 524—528(刘薇, 程辟, 卿志星, 王斌, 康伟松, 周捷, 曾建国. 中南药学, 2014,(6), 524—528)
[20] Zhang M.,Nankai University, Tianjin, 2009(张敏. 苯并[]菲啶和橙酮类化合物的设计、 合成与生物活性研究, 天津: 南开大学, 2009)
[21] Zhou L., Miao F., Yang X. J., S, CN 102775417A, 2012⁃11⁃14(周乐, 苗芳, 杨新娟. 血根碱醇化物及其制备方法和在植物杀菌剂药物中的应用, CN 102775417A, 2012⁃11⁃14)
[22] Li C. M., Chen X., Li W. L., Liu B. M., Wang L., Ji Y. B.,,2019,(6), 20—23
[23] Samatadze T. E., Zelenin A. V., Suslina S. N.,Amosova A. V.,Popov K. V., Zagumennikova T. N., Tsitsilin A. N., Bykov V. A., Muravenko O. V.,, 2012,(1), 72—79
Synthesis, Characterization, Biological Activity and Structure-activity Relationship of 6--heterocyclic Substituted Sanguinarine Derivatives
JIAChangqing1,3*, MARui1, QIANXicheng1, QINZhaohai2, XUHouqiang3
(,,554300,;,,100193,;,,550000,)
A novel series of 6-⁃heterocycle substituted sanguinarine derivatives was designed and synthesized by active group splicing with sanguinarine as lead. The structures of title compounds were confirmed by1H NMR,13C NMR, IR and HRMS. By using the mycelium growth rate method, title compounds were evaluated for antifungal activitiesand structure-activity relationships(SAR) were investigated. The preliminary antifungal activity test results indicate that compounds 3a⁃06, 3a⁃07, 3b⁃01, 3c⁃07 and 3c⁃08 exhibited a relatively broad spectrum of fungicidal activity against ten tested pathogens at a concentration of 50 μg/mL, the inhibition rate against most of the tested pathogens is above 72%. In further precision virulence assay, some title compounds showed good antifungal activity. The median effective concentrations (EC50) of compound 3b⁃01 againstandwere 8.52 and 9.77 μg/mL, respectively. The EC50of compound 3c⁃08 againstandwere 9.17 and 8.83 μg/mL, respectively. Compound 3c⁃08 has the potential for application in the prevention and control of tea diseases. Compared with the lead compound sanguinarine hydrochloride, most of the title compounds showed better antifungal activity. The preliminary results of insecticidal activity showed that the insecticidal activity of these compounds againstwas normal at a concentration of 400 μg/mL. In conclusion, these results laid a foundation for further development and utilization of sanguinarine derivatives.
Macleaya cordata; Sanguinarine derivatives;-heterocyclic; Biological activity; Structure-activity relationships(SAR)
2023-05-08
贾长青, 男, 博士, 教授, 主要从事新农药创制、 有机合成以及天然产物化学方面的研究. E-mail: jiachangq@126.com
贵州省科技计划项目(批准号: 黔科合基础[2018]1422)和贵州省高校创新团队(批准号: 黔教技[2023]097)资助.
O626
A
10.7503/cjcu20230231
2023-07-29.
Supported by the Guizhou Provincial Science and Technology Plan Project of China(No.Qiankehe Foundation [2018]1422) and the Guizhou Higher Education Institutions Innovation Team, China(No.Qianjiaoji[2023]097).
(Ed.: L, W, K)