含双酰胺结构的1,2,4-噁二唑类衍生物的设计、合成及抗菌活性
王锋, 陈钰, 裴鸿艳, 刘东东, 罗春凤, 张静,, 张立新,
含双酰胺结构的1,2,4-噁二唑类衍生物的设计、合成及抗菌活性
王锋1,2, 陈钰1, 裴鸿艳1, 刘东东1,2, 罗春凤3, 张静1,2,3, 张立新1,2,3
(1. 沈阳化工大学功能分子研究所, 沈阳 110142; 2. 辽宁科技大学化学工程学院, 鞍山 114051; 3. 广西思钺生物科技有限责任公司, 南宁 530000)
为了寻找新型抗菌先导化合物, 采用活性亚结构拼接的方法引入新的活性片段及取代基, 设计合成了27个新型含双酰胺结构的1,2,4-噁二唑类衍生物4a~4c和6a~6x, 经核磁共振氢谱(1H NMR)和高分辨质谱(HRMS)确证其化学结构. 抗菌活性测试结果表明, 当浓度为3.13 mg/L时, 化合物6f, 6i, 6m, 6n和6q对大豆锈病()的防效分别为80%, 90%, 80%, 90%和70%, 优于杀菌剂Flufenoxadiazam(30%)和对照药剂苯醚甲环唑(50%); 化合物6i和6n的抗菌活性优异, 当浓度为1.56 mg/L时, 对大豆锈病仍有50%和70%的抗菌活性. 化合物6n在浓度为1.56mg/L时, 对玉米锈病()具有100%防效的优异抗菌活性. 分子对接模拟结果表明, 化合物6n与组蛋白去乙酰化酶4(HDAC 4)具有多种相互作用, 与PRO-298, LEU-299及 HIS-158号残基形成的氢键作用可能是其抗菌活性优异的重要原因.
双酰胺结构; 1,2,4-噁二唑; 合成; 抗菌活性; 分子对接
植物真菌对农业生产具有巨大危害[1~3], 由豆薯层锈菌()引起的大豆锈病是危害大豆生产的主要真菌病害[4], 也是大豆植物最大的威胁之一[5]. 在对真菌病害的防治方法中, 杀菌剂的施用一直是重要的手段, 具有效率高、 成本低且施用方便等优势. 然而,现有农用杀菌剂长期、 大量且不规范的施用导致大豆锈病对现有杀菌剂的抗性及交叉抗性问题日趋严重[6,7], 因此寻找绿色、 高效且作用机制新颖的杀菌剂已成为当前农药工作者的一个研究热点.
含2个氮原子和1个氧原子的噁二唑杂环是重要的含氮五元杂环化合物. 非对称性的1,2,4-噁二唑杂环含有N—O键的不饱和结构, 共轭体系独特, 其衍生物在抗糖尿病[8]和抗肿瘤[9,10]等医药方面, 以及除草[11,12]、 杀虫[13,14]、 抗细菌[15]和抗真菌[16]等农药方面均表现出广泛而良好的生物活性. 在药物分子结构的设计合成中, 三氟甲基具有强电负性、 小尺寸和C—F键低极化率等特性, 将其引入分子结构能赋予药物多种特性[17]. 巴斯夫、 先正达、 住友和拜耳等公司先后报道了多个关于5-(三氟甲基)- 1,2,4-噁二唑类化合物的专利, 其在抗菌、 除草及杀虫方面均表现出良好的活性[18~21]. 1,2,4-噁二唑类化合物对组蛋白去乙酰化酶(HDACs)表现出良好的抑制作用[22~24], 这种以HDACs(真菌HDACs主要为 Ⅱ类HDAC4, HDAC7等)为靶标的杀菌作用机制与现有市场上主流药剂的杀菌机制不同, 不存在抗性及交叉抗性方面的问题, 是研发新型杀菌剂的理想选择.
双酰胺结构在医药和农药领域具有重要作用[25], 在抗细菌[26]、 抗真菌[27]、 除草[28]及杀虫[27,29]等方面表现出良好的生物活性, 如日本三井化学农业公司开发的Tolprocard杀菌剂. 本课题组基于巴斯夫及先正达等对1,2,4-噁二唑类化合物的研究, 以-苯基-4-[5-(三氟甲基)-1,2,4-噁二唑-3-基[苯甲酰胺(浓度为6.25 mg/L时, 对大豆锈病的防效为98%)为先导化合物[18], 采用活性亚结构拼接及结构修饰的方法, 在分子的苯基与酰胺基之间引入乙基氨基羰基活性片段构成双酰胺结构, 得到的化合物6d对大豆锈病的抗菌活性良好(浓度为6.25 mg/L时, 对大豆锈病的防效为90%); 以其为次先导化合物,对双酰胺结构中柔性烷基链及R基部分进行修饰, 设计并合成了27个新型1,2,4-噁二唑类衍生物(Scheme 1). 测试了目标化合物对大豆锈病的抗菌活性, 对构效关系进行了初步分析, 并以高活性 化合物6n为代表, 测试了其对其它真菌病害的抗菌活性. 通过分子对接模拟, 探讨了5-(三氟甲基)- 1,2,4-噁二唑类化合物与组蛋白去乙酰化酶4(HDAC4)的结合方式及相互作用.
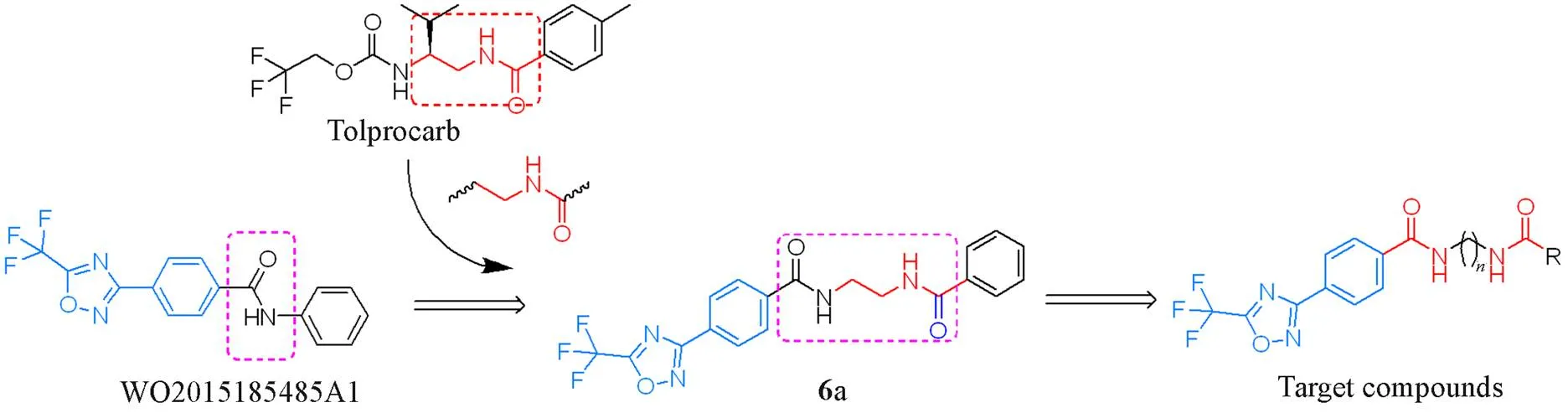
Scheme 1Design strategy for the target compounds
1 实验部分
1.1 试剂与仪器
对氰基苯甲酸, 分析纯, 上海迈瑞尔化学技术有限公司; 盐酸羟胺、 8-羟基喹啉、 邻甲基苯甲酰氯、 间甲基苯甲酰氯和对甲基苯甲酰氯, 分析纯, 上海阿拉丁生化科技有限公司; 甲苯、 无水乙醇、 无水碳酸钠和二氯甲烷, 分析纯, 天津市恒兴化学试剂制造有限公司; 乙酰氯、 丙酰氯、 环丙基甲酰氯、 苯甲酰氯、 苯乙酰氯、 邻氟苯甲酰氯、 间氟苯甲酰氯、 对氟苯甲酰氯、 邻氯苯甲酰氯、 间氯苯甲酰氯、 对氯苯甲酰氯、 邻溴苯甲酰氯、 邻三氟甲基苯甲酰氯、 邻氰基苯甲酰氯、 邻硝基苯甲酰氯、 三氟乙酸酐、 三乙胺和氯化亚砜, 分析纯, 国药集团化学试剂有限公司; 四氢呋喃, 分析纯, 天津市富宇精细化工有限公司;-叔丁氧羰基-1,2-乙二胺、-叔丁氧羰基-1,3-乙二胺和-叔丁氧羰基-1,4-乙二胺, 分析纯, 上海鸿鹄生物医药科技有限公司; 乙酸乙酯和石油醚, 分析纯, 上海泰坦科技有限公司; 加热反应采用硅油为加热介质; 反应过程中使用薄层层析硅胶板(TLC)监测反应; 所有萃取的有机相均用无水硫酸镁干燥, 用旋转蒸发仪减压浓缩; 柱层析分离使用300~400目硅胶, 硅胶和薄层层析板均为青岛海湾精细化工有限公司产品.
AVANCE III 600 MHz型核磁共振波谱仪(1H NMR), 瑞士Bruker公司; Waters Xevo G2-XS Tof型高分辨质谱仪(HRMS), 美国Agilen公司; CHEETAH中压快速纯化制备色谱, 天津博纳艾杰尔科技有限公司; MP450型全自动熔点仪, 济南海能仪器股份有限公司; ZF-2型三用紫外显色仪, 上海安亭电子仪器厂.
1.2 实验过程
目标化合物的合成路线如Scheme 2所示.
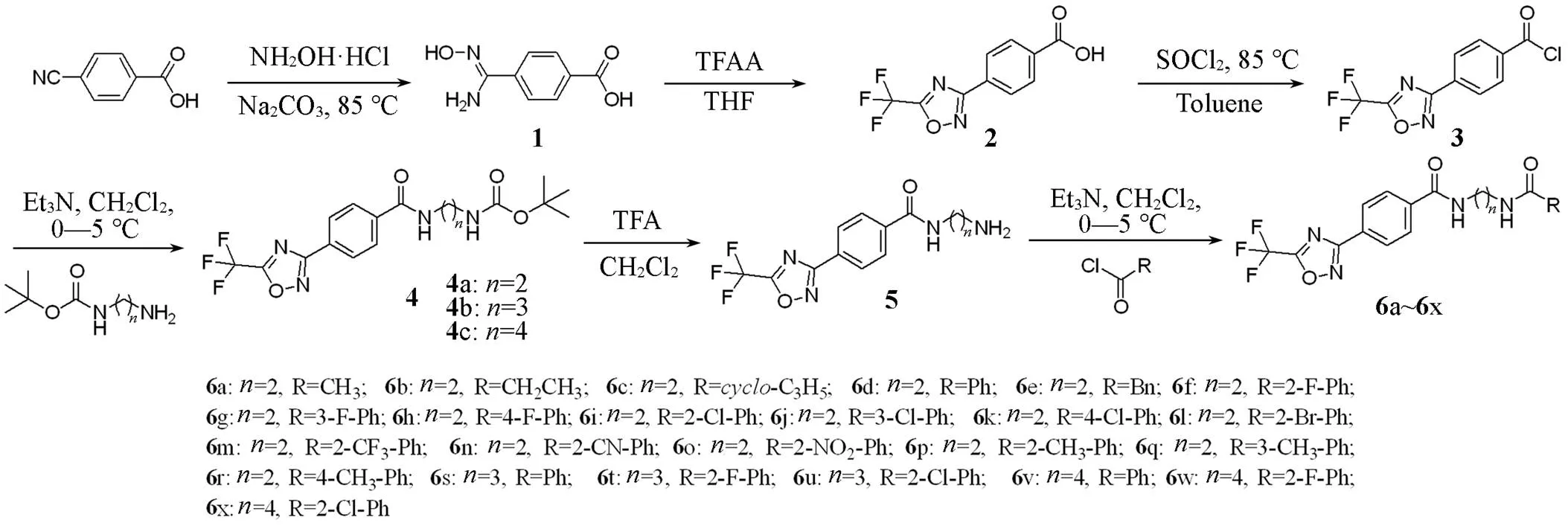
Scheme 2Synthetic routes of target compounds 4a─4c and 6a─6x
1.2.1中间体4a~4c的合成参照文献[18]方法, 先合成中间体1, 再用中间体1与三氟乙酸酐反应合成中间体2.
将7.00 g(27.13mmol)中间体2加入反应瓶中, 再加入80mL甲苯、 16.47 g(138.44 mol)氯化亚砜和0.10 g(1.35 mmol),-二甲基甲酰胺, 缓慢升温至85 ℃, 回流条件下反应4 h, 用薄层色谱(TLC)监测至反应完全. 停止反应,待反应液冷却至室温, 经减压蒸馏除去过量的氯化亚砜和甲苯,得到黄油状中间体3, 直接用于下一步反应.
将4.58 g(28.59 mmol)-叔丁氧羰基-1,2-乙二胺、 6.19 g(61.17 mmol)三乙胺和50 mL二氯甲烷加入250 mL反应瓶中, 冰浴环境下(0~5 ℃)搅拌15 min, 再缓慢滴加中间体3(溶于50 mL二氯甲烷), 继续在冰浴环境下搅拌反应5 h, 用薄层色谱(TLC)监测至反应完全. 停止反应,减压浓缩反应溶液, 残余物经柱层析分离(淋洗剂为乙酸乙酯/石油醚), 得到白色固体中间体4a 7.36 g, 收率67.8%.
参照中间体4a的合成方法, 分别用-叔丁氧羰基-1,3-丙二胺和-叔丁氧羰基-1,4-丁二胺与化合物3进行缩合反应, 制得中间体4b和4c, 收率分别为79.7%和82.5%.
中间体4a~4c的理化数据列于表1,1H NMR数据列于表2(图S1~图S6, 见本文支持信息).

Table 1 Yields and HRMS data of intermediates 4a─4c
*=M+1.

Table 2 1H NMR data of intermediates 4a─4c
1.2.2目标化合物6a~6x的合成将0.50 g(1.25mmol)中间体4a溶解于5 mL二氯甲烷中并开始搅拌, 再加入1.15 g(10.09mmol)三氟乙酸, 室温下搅拌3 h, 用薄层色谱(TLC)监测至反应完全. 停止反应, 反应溶液经减压浓缩得到对应的油状中间体5, 将其溶于5 mL二氯甲烷中, 并加入0.19 g(1.88 mmol)三乙胺, 冰浴环境下(0~5 ℃)搅拌15min, 再缓慢滴加0.10 g(1.27 mmol)乙酰氯(溶于10 mL二氯甲烷), 在冰浴环境下(0~5 ℃)继续反应3 h, 用薄层色谱(TLC)监测至反应完全. 停止反应,反应溶液减压浓缩, 加入20 mL水, 经乙酸乙酯(20mL×3次)萃取, 合并有机相, 经无水硫酸镁干燥后, 过滤, 减压浓缩, 残余物经柱层析分离(淋洗剂为乙酸乙酯/石油醚), 得到白色固体化合物6a, 收率78.8%.
参照化合物6a的合成方法, 用三氟乙酸脱去中间体4a的叔丁氧羰基(Boc)后, 所得化合物与不同酰氯进行缩合反应, 制得化合物6b~6r, 收率51.5%~91.5%; 用三氟乙酸脱去中间体4b的Boc基团后, 所得化合物与不同酰氯进行缩合反应, 制得化合物6s~6u, 收率58.7%~72.6%; 用三氟乙酸脱去 中间体4c的Boc基团后, 所得化合物与不同酰氯进行缩合反应, 制得化合物6v~6x, 收率71.8%~78.3%.
化合物6a~6x的理化数据列于表3,1H NMR数据列于表4(图S7~图S54, 见本文支持信息).
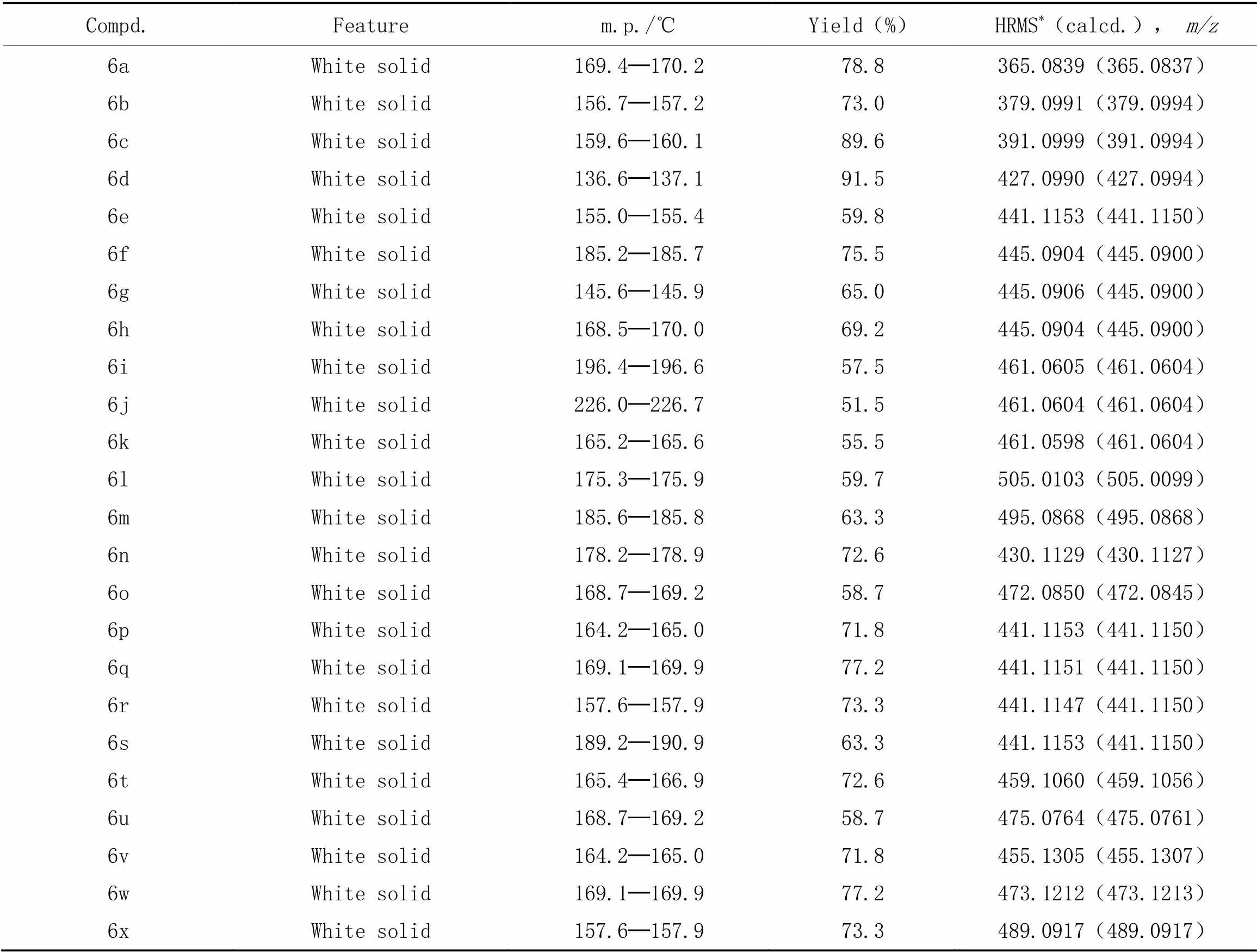
Table 3 Yields and HRMS data of compounds 6a─6x
*=M+1.

Table 4 1H NMR data of midbodies 6a─6x
1.2.3目标化合物的抗菌活性测试用少量溶剂(丙酮/甲醇)溶解目标化合物, 用含有0.1%(质量分数)吐温80的静置自来水稀释成所需浓度的待测液. 采用活体盆栽测定法[29], 以清水作为空白对照, 以苯醚甲环唑(Difenoconazole)和嘧菌酯(Azoxystrobin)两种杀菌剂为阳性对照, 测试了目标化合物对大豆锈病的抗菌活性.
同样采用活体盆栽测定法, 以清水作为空白对照, 以氟唑菌酰胺(Fluxapyroxad)、 烯肟菌胺 (Fenaminstrobin)和嘧菌酯为阳性对照, 测试了化合物6n与Flufenoxadiazam对黄瓜白粉病()、 小麦白粉病()以及玉米锈病()的抗菌活性.
1.2.4分子对接选取高活性的化合物6n与组蛋白去乙酰化酶4(HDAC4)进行分子对接模拟, 探究了目标化合物与HDAC4之间的的结合模式与相互作用. 蛋白质2VQJ(HDAC4)结构由RCBS PDB数据库中检索得到(https://www.rcsb.org/); 再使用AutoDock(4.2.6)可视化作图软件进行分子对接,通过遗传算法优化方法和半经验自由能计算评价函数对不同对接位点进行能量优化; 使用PyMOL(2.2.0)和BIOVIA Discovery Studio 2019工具作图, 观察制备化合物与蛋白的结合方式与相互作用.
2 结果与讨论
2.1 合成及结构表征
在合成目标化合物的过程中, 中间体1易与碳酸钠反应生成大量钠盐溶于水中, 产率损失较大; 利用4 mol/L盐酸缓慢调节滤液的pH值至5~6时, 持续搅拌中滤液不断析出固体,能减少产物的损失; 当滤液pH值的酸性过强时, 中间体1易与盐酸反应生成盐酸盐溶于水中. 因此, 调节滤液的pH值保持在5~6时为宜. 以目标化合物6f为例, 在其1H NMR谱图中,与噁二唑相连的苯环为对位取代, 环上的 4个H以2个双峰的形式分别在8.16和8.06处出现,7.64,7.51及7.31~7.22处的4个H可归属于被F原子取代的苯环上的H,3.48~3.43处的4个H可归属于双酰胺结构间的2个亚甲基上的H. 在化合物6f的HRMS谱图中, 实测值与理论计算值一致, 进一步确证了其化学结构.
2.2 目标化合物的抗菌活性
目标化合物4a~4c和6a~6x对大豆锈病抗菌活性的测试结果列于表5,并与含5-三氟甲基-1,2,4-噁二唑的Flufenoxadiazam杀菌剂[29](在2021年3月获得ISO通用名但尚未商品化)进行对比参考.
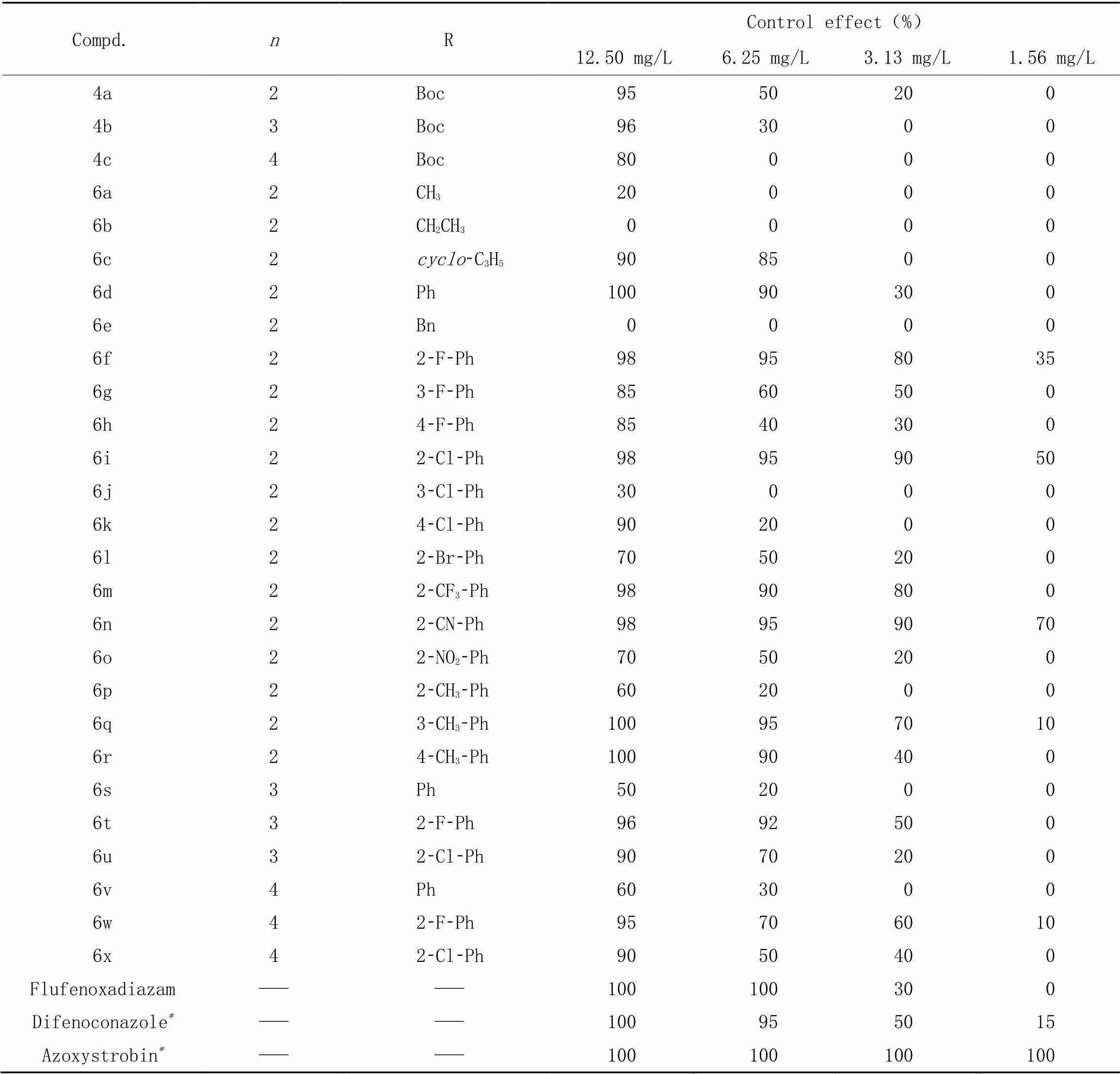
Table 5 Control effect(%) of target compounds 4a─4c and 6a─6x against Soybean rust
*Commercial fungicides difenoconazole and azoxystrobin were used as positive control agents.
测试结果表明, 当浓度为12.50 mg/L时, 大部分化合物对大豆锈病表现出良好的抗菌活性; 当浓度为6.25 mg/L时, 化合物6c, 6d, 6f, 6i, 6m, 6n, 6q, 6r和6t对大豆锈病的防效均不低于85%, 抗菌活性良好; 当浓度为3.13 mg/L时, 化合物6f, 6i, 6m, 6n和6q对大豆锈病仍有超过70%的防效, 优于Flufenoxadiazam(30%)和对照药剂苯醚甲环唑(50%); 当浓度为1.56 mg/L时, 化合物6i和6n对大豆锈病的防效分别为50%和70%, 虽低于嘧菌酯(100%), 仍有较好的抗菌活性.
初步的构效关系研究表明, 当2个酰胺之间的烷基数=2, 且取代基R为烷基时, 直链烷基在目标分子中对大豆锈病的抗菌活性表现较差, 其碳链的延长会进一步降低目标分子的抗菌活性, 而环烷基比直链烷基更有利于目标分子的抗菌活性; 当2个酰胺之间的烷基数=2, 取代基R为未取代、 邻位吸电子基取代、 间位或对位供电子基取代的苯基时, 目标分子均表现出良好的抗菌活性, 其中以邻位吸电子取代基为F原子、 Cl原子、 CF3基和CN基时, 抗菌活性表现优异; 当=3或4时, 碳链的延长会使得化合物的抗菌活性降低, 不利于目标分子的抗菌活性.
采用活体盆栽测定法, 以对大豆锈病抗菌活性最优异的化合物6n为代表, 并与Flufenoxadiazam进行对比参考, 测试了其对黄瓜白粉病、 小麦白粉病以及玉米锈病的抗菌活性. 由表6可知, 化合物6n和Flufenoxadiazam对黄瓜白粉病和小麦白粉病在测试浓度下未表现出抗菌活性, 对玉米锈病则表现出优异的抗菌活性; 而对大豆锈病抗菌活性优于Flufenoxadiazam的化合物6n, 其对玉米锈病的抗菌活性却略低于Flufenoxadiazam, 表明1,2,4-噁二唑类化合物并不能对所有真菌表现出良好的抗菌活性, 不同物种的真菌Ⅱ类的HDACs表现出不同的功能[5], 这也是化合物测定抗菌活性时差异化的原因; 化合物6n与Flufenoxadiazam对玉米锈病表现出优异的抗菌活性, 说明对大豆锈病表现出良好抗菌活性的1,2,4-噁二唑类化合物对其它锈菌目的真菌也能表现出较好的抗菌活性.
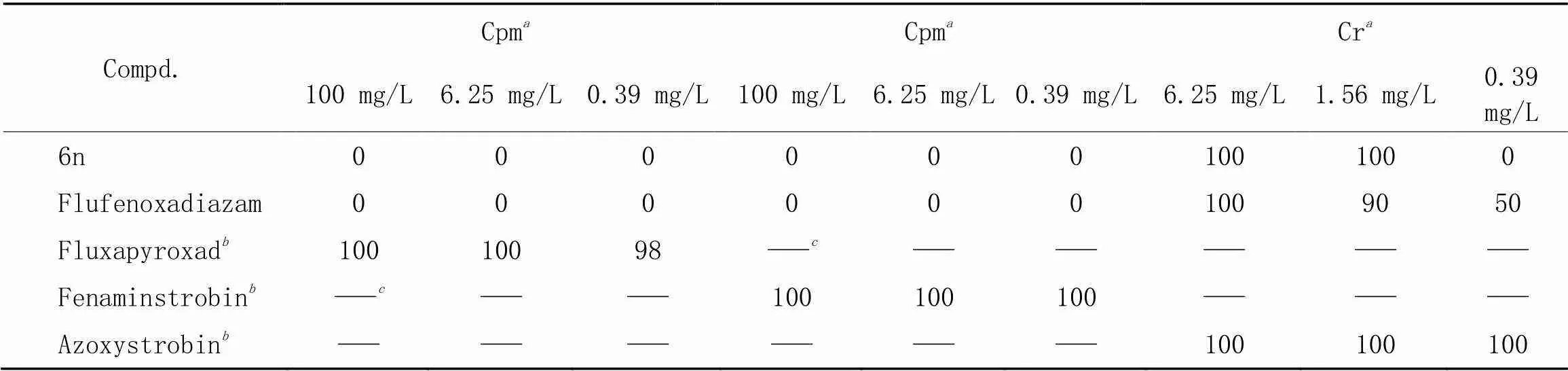
Table 6 Control effect(%) of compound 6n
. Cpm: cucumber powdery mildew; wpm: Wheat powdery mildew; Cr: corn rust;commercial fungicides difenoconazole and azoxystrobin were used as positive control agents;. not tested.
2.3 分子对接
为了探究配体化合物与HDAC4受体的结合方式及相互作用, 对高活性的目标化合物6n与Flufenoxadiazam进行了分子对接. 分子对接结果表明, 化合物6n与Flufenoxadiazam具有非常相近的结合能, 分别为-5.28和-5.23 kcal/mol. Flufenoxadiazam与HDAC4的分子对接结果如图1(A)所示, 含三氟甲基与苯基的1,2,4-噁二唑骨架深度嵌入到活性口袋中, 并与多个氨基酸残基发生明显的相互作用: (1) HIS-158, HIS-159, CYS-169和GLY-330号残基与三氟甲基上的氟原子形成氢键作用, HIS-158号残基与噁二唑环上的氧原子形成一个氢键作用, GLU-329, ASP-196和GLY-167号残基与三氟甲基上的氟原子形成卤键作用; (2) 噁二唑杂环与Zn原子存在-阳离子静电作用, 与 ASP-290之间存在-阴离子静电作用; (3) PRO-156号残基与三氟甲基上的碳原子形成烷基-烷基弱疏水作用, LEU-299号残基与桥连苯环、 PRO-298号残基与邻氟取代的苯环均形成-烷基弱疏水作用, HIS-198号残基与桥连苯环形成-堆叠的疏水作用. 化合物6n与HDAC4的分子对接结果如图1(B)所示, 分子深深嵌入到活性口袋中, 与Flufenoxadiazam一致的噁二唑及桥连苯环骨架部分, 也形成了几乎相同的相互作用; 并且结合姿势表明, 化合物6n与结合口袋的适当形状具有互补性, 通过与结合位点中各个氨基酸残基之间形成的不同相互作用, 使结合模式变得稳定.
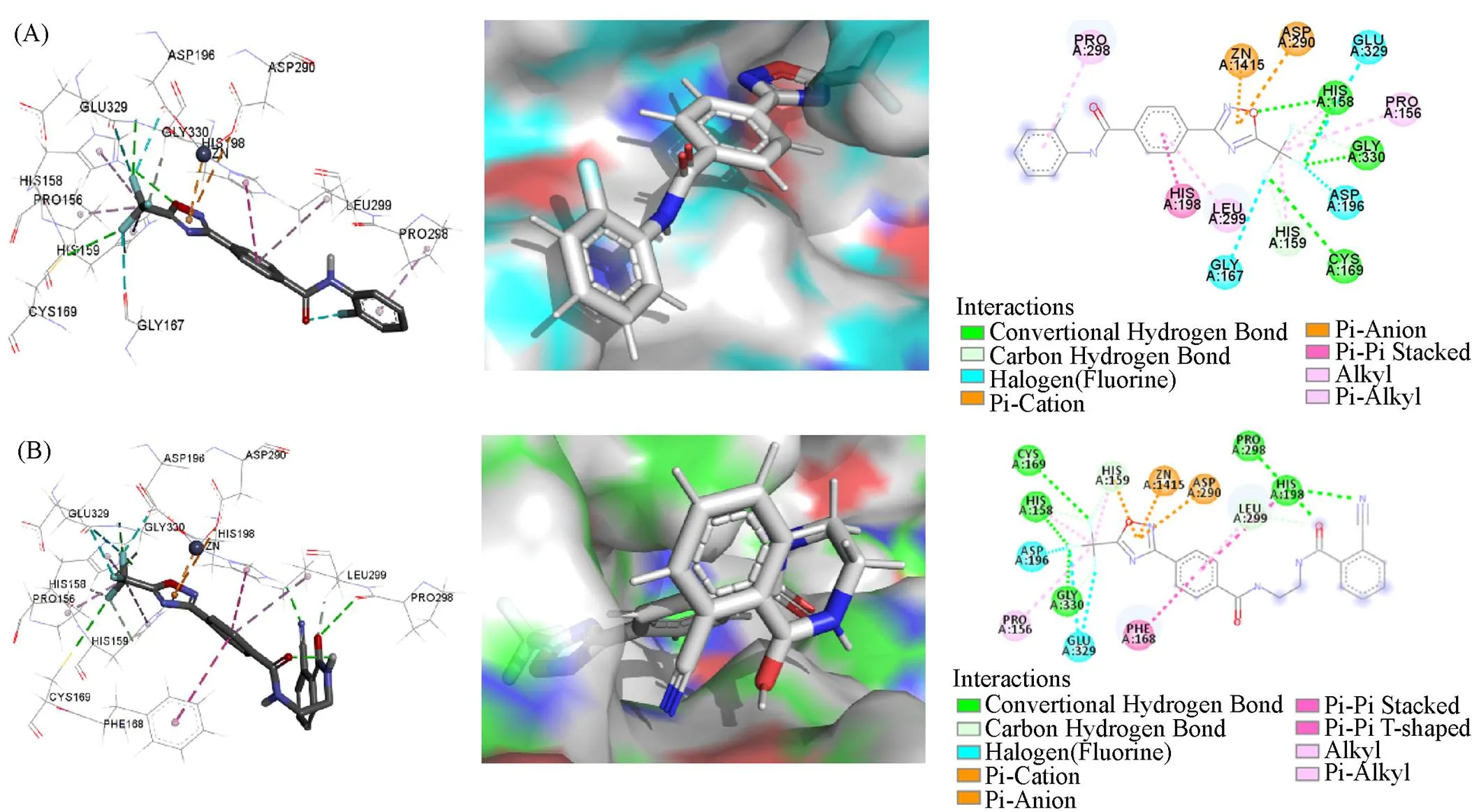
Fig.1 Molecular docking of flufenoxadiazam(A) and compound 6n(B) in the active site of HDAC4(PDB:2VQJ)
值得注意的是, 化合物6n中引入的乙基氨基羰基片段上的氧原子与PRO-298号残基和LEU-299号残基形成了氢键作用, 氰基与HIS-158号残基形成了氢键作用, 这些不同于Flufenoxadiazam之处可能是化合物6n表现出优异抗菌活性的重要原因.
3 结 论
以对氰基苯甲酸为起始原料, 设计合成了27个新型含双酰胺结构的1,2,4-噁二唑类衍生物, 并测试了其对大豆锈病的抗菌活性. 实验结果表明, 大部分化合物对大豆锈病均表现出良好的抗菌活性; 当浓度为3.13 mg/L时, 化合物6f, 6i, 6m, 6n和6q对大豆锈病的防效分别为80%, 90%, 80%, 90%和70%, 均优于杀菌剂Flufenoxadiazam(30%)和对照药剂苯醚甲环唑(50%), 抗菌活性优异; 当浓度为1.56 mg/L时, 化合物6i和6n对大豆锈病仍有50%和70%的防效,抗菌活性最为突出. 同时, 化合物6n对同属锈菌目的玉米锈病也表现出优异的抗菌活性, 当1.56mg/L浓度时, 仍然有100%的防效. 分子对接结果表明, 化合物6n与组蛋白去乙酰化酶4具有多种相互作用, 其中与PRO-298号残基、 LEU-299号残基及HIS-158号残基形成的氢键作用可能是其抗菌活性优异的重要原因.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/20230309.
[1] Li D. D., Zhang S. S., Song Z. H., Wang G. T., Li S. K.,, 2017,, 114—121
[2] Wang L. L., Li C., Zhang Y. Y., Qiao C. H., Ye Y. H.,, 2013,(36), 8632—8640
[3] Price C. L., Parker J. E., Warrilow A. G. S., Kelly D. E., Kelly S. L.,, 2015,(8), 1054—1058
[4] Li Q., Zhang X. M.,, 2018,(4), 23—27(李琼, 张晓明. 农学学报, 2018,(4), 23—27)
[5] Wingter C., Fehr M.,, Elsevier, Amsterdam, 2021, 401—423
[6] Gao J., Zhou M. G.,, 2022,(5), 7—12, 33(高静, 周明国. 现代农药, 2022,(5), 7—12, 33)
[7] Liu M. Z., Pei H. Y., Zhang J., Zhang L. X.,, 2020,(6), 11—21(刘梦竹, 裴鸿艳, 张静, 张立新. 现代农药, 2020,(6), 11—21)
[8] Nazir M., Abbasi M. A., Aziz⁃ur⁃Rehman, Siddiqui S. Z., Khan K. M., Kanwal, Salar U., Shahid M., Ashraf M., Lodhi M. A., Khan F. A.,, 2018,, 253—263
[9] Cui J. G., Pang L. P., Liu C., Sheng H. B., Gan C. F., Zhan J. Y., Liu X. L., Pang C. L., Huang Y. M.,, 2018,(7), 612—622(崔建国, 庞丽萍, 刘畅, 盛海兵, 甘春芳, 展军颜, 刘晓兰, 庞春玲, 黄燕敏. 化学试剂, 2018,(7), 612—622)
[10] Liu B., Xu X. N., Zhu Z. J., Tong H. J., Zhang Y. M., Tang W. Q.,, 2021,(4), 383—387, 399(刘斌, 徐小娜, 朱周静, 仝红娟, 张彦民, 唐文强. 化学通报, 2021,(4), 383—387, 399)
[11] Huang T. H., Tu H. Y., Liu M., Hou C. J., Zhang A. D.,, 2011,(6), 891—896(黄统辉, 涂海洋, 刘名, 侯昌健, 张爱东. 有机化学, 2011,(6), 891—896)
[12] Shi J. M.,Huo J. Q., Zhang Z., Zhang J. L.,, 2016,(4), 530—534(时佳妹, 霍静倩, 张哲, 张金林. 农药学学报, 2016,(4), 530—534)
[13] Oliveira V. S., Pimenteira C., da Silva⁃Alves D. C. B., Leal L. L. L., Neves⁃Filho R. A. W., Navarro D. M. A. F., Santos G. K. N., Dutra K. A., dos Anjos J. V., Soares T. A.,., 2013,(22), 6996—7003
[14] Xie S. S., He J. G., Zhang M., Hou S., Zhang B. J., Ding X. F., Hu Z., Sun R. F.,, 2020,(5), 332—338(谢世爽, 贺建国, 张萌, 侯帅, 张北京, 丁晓帆, 胡展, 孙然锋. 农药, 2020,(5), 332—338)
[15] Tian K. Q., Liu X. X., Wang J., Zhang P.,, 2015,(7), 608—612(田克情, 刘晓欣, 王娇, 张萍. 化学试剂, 2015,(7), 608—612)
[16] Zhang L. T., Su J. Y., Xu X. Y.,, 2021,(9), 3539—3549(章乐天, 苏嘉媛, 徐晓勇. 有机化学, 2021,(9), 3539—3549)
[17] Zhang J., Jin C. F., Zhang Y. J.,, 2014,(4), 662—680(张霁, 金传飞, 张英俊. 有机化学, 2014,(4), 662—680)
[18] Wieja A., Winter C., Rosenbaum C., Kremzow⁃Graw D., Roehl F., Rheinheimer J., Poonoth M., Terteryan V., Haden E., Escribano C. A., Achenbach J. H., Mentzel T.,Wiebe C.,, WO2015185485⁃A1, 2015⁃12⁃10
[19] Brunet S., Desbordes P., Ducerf S., Dufoyr J., Goertz A., Gourgues M., Hilt E., Naud S., Rebstock A., Thomas V., Vernay A., Villalba F., Gortz A.,, WO2019155066⁃A1, 2019⁃8⁃15
[20] Quintero P. M. A., Terteryan⁃Seiser V., Grammenos W., Wiebe C., Montag J., Coquiller M., Neumann T.,, WO2019115511, 2019⁃6⁃20
[21] Hoffman T. J., Stierli D., Pitterna T., Beaudegnies R., Rajan R.,, WO 2019097054⁃A1, 2019⁃ 5⁃23
[22] Cai J., Wei H. T., Hong K. H., Wu X. Q., Cao M., Zong X., Li L. S., Sun C. L., Chen J. Q., Ji M.,2015,, 1—13
[23] Benassi A., Doria F., Pirota V.,,2020,(22), 8692
[24] Good J. A. D., Silver J., Nunez⁃Otero C., Bahnan W., Krishnan K. S., Salin O., Engstrom P., Svensson R., Artursson P., Gylfe A., Bergstrom S., Almqvist F.,, 2016,(5), 2094—2108
[25] Wang P. Y., Shao W. B., Xue H. T., Fang H. S., Zhou J., Wu Z. B., Song B. A., Yang S.,, 2017,(11), 6115—6130
[26] Xu Q. B., Liang P. B., Lu H. Z., Jin S. H., Dong Y. H., Zhang J. J.,, 2021,(8), 3116—3125(许庆博, 梁培博, 路慧哲, 金淑惠, 董燕红, 张建军. 有机化学, 2021,(8), 3116—3125)
[27] Zhang H. Y., Liu M. Y., Yan G., Shi D. Q.,, 2016,(6), 668—676(张瀚匀, 刘曼赟, 严刚, 石德清. 应用化学, 2016,(6), 668—676)
[28] Li L., Li M., Chai B. S., Yang J. C., Song Y. Q., Liu C. L.,, 2016,(9), 1649—1654(李林,李淼, 柴宝山, 杨吉春, 宋玉泉, 刘长令. 高等学校化学学报, 2016,(9), 1649—1654)
[29] Wang F., Liu D. D., Zhu C., Zhang J., Zhang L. X.,, 2022,(5), 326—328(王锋, 刘东东, 朱晨, 张静,张立新. 农药, 2022,(5), 326—328)
Design, Synthesis and Anti-fungal Activity of 1,2,4-Oxadiazole Derivatives Containing Diamide Moiety
WANGFeng1,2, CHENYu1, PEIHongyan1, LIUDongdong1,2, LUOChunfeng3, ZHANGJing1,2,3*, ZHANGLixin1,2,3*
(,,110142,;,,114051,;,,530000,)
To search the novel and efficient antifungal lead compounds, twenty-seven 1,2,4-oxadiazole derivatives (compounds 4a─4c and 6a─6x) containing diamide moiety with novel chemical structures were designed and synthesized, which was based on the method of the splicing of bioactive substructures. The structures of target compounds were characterized by means of1H NMR and HRMS spectra. The bioassay results showed that, at the concentration of 3.13 mg/L, the control effect of compounds 6f, 6i, 6m, 6n and 6q against Soybean rust() were 80%, 90%, 80%, 90% and 70%, respectively. The above activities were all better than Flufenoxadiazam(30%) and the control agent Difenoconazole(50%). Compound 6n also showed prominent antifungal activity against Corn rust(), which control effect was 100% at the concentration of 1.56 mg/L. The molecular docking simulation revealed that compound 6n has various interactions with histone deacetylase 4(HDACs 4),which compound 6n interacts with PRO-298, LEU-299 and HIS-158 through hydrogen bond may be the important source why it showed prominent antifungal activity.
Diamide moiety; 1,2,4-Oxadiazole; Synthesis; Antifungal activity; Molecular docking
2023-07-03
张 静, 男, 高级工程师, 主要从事新农药创制方面的研究. E⁃mail: zhang⁃jing@syuct.edu.cn
张立新, 男, 博士, 教授, 主要从事农药、 医药等功能分子的设计与开发方面的研究. E-mail: zhanglixin@syuct.edu.cn
南宁市创新创业领军人才“邕江计划”创业项目(批准号: 2020002-1)和辽宁省“揭榜挂帅”科技攻关计划项目(批准号:2022JH1/10400018)资助.
O626
A
10.7503/cjcu20230309
Supported by the Nanning Innovation and Entrepreneurship Leading Talents “YongJiang Plan” Entrepreneurship Project, China(No.2020002-1) and the Science and Technology Project of “Unveiling and Commanding” Liaoning Province, China(No.2022JH1/10400018).
2023-08-23.
(Ed.: L, W, K)