乙烯砜功能化磁性颗粒的制备及在棕榈酰化肽分析中的应用
郑海娇, 许文辉, 贾琼
乙烯砜功能化磁性颗粒的制备及在棕榈酰化肽分析中的应用
郑海娇, 许文辉, 贾琼
(吉林大学化学学院, 长春 130012)
以乙烯砜修饰的磁性颗粒作为磁性固相萃取(MSPE)平台的载体, 与基质辅助激光解吸电离飞行时间质谱或液相色谱-高分辨质谱技术联合, 实现了对复杂样品中低丰度棕榈酰化肽的分离富集. 通过场发射扫描电子显微镜、 红外光谱、 振动样品磁强计、 X射线衍射和Zeta电位测定等手段对合成的功能化磁性材料进行了表征. 用自合成的棕榈酰化的棕榈酰辅酶A模拟棕榈酰化肽标准样品, 在最优实验条件下, 构建的MSPE-MS平台能够实现对棕榈酰化肽的高选择性(牛血清白蛋白酶解物与棕榈酰化肽的摩尔比为2000∶1)和高灵敏度(检出限为1.0 fmol/μL)检测. 研究结果表明, 经乙烯砜功能化的磁性材料对小鼠肝细胞裂解液中低含量的棕榈酰化肽具有较高的选择性, 所建立的方法适用于复杂样品的分离分析.
乙烯砜; 磁性颗粒; 磁性固相萃取; 棕榈酰化肽; 质谱检测
长链脂肪酸在蛋白质上进行共价加成的过程被称为蛋白质脂质化修饰. 作为唯一完全可逆的脂质化修饰, 蛋白质棕榈酰化修饰是棕榈酸分子通过不稳定的硫酯键将脂质长链共价结合在可溶性跨膜蛋白分子的半胱氨酸(S)的巯基侧链上. 长链脂质分子的加入增加了蛋白质的疏水性, 从而影响蛋白质的结构、 组装、 活性、 亚基定位与蛋白-蛋白相互作用等功能. 蛋白质的棕榈酰化在细胞信号转导、 代谢等过程中起着重要作用[1~3]. 大量研究揭示了棕榈酰化蛋白在生理机能和疾病发生发展中起到潜在的机制调节功能. 如, 引发全球范围内流行的新型冠状病毒肺炎(Coronavirus disease 2019, COVID-19)的新型冠状病毒(Servere acute respiratory syndrome coronavirus 2, SARS-CoV-2)的刺突蛋白S和包膜蛋白E上均有棕榈酰化位点, 研究这些蛋白的棕榈酰化可为研究新型冠状病毒的致病机制提供思路[4,5]. 目前, 对棕榈酰化蛋白组学的研究主要依靠棕榈酰化蛋白的纯化联合高分辨串联质谱技术. 由于脂质修饰的亚化学计量水平以及棕榈酰化肽的疏水性和硫酯连接的潜在不稳定性, 使得采用质谱技术直接对棕榈酰化蛋白进行分析仍然具有一定的挑战性, 因此, 在质谱检测前对样品进行富集纯化的前处理步骤十分重要.
蛋白质棕榈酰化的纯化技术主要有酰基-生物素交换法(Acyl-biotin exchange, ABE)和点击化学法[1,6~8]. ABE法的主要原理是利用羟胺试剂选择性地标记含有硫酯键的棕榈酰化位点. 点击化学法是使用炔标记的棕榈酸配体进行代谢标记, 然后用带有荧光团的叠氮化物对棕榈酰化肽进行生物正交标记检测或用带有亲和标记的叠氮化物进行亲和富集. 然而, 许多检测方法仍会受到大量假阳性结果的干扰. 这种大量出现假阳性结果的主要原因是所采用的分离富集过程操作繁多, 不可避免地影响了方法的灵敏度和选择性. 2018年, Lu等[9]发展了一种基于二硫二吡啶功能化磁性纳米颗粒的针对棕榈酰化肽的新型富集策略来系统性地鉴定复杂样品中的棕榈酰化修饰. 该研究首次实现了利用功能化磁性材料富集棕榈酰化肽, 将磁性固相微萃取技术(Magnetic solid phase extraction, MSPE)引入到蛋白质棕榈酰化肽的前处理过程中, 鉴定当时最大的小鼠棕榈酰化数据库, 同时降低了分析结果的假阳性, 为实现易修饰、 易操作、 耗时短及灵敏度高的棕榈酰化肽分离富集方法提供了新思路. 由此可见, 进一步开发对棕榈酰化肽具有较强捕获能力的功能化磁性富集材料是棕榈酰化修饰准确鉴定的基础需求.
乙烯砜是一种活性不饱和烃, 由于砜基的强吸电子作用而具有较高的反应活性, 在不同pH条件下可识别巯基、 氨基和糖羟基. 在pH=6.5~7.5的中性条件下仅能识别巯基[10~12], 是选择性专一的保证. 乙烯砜识别巯基的条件温和、 识别迅速且操作简便; 同时乙烯基砜基在水溶液中具有较高的化学稳定性, 副反应少且易于储存, 所以制备基于乙烯砜基的磁性纳米材料用于棕榈酰化肽的捕获具有较高的可行性. 其主要机理为乙烯基可以与亲核基团巯基发生Michael加成反应, 且该反应没有副产物[13]. 研究表明, 乙烯基砜的双键与1分子的亲核试剂发生加成反应生成单加合物后, 裸露的另一端仍保持高反应活性, 易与其它基团反应生成交联加合物[14], 该性能为将乙烯砜基引入各类基底材料提供了基础. 本文利用水热法合成了四氧化三铁(Fe3O4)纳米颗粒, 以硅酸四乙酯(TEOS)对其进行包覆后再以3-巯丙基三乙氧基硅烷(MPTS)对硅烷化的磁性纳米颗粒进行第一步后修饰, 使磁性纳米颗粒表面带有巯基. 再通过巯烯点击反应将双(乙烯砜基)丙醇(BVP)包覆到巯基修饰的颗粒表面, 得到乙烯砜基功能化的磁性纳米颗粒(命名为MagBVP). 实验采取成本低、 耗时短、 简单且产量高的有机合成方法, 制备了可重复利用的磁性纳米颗粒. 以棕榈酰化的棕榈酰化辅酶A作为标准肽段模型, 建立了MSPE-MS平台, 考察了基于乙烯砜基修饰的磁性纳米颗粒对棕榈酰化肽的富集能力及方法的适用性.
1 实验部分
1.1 试剂与仪器
乙二胺四乙酸(EDTA, 纯度99%)、 三氟乙酸(TFA, 纯度≥98%)、 硅酸四乙酯(TEOS, 纯度99%)、 3-巯丙基三乙氧基硅烷(MPTS, 纯度99%)、 乙腈(ACN, 纯度99%)、 2,5-二羟基苯甲酸(DHB, 纯度99%)、 羟氨(NH2OH, 纯度99%)、 棕榈酰辅酶A(palmitoylcoA, 纯度99%)、 牛血清蛋白(BSA, 纯度99%)、 胰蛋白酶(Trypsin, 纯度99%)、 二硫苏糖醇(DTT, 纯度99%)、 碘乙酰胺(IAA, 纯度99%)、 盐酸缓冲溶液(Tris-HCl, 纯度99%)、 双(乙烯砜基)丙醇(BVP, 纯度99%)、 十二烷基硫酸钠(SDS, 纯度99%)、 乙二胺四乙酸(EDTA, 纯度99%)、 棕榈酰氯(纯度≥95%)、 甲酸(纯度99%)和二羟基苯甲酸(DHB, 纯度99%)购于上海阿拉丁生化科技股份有限公司; 三氯化铁(FeCl3·6H2O, 纯度≥98%)、 醋酸钠(NaAc, 纯度99%)、 盐酸(HCl, 纯度99%)、 氨水(NH3·H2O, 纯度25%)、 石油醚(纯度≥98%)、 无水乙醇(纯度≥98%)、 乙二醇(纯度≥98%)、 甲醇(纯度≥98%)、 甲苯(纯度≥98%)、,-二甲基甲酰胺(DMF, 纯度≥98%)、 氯化钠(NaCl, 纯度≥98%)和三氯甲烷(纯度≥98%)均购于北京化学试剂公司; AML12细胞裂解液购于上海生物科技有限公司; 实验用水均采用Milli-Q超纯水仪制备的高纯水; 所用缓冲溶液为现配的盐酸缓冲溶液(50 mmol/L, Tris-HCl).
UID-VSM型磁学性能测试系统(美国Quantum Design公司); SU8020型冷场发射扫描电镜(日本 Hitachi公司); SQNicolet IS5型傅里叶变换红外光谱仪(德国Bruker公司); Zetasizer Nano ZS ZEN3600型纳米粒度和ZETA电位分析仪(英国Malvern公司); X射线衍射仪(荷兰PANalytical B.V.公司); Milli-Q型超纯水仪(美国Millipore公司); AB Sciex 5800型飞行时间质谱仪(美国AB SCIEX公司); Thermo Scientific Q Exactive™液相色谱串联质谱仪(美国Thermo Scientific公司).
1.2 实验过程
1.2.1标准棕榈酰化肽模型的合成标准棕榈酰化肽模型(命名为PalmitoylcoA-palm)通过棕榈酰氯与棕榈酰辅酶A的酰化反应合成[15]. 将50 μg棕榈酰辅酶A与5 μL棕榈酰氯溶于1 mL TFA溶液中, 于25 ℃搅拌30 min. 所得产物经重结晶后用石油醚和无水乙醇反复洗涤, 再经真空烘干, 烘干的粉末经真空冻干成棕榈酰化肽的冻干粉, 备用.
1.2.2羟胺化处理称取上述冻干粉(1.0 mg)溶解于1 mL Tris-HCl缓冲溶液中, 混合均匀后加入EDTA和三氯甲烷-甲醇溶剂, 静置10 min, 再依次加入0.04 g/mL SDS, 150 mmol/L NaCl, 1 mmol/L EDTA和0.67 mol/L的NH2OH(pH=7.5), 加热至沸腾并保持10 min[16].
1.2.3酶解步骤称取1 mg BSA冻干粉标准品溶解于含有8 mol/L尿素的1 mL Tris-HCl缓冲溶液中, 加入100 μL DTT(1 mol/L), 在56 ℃下反应1 h, 随后加入37 mg IAA, 室温下于暗室中继续反应 45 min. 将烷基化处理后的样品用Tris-HCl缓冲溶液稀释至尿素浓度小于1 mol/L, 将BSA样品置于100 ℃金属浴中加热10 min使蛋白发生变性反应. 待样品冷却至室温后, 按比例加入1 mg/mL的胰蛋白酶(BSA与胰蛋白酶的质量比为50∶1), 于37 ℃振荡水浴装置中进行酶解反应, 反应16 h后加入2 μL甲酸充分混匀, 室温下静置1 h, 所制备的酶解液均保存于-20℃冰箱中备用[17].
1.2.4实际样品的处理AML12细胞裂解液经上述酶解步骤后进行羟胺化处理, 备用.
1.2.5MagBVP的合成MagBVP颗粒的合成主要包括以下4步: (1) 采用水热法合成Fe3O4颗粒[18~20]. 称量1.35 g FeCl3·6H2O溶于75 mL乙二醇溶剂中, 搅拌均匀后加入3.60 g NaAc, 继续搅拌至生成黄色溶液. 将黄色混合溶液移至100 mL的不锈钢反应釜中, 置于200 ℃烘箱中反应16 h后, 冷却至室温. 将产物用乙醇和超纯水依次反复冲洗, 通过磁吸法分离得到Fe3O4颗粒. (2) 对合成的Fe3O4颗粒进行硅烷化. 称量350 mg Fe3O4颗粒均匀分散于275 mL乙醇-水(体积比4∶1)溶液中, 加入1.4 mL NH3·H2O(质量分数25%)并充分混匀, 再加入1 mL TEOS, 于25 ℃搅拌反应12 h, 通过磁吸法分离得到硅烷化的Fe3O4颗粒(命名为MagTEOS). (3) MagTEOS的巯基化. 称量100 mg MagTEOS分散到30 mL乙醇中, 加入1.3 mL MPTS, 室温下搅拌1 h, 通过磁吸分离得到巯基化的磁性颗粒(命名为MagMPTS)[21]. (4) BVP的后修饰. 称量100 mg BVP和10 mg DMAP, 依次加入到10 mL DMF和400 μL DIPEA的混合溶液中, 充分混匀后加入MagMPTS, 室温下搅拌24 h. 依次用DMF和纯水清洗产物, 通过磁吸分离得到终产物——BVP修饰的磁性颗粒(命名为MagBVP).
1.2.6MSPE富集棕榈酰化肽过程将制备的MagBVP用Tris-HCl缓冲溶液(50 mmol/L, pH=6.5)多次洗涤后再将其分散于Tris-HCl缓冲溶液(10 mg/mL)中备用. MSPE前处理步骤主要包括上样、 清洗和 解吸[22,23]. 首先, 取20 μL上述储备液加入到100 μL样品溶液中(所需的不同浓度的样品均用缓冲溶剂进行稀释), 用恒温振荡器在室温下振荡45 min后, 通过磁吸分离样品与材料. 除去溶剂后, 每次用100 μL Tris-HCl缓冲溶剂对材料反复洗涤3次, 以清洗去除非目标肽段. 最后, 在清洗过的材料中加入30 μL解吸液(50% ACN/H2O + 0.1% TFA), 室温下振荡20 min, 以磁吸的方式分离材料并收集解析液以用于后续分析.
1.2.7仪器条件设置MALDI-TOF MS条件设置: 标准待测样品均用AB Sciex 5800型飞行时间质谱仪测试, 选用阳离子模式, 采用含25 mg/mL DHB的50%ACN/H2O+0.1%TFA溶液作为基质. 测试前, 取待测样品与DHB基质溶液各0.5 μL, 均匀混合后滴于质谱仪靶板表面. 其它参数设置如下: 离子源温度110 ℃; 电喷雾电压2.3 kV; 扫描范围/z 1000~3500; 毛细管电压3500 V; 碰撞解离能量10 eV.
LC-MS/MS的液相色谱条件设置: RSLC C18色谱柱(75 μm i.d.×150 mm), 流动相A为0.1%甲酸, 流动相B为0.1%甲酸+80% ACN, 梯度洗脱模式: 0~3 min, 95%A; 3~28 min, 90%~62%A; 31~40 min, 62%~0%A. 流速500 nL/min. 质谱条件设置: 一级质谱分辨率120000, AGC target: 4×105, Maximum IT: 50 ms, 扫描范围/350~1550; 二级质谱分辨率50000, AGC target: 1×105, Maximum IT: 100 ms, TopN: 20, NCE/stepped NCE: 32.
1.2.8数据库分析采用 PEAKS 软件进行数据库检索, 蛋白酶解类型为胰蛋白酶, 最多允许3个漏切位点, 母离子质量偏差1.5×10‒5, 碎片离子质量误差0.03 Da, 可变修饰: Palmitoylation, 固定修饰: Carbamidomethylation.
2 结果与讨论
2.1 MagBVP的合成与表征
MagBVP的合成及MSPE流程见Scheme 1. 经BVP修饰前后Fe3O4颗粒的形貌和大小可通过扫描电子显微镜(SEM)来观察. 由图1可见, 只经TEOS硅烷化后的Fe3O4颗粒表面较光滑且颗粒有明显聚集的现象[图1(A)]; 经MPTS进一步修饰后的颗粒表面略微粗糙, 聚集现象无明显改善, 颗粒直径尺寸略大于MagTEOS[图1(B)]. 经BVP第二步后修饰的Fe3O4颗粒表面更加粗糙的同时分散性有一定改善, 且颗粒尺寸为3种颗粒中最大的, 主要原因是通过表面覆盖的修饰物降低了颗粒之间的磁性偶极吸引[图1(C)]. 采用红外光谱(FTIR)对MagBVP及合成过程中的中间产物进行了表征, 结果见图2. 图2(A)谱线~中, MagTEOS, MagMPTS及MagBVP 3种磁性颗粒在1078和788 cm-1处均有相似的特征吸收峰, 分别由Fe—O键的弯曲振动、 Si—O—Si键不对称伸缩振动和Si—O键的弯曲振动引起, 说明Fe3O4颗粒的已硅烷化. 对比谱线和发现, 在3469和1568 cm-1处出现了属于S—H和C—S的特征吸收峰, 证实了MTPS已修饰. 对比谱线和发现, 增加了1188 cm-1处的吸收峰, 该峰归属于S=O的伸缩振动, 说明MagBVP已制备. 图2(B)为3种磁性颗粒的振动样品磁强计(VSM)曲线, 修饰前/后磁性微球的饱和磁通量分别为77.4, 71.8和53.9 A·m2·kg‒1, 均达到磁性分离要求. 图2(B)中插图表明在外界磁场作用下, MagBVP可以在约30 s的时间内迅速与溶液分离. 图2(C)中谱线~为3种磁性颗粒的X射线衍射(XRD)谱图, 对比JCPDS粉末衍射标准联合委员会中数据库, 3种磁性颗粒均出现的衍射峰(2=30.3°, 35.6°, 43.4°, 57.3°, 63.0°)与Fe3O4的(220), (311), (400), (511)和(440)晶面相匹配[24], 说明基团的后修饰并未破坏铁磁颗粒的晶格结构. 图2(D)为在弱酸性条件下测定的3种磁性颗粒表面的电性. MagTEOS由于表面的多羟基使Zeta电位为负值, 与之对比, MagMPTS由于表面修饰了大量巯基基团, 表面电负性增强, 而MagBVP表面修饰了可与巯基结合的乙烯砜, 材料表面电负性进一步增强, 验证了材料的吸附机理.

Fig.1 SEM images of MagTEOS(A), MagMPTS(B) and MagBVP(C)
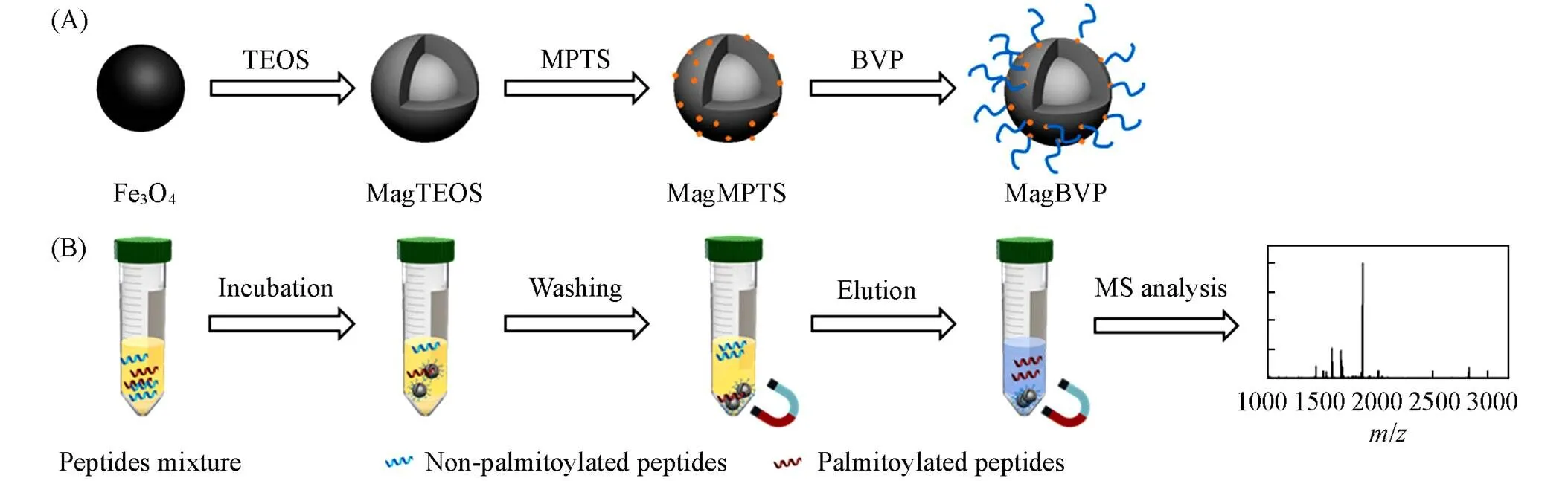
Scheme 1Synthetic route of MagBVP(A) and workflow of palmitoylated peptides enrichment by MagBVP(B)
2.2 MagBVP对棕榈酰化肽的富集能力
采用胰蛋白酶酶解的20 pmol BSA酶解产物与合成的棕榈酰化肽的混合溶液作为标准样品, 考察了MagBVP对棕榈酰化肽的富集能力. 由于MagBVP选择性识别巯基的行为依赖于中性的pH环境, 因此对样品溶液的pH条件进行了优化. 考察了不同pH值的Tris-HCl缓冲溶液(50 mmol/L, pH= 4.5~10.5)的影响, 结果表明, 当pH=6.5时, 质谱所检测到的棕榈酰化肽丰度最高; 而在pH=4.5~5或9.5~10.5范围内, 几乎未检测到棕榈酰化肽[图3(A)]. 最终, 确定Tris-HCl(50 mmol/L, pH=6.5)为最佳的样品缓冲溶液. 通过紫外光谱法计算了MagBVP与棕榈酰化肽之间的结合能, 得到饱和结合能为117.9 mg/g[图3(B)]. 最后, 通过分子对接计算模拟出乙烯砜基与棕榈酰化肽的结合位点[25][图3(C)]. 以上结果均说明, MagBVP对棕榈酰化肽具有较好的捕获能力, 可以用于后续标准样品的分析.
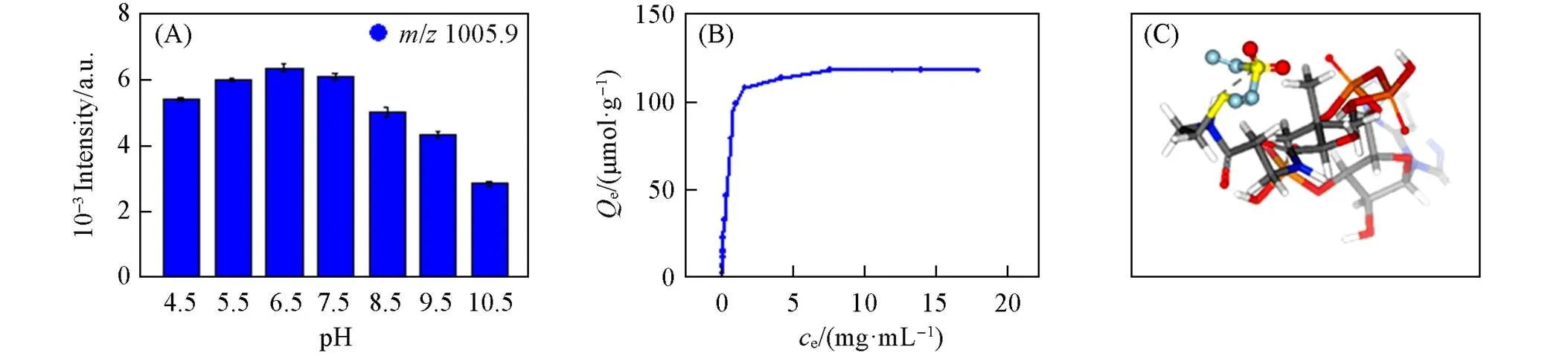
Fig.3 Effects of pH on the enrichment capacity of palmitoylcoA⁃palm by MagBVP(A), saturated adsorption isotherms for palmitoylcoA⁃palm at pH 6.5(B), and affinity and binding sites between the active sites in MagBVP and palmitoylcoA⁃palm(treated with NH2OH)(C)
随后, 测定了MagBVP对棕榈酰化肽的富集能力, 与MALDI-MS联用, 同样采用胰蛋白酶酶解的20 pmol BSA酶解产物与合成的棕榈酰化肽的混合溶液作为标准样品. 如图4所示, 未经富集的质谱图中没有目标待测物的信号峰[图4(A)], 且背景信号峰干扰明显; 而经过MagBVP富集后, 质谱图中出现明显的棕榈酰化肽信号峰[1005.9, 如图4(B)], 且背景信号峰干扰极小. 在相同的实验条件下, 用未经BVP修饰的MagTEOS和MagMPTS分别对棕榈酰化肽样品进行了富集. 如图4(C)和(D)所示, 经MagTEOS和MagMPTS富集后的质谱图中未出现目标待测物的信号峰. 综上所述, 经BVP修饰的磁性颗粒具有较强的捕获棕榈酰化肽的能力.
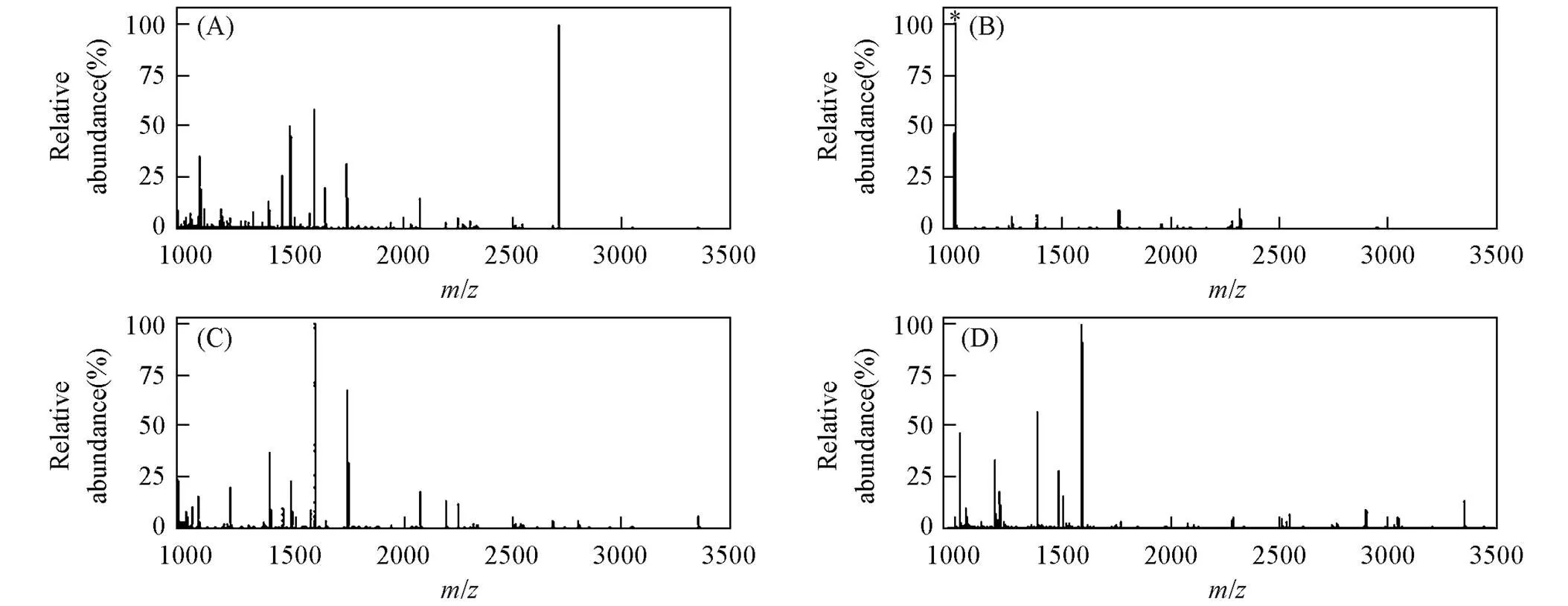
Fig.4 MALDI mass spectra of BSA tryptic digest and palmitoylcoA⁃palm mixture before(A) and after enrichment by MagBVP(B), MagTEOS(C) and MagMPTS(D)
(A) BSA: palmitoylcoA-palm molar ratio is 100∶1; (B) palmitoylated peptides are marked.
考察了基于MagBVP的MSPE-MS方法的灵敏度, 配制浓度分别为1.0~5.0 fmol/μL的棕榈酰化肽标准溶液并经羟胺处理, 分别经MagBVP富集后再用质谱检测. 图5(A)~(C)结果表明, 当标准肽段溶液的浓度<1.0 fmol/μL时, 在质谱图中观察不到该目标肽段的信号峰, 而当浓度≥1.0 fmol/μL时, 质谱图中存在目标肽段信号峰, 且 S/N>3. 由此测得本方法的最低检出限(LOD)为1.0 fmol/μL. 考察了基于MagBVP的MSPE-MS方法的稳定性, 制备的MagBVP经7次循环使用后质谱图中信号丰度并未明显下降[图6(A)和(B)]. 随后, 考察了基于MagBVP的MSPE-MS方法对棕榈酰化肽的选择性, 将BSA的酶解产物与合成的棕榈酰化肽段按摩尔比2000∶1混合作为复杂样品. 结果表明, 在未经任何富集的质谱谱图中未观察到棕榈酰化肽的信号[图6(C)]; 在经 MagBVP富集后的质谱图中发现明显的棕榈酰化肽的信号[图6(D)], 而非棕榈酰化肽的信号被抑制, 说明MagBVP适用于捕获复杂样品中棕榈酰化肽, 后续可以考虑将MagBVP用于实际样品分析应用中.
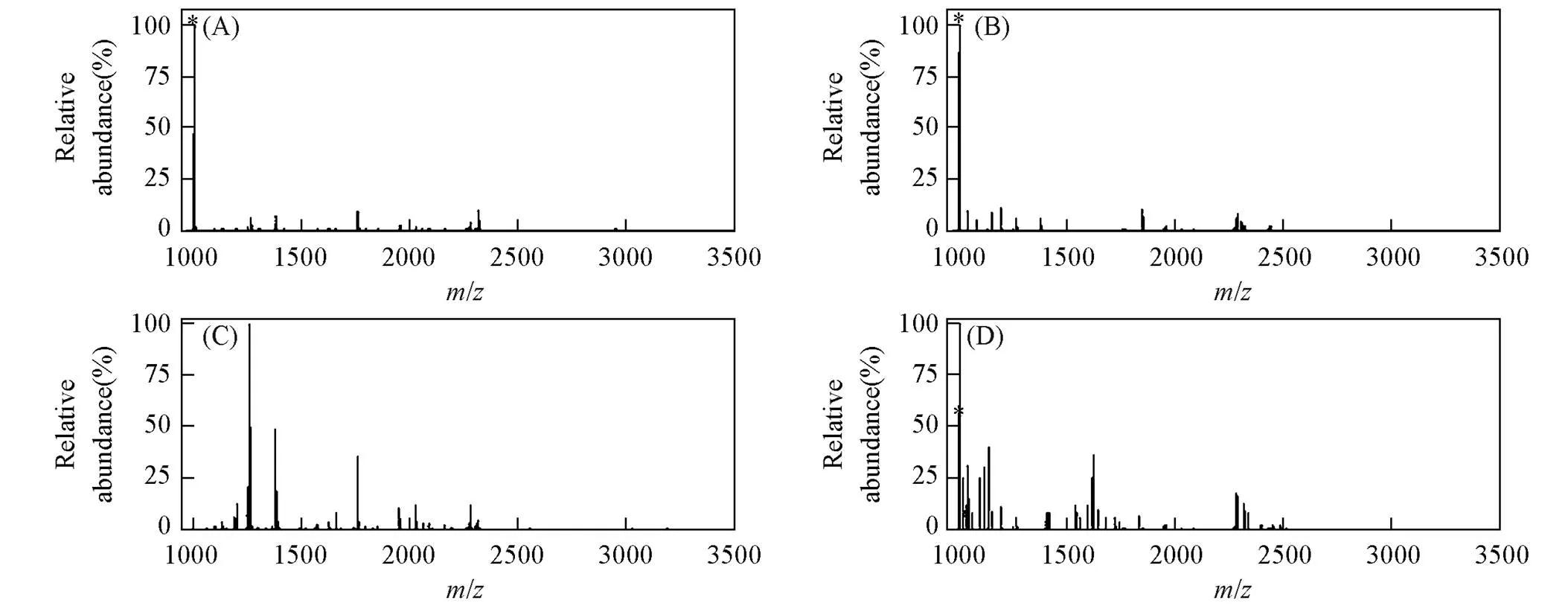
Fig.6 MALDI mass spectra of tryptic digest mixtures of BSA and palmitoylcoA⁃palm after enrichment by MagBVP
(A) For the first time; (B) after 7 cycles; (C) before and (D) after enrichment by MagBVP. Palmitoylated peptides are marked. (A, B) BSA: palmitoylcoA-palm molar ratio was 100∶1; (C, D) BSA: palmitoylcoA-palm molar ratio was 2000∶1.
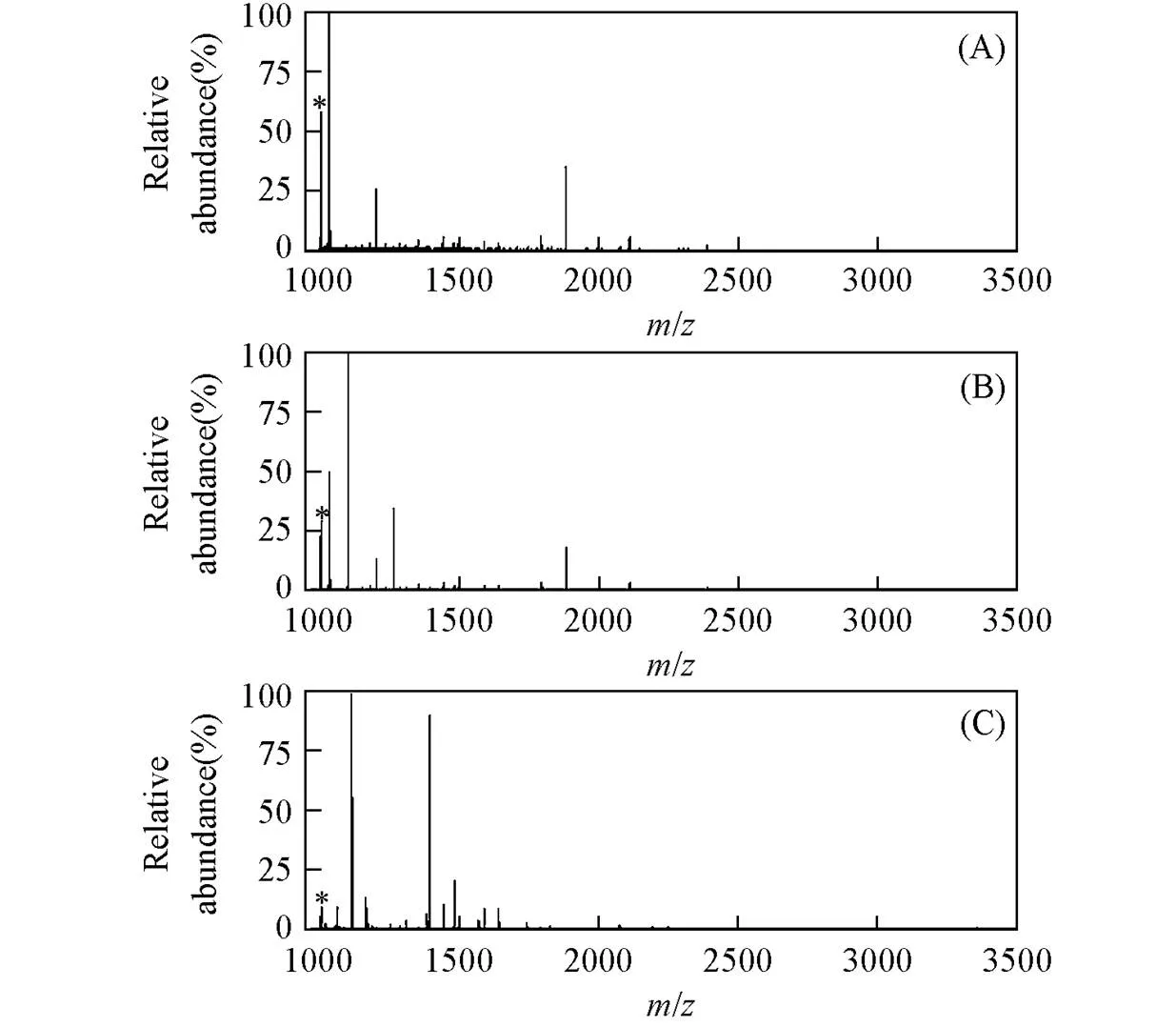
Fig.5 MALDI mass spectra of tryptic digest mixtures of palmitoylcoA⁃palm and BSA after enrichment by MagBVP
(A) 5.0 fmol/μL; (B) 2.5 fmol/μL; (C) 1.0 fmol/μL. Palmitoylated peptides are marked.
2.3 实际样品的分析
基于MagBVP的MSPE-MS方法对复杂样品的富集效果评价了所建立的方法实际应用的可行性. 选取AML12细胞裂解液(=3)作为实际样品, 在最优化的富集条件下对8 μL细胞裂解液样品进行检测, 经分析得出其中含有260种棕榈酰化蛋白[图7(A)与表S1, 见本文支持信息]. 对实际样品中的棕榈酰化蛋白进行GO功能注释及富集分析[图7(B)][26], 结果表明, 所鉴定的棕榈酰蛋白主要富集于细胞质中, 并通过与各种分子结合参与脂质代谢过程.
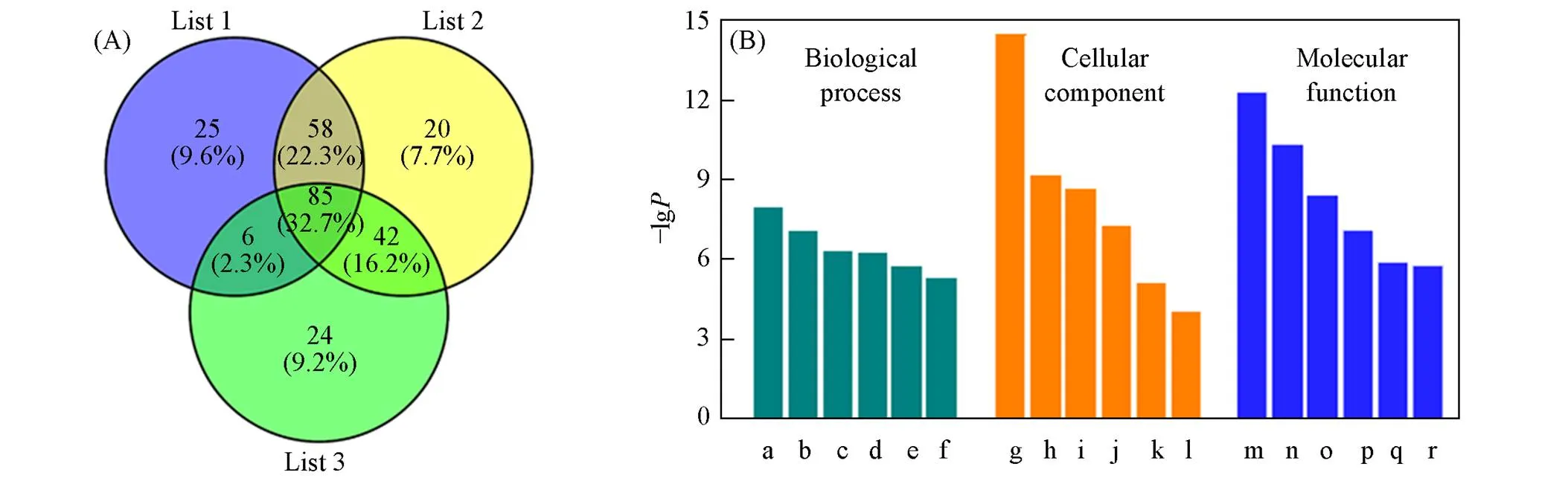
Fig.7 Venn’s diagrams of the identified palmitoylated peptides(n=3)(A) and GO analysis results of identified palmitoylated proteins categorized by biological process, cellular component, and molecular function(B)
a. Lipid metabolic process; b. positive regulation of transcription from RNA polymerase II promoter; c. negative regulation of apoptotic process; d. spermatogenesis; e. response to drug; f. fatty acid metabolic process; g. cytoplasm; h. membrane; i. cytosol; j. nucleoplasm; k. mitochondrion; l. intracellular membrane-bounded organelle; m. protein binding; n. metal ion binding; o. nucleotide binding; p. ATP binding; q. identical protein binding; r. oxidoreductase activity.
3 结 论
制备了乙烯砜修饰的磁性纳米颗粒吸附剂, 通过SEM, FTIR, VSM及XRD表征了材料的结构与性能. 制备的MagBVP具有良好的分散性和均匀的颗粒结构, 晶型结构稳定, 磁感应性强, 饱和磁化强度为53.9 A·m2·kg‒1. MagBVP表面枝接的双(乙烯砜基)丙醇化合物可提供大量的乙烯砜, 在中性pH条件下能够快速高效地与巯基发生点击反应, 适用于识别经羟胺处理过的表面巯基暴露的棕榈酰化肽. 乙烯砜副反应少, 通过简单地控制溶液pH条件即可实现精准专一的对巯基的识别. 将MagBVP用于MSPE前处理技术, 以棕榈酰化模拟肽段作为标准样品, 结合MALDI-TOF MS平台, 证明了方法用于棕榈酰化肽的分析性能. 结果表明, 该方法具有较高的灵敏度(检出限低至1.0 fmol/μL)和较好的选择性[(BSA酶解产物)∶(棕榈酰化肽)=2000∶1]. 以上结果均表明, 所构建的基于MagBVP和MSPE-MS的联用方法在棕榈酰化肽的分析检测方面具有良好的可行性. 最后, 将所建立的平台用于小鼠肝脏细胞裂解液中棕榈酰化肽的鉴定, 共鉴定出260种棕榈酰化蛋白, 证明该方法可用于复杂实际生物样品的分析检测, 为日后将该方法用于临床样品分析提供了理论基础, 同时为蛋白质棕榈酰化修饰的鉴定提供了新方法.
支持信息见http://www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20230239.
[1] Zhang X. Q., Zhang L., Ji G. H., Lei Q. Y., Fang C. Y., Lu H. J.,, 2018,, 10543—10550
[2] Anderson A. M., Ragan M. A.,, 2016,, 16028
[3] Linder M. E., Deschenes R. J.,, 2007,, 74—84
[4] Kuzmin A., Orekhov P., Astashkin R., Gordeliy V., Gushchin I.,, 2022,, 1102—1114
[5] Schoeman D., Fielding B. C.,, 2019,, 69
[6] Wan J., Roth A. F., Bailey A. O., Davis N. G.,, 2007,, 1573—1584
[7] Chamberlain L. H., Shipston M. J.,, 2015,, 341—376
[8] Ji Y. H., Leymarie N., Haeussler D. J., Bachschmid M. M., Costello C. E., Lin C.,, 2013,(24), 11952—11959
[9] Zhang X. Q., Zhang Y. T., Fang C. Y., Zhang L., Yang P. Y., Wang C. C., Lu H. J.,, 2018,, 6161—6168
[10] dos Santos J. C. S., Rueda N., Barbosa O., Millán⁃Linares M. C., Pedroche J., Yuste M. M., Goncalves L. R. B., Fernandez⁃Lafuente R.,, 2015,, 38—44
[11] Wang H. Q., Cheng F., Li M. Y., Peng W., Qu J. P.,, 2015,, 3413—3421
[12] Bezerra R. M., Monteiro R. R. C., Andrade Neto D. M., da Silva F. F. M., de Paula R. C. M., de Lemos T. L.G., Fechine P. B. A., Correa M. A., Bohn F, Gonçalves L. R. B., dos Santos J. C. S.,, 2020,, 109560
[13] David Arthur H. G., García⁃Cerezo P., Campaña A. G., Santoyo⁃González F., Blanco V.,, 2022,, 633—642
[14] Ortega⁃Muñoz M., Morales⁃Sanfrutos J., Megia⁃Fernandez A., Lopez⁃Jaramillo F. J., Hernandez⁃Mateo F., Santoyo⁃Gonzalez F.,, 2010,(34), 7189—7196
[15] Zheng H. J., Wang Z. R., Jia Q.,, 2023, 2300254
[16] Li Y. M., Wang S. S., Chen Y. C., Li M. J., Dong X. S., Hang H. C., Peng T.,, 2020,, 13880—13883
[17] Zhao H. H., Li C. Y., Jin H.,, 2021,(12), 3624—3631(赵欢欢, 李存玉, 金红. 高等学校化学学报, 2021,(12), 3624—3631)
[18] Zheng H. J., Jiang L. Y., Jia Q.,, 2021,(3), 717—724(郑海娇, 姜丽艳, 贾琼. 高等学校化学学报, 2021,(3), 717—724)
[19] Xu Y., Yang H. G., NIiu H. B., Tian H. L., Piao H. G., Huang Y. P., Fang Y. F.,, 2021,(8), 2564—2573(徐艳, 杨宏国, 牛慧斌, 田海林, 朴红光, 黄应平, 方艳芬. 高等学校化学学报, 2021,(8), 2564—2573)
[20] Zheng H. J., Jia J. X., Li Z., Jia Q.,, 2020,, 2680—2689
[21] Pallavicini P., Cabrini E., Casu A., Dacarro G., Diaz⁃Fernandez Y. A., Falqui A., Milanesea C., Vita F.,, 2015,, 21088—21098
[22] Feng Y. M., Shi Y. H., Huang R., Wang P. P., Li G. L.,, 2023,, 136349
[23] Riazi Bonab H., Abbas Matin A., Heidari H., Ciraqov F.,, 2023,, 464129
[24] Wardani R. K., Dahlan K., Wahyudi S. T., Sukaryo S. G.,, 2019,, 020137
[25] Chen V. B., Arendall W. B., Headd J. J., Keedy D. A., Immormino R. M., Kapral G. J., Murray L. W., Richardson J. S., Richardson D. C.,, 2010,, 12—21
[26] Huang D. W., Sherman B. T., Lempicki R. A.,, 2009,, 44—57
Vinyl Sulfone Functionalized Magnetic Nanoparticles and Its Application in Palmitoylated Peptides Enrichment
ZHENGHaijiao, XUWenhui, JIAQiong*
(,,130012,)
Vinyl sulfone modified magnetic nanoparticles(denoted as MagBVP) were synthesized and used as the magnetic carrier of magnetic solid phase extraction(MSPE) platform, combined with MALDI-TOF MS or LC-MS/MS. The MagBVP was characterized by means of vibrating sample magnetometer, field emission scanning electron microscopy, infrared spectroscopy, zeta potential measurement and X-ray diffraction. The synthesized palmitoylated palmitoyl-coA was selected as the modeling palmitoylated peptide sample. Under the optimal conditions, the MSPE-MS platform could achieve high selectivity(BSA tryptic digests/palmitoylated peptide molar ratio of 2000∶1) and sensitivity(the detection limit was determined to be as low as 1.0 fmol/μL) for palmitoylated peptide. Finally, the method was applied to the determination of palmitoylated peptides in cell lysates samples. These results showed that the magnetic material modified by vinyl sulfone had a high selectivity for palmitoylomics.
Sulfone, Magnetic nanoparticle; Magnetic solid phase extraction; Palmitoylomics; Mass spectrometry
2023-05-18
贾 琼, 女, 博士, 教授, 主要从事复杂样品分离分析研究. E-mail: jiaqiong@jlu.edu.cn
国家自然科学基金(批准号: 22004045)资助.
O652.6; O657.6
A
10.7503/cjcu20230239
2023-07-11.
Supported by the National Natural Science Foundation of China(No.22004045).
(Ed.: N, K)