基于小鼠肝细胞癌全转录组测序的Ighmbp2表达上调的机制
陈峥宇,倪安妮,唐玉莲,孙丽双,李 书,刘会婷,罗绿景,李根亮
(右江民族医学院基础医学院生物化学与分子生物学教研室,百色 533000;*通讯作者,E-mail:ligenliang@ymcn.edu.cn)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌,其预后差,致死率高,是最常见的恶性肿瘤,复发和转移率很高[1-6]。研究发现,部分基因在其发病和转移过程中发生了异常变化[7,8]。弄清这些基因异常表达的原因有利于更好地了解其在肝癌预防、发生和转移中的分子表达机制,为HCC的研究提供更多的研究思路。然而,大多数出现在肝癌组织及其相关的非病变组织的基因的异常表达机制尚不清楚。因此,研究出肝癌组织及其相关组织中基因的异常表达机制具有重要的研究意义,并且可能产生潜在的临床价值。
免疫球蛋白μ结合蛋白2(immunoglobulin mu-binding protein 2,Ighmbp2),该基因编码是螺旋酶家族的成员,它与免疫球蛋白区域的特定DNA序列结合。该蛋白与DNA复制、前mRNA剪接和转录有关系,并具有多态性[9,10]。Ighmbp2是一种依赖ATP的5′端-3′端的螺旋酶,这种螺旋酶主要分布在神经元和非神经元细胞的细胞质上,并与核糖体相关。已有研究表明,Ighmbp2引起的氨基酸替代不会影响核糖体结合,但会严重损害ATPase和螺旋酶的活性[9]。Ighmbp2相关疾病可导致胃肠道自主功能障碍的严重外周神经病变[11]。Ighmbp2可以通过心脏功能适应和物理修饰来改变DCM的过程,以应对负荷和呼吸需求的变化[12]。最近的研究表明,Ighmbp2基因在许多癌症组织中上调表达,参与多种恶性瘤体的生长和发展而对预后产生负面影响[13-15]。然而,Ighmbp2在肝细胞癌(HCC)中过表达的可能机制有待进一步研究。
在本研究中,通过全转录组测序以及生物信息学分析数据,分析Ighmbp2基因在HCC中的表达,进一步分析全转录组数据中各种mRNAs、miRNAs和lncRNAs与Ighmbp2基因的PPI、ceRNA和靶向性等互作关系,并筛选出Ighmbp2的相关基因,分析其参与的生物学功能,探讨Ighmbp2基因在HCC组织中上调表达的可能调控机制。
1 材料和方法
1.1 细胞株及实验动物
小鼠H22细胞系(上海中乔新舟生物科技有限公司)。6~8周雄性昆明小鼠100只(长沙市天勤生物技术有限公司,生产许可证:scxk(湘)2014-0010,scxk(湘)2014-0011),洁净级,体质量25~30 g。
1.2 主要仪器及试剂
二氧化碳培养箱(三洋有限公司,日本),超微量分光光度计(上海谱元仪器有限公司),罗氏LightCycler96 RT-qPCR仪(罗氏企业有限公司,瑞士)。总RNA提取试剂盒(北京索莱宝科技有限公司),Thermo Scientific RevertAid第一链cDNA合成试剂盒(赛默飞世尔科技有限公司,美国),SYBR染料qPCR预混液(广州易锦生物技术有限公司),Ighmbp2基因RT-qPCR引物(上海生工生物工程有限公司)。
1.3 HCC小鼠模型的构建及样本的测序和数据分析
首先对小鼠进行随机分5组:SL组、H3L组、H30NL组、H30L组、H30T组,每组小鼠20只。其中80只小鼠在前腋下皮下注射H22细胞后并按期进行组织收集,另外20只小鼠在前腋下皮下注射生理盐水后进行组织收集,构建方法参照本实验室之前的方法[16]。20只小鼠注射生理盐水,收集其肝组织作为SL组。80只小鼠注射H22肝癌细胞系,收集注射3 d的小鼠的肝组织作为H3L组,收集注射30 d未成瘤小鼠的肝组织作为H30NL组,收集注射30 d成瘤小鼠的癌旁组织作为H30L组,收集注射30 d成瘤小鼠的瘤组织,作为H30T组。H30T组作为实验组,其他4组作为对照组。取各样本组织100 mg并各自进行3个生物学重复,使用RNA提取试剂盒提取总RNA,然后由深圳华大基因股份有限公司进行各样本的全转录组测序和蛋白质组学测序。RNA质量检测、逆转录、文库构建及测序数据的处理按常规程序进行,转录组数据分析通过深圳华大基因公司的Dr.Tom多组学交互系统(https://biosys.bgi.com/)完成。RT-qPCR检测Ighmbp2基因的表达,内参基因为GAPDH,引物序列见表1。

表1 RT-qPCR基因引物设计序列
1.4 Ighmbp2基因及其转录本的表达分析
通过华大基因的Dr.Tom多组学交互系统(https://biosys.bgi.com/)收集测序数据中Ighmbp2基因及其转录本的表达量,通过生物信息学方法分析并获得蛋白质组学数据中Ighmbp2蛋白的表达量数据,利用Excel转件自带的分析系统计算Ighmbp2基因和编码蛋白在不同组中表达的平均数和标准差,并利用Origin 8.0绘图。
1.5 Ighmbp2相关基因筛选
通过深圳华大基因的Dr.Tom多组学交互系统构建Ighmbp2基因的蛋白互作网络(PPI)、miRNA-mRNA调控网络(Target)、竞争性ceRNA网络(ceRNA),收集所有基因(包括mRNA、miRNA和lncRNA),筛选出HCC组织和对照组织之间的差异表达基因。差异表达的阈值为:|log2(FPKM比值)|>1(即二者间FPKM的差异倍数大于1)、q<0.05(q为校正的P)、各基因表达的FPKM>10、非编码RNA的FPKM>1。FPKM指外显子模型每千个碱基的转录每百万映射读取的fragments,即每1百万个比对上的reads中比对到外显子的每千碱基上的reads个数。
1.6 Ighmbp2相关基因的功能分析和互作网络图构建
利用华大基因的Dr.Tom多组学交互系统分析数据,构建Ighmbp2相关基因的表达量聚类热图及包含PPI、Target、ceRNA的网络互作图,并对Ighmbp2相关基因进行GO和KEGG富集分析。
1.7 统计学分析
采用SPSS 23.0统计软件分析,计量资料经正态分布和方差齐性检验后,采用LSD检验方法进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Ighmbp2基因在各样本组织中的表达
数据结果显示,相比SL组,H3L组、H30NL组、H30L组和H30T组中Ighmbp2基因表达均上调,其中H30T组中表达最高;组间比较显示,H30L组与SL组、H30L组与H30NL组、H30L组与H3L组、SL组与H30NL组、SL组与H3L组、H30NL组与H3L组间Ighmbp2基因的表达差异均无统计学意义(P>0.05),H30L组与H30T组、H30T组与SL组、H30T组与H30NL组、H30T组与H3L组间Ighmbp2基因的表达差异均有统计学意义(P<0.05,见图1)。
另外,在HCC中存在Ighmbp2基因的5个转录本:NM_009212.2、XM_006531702.1、XR_001782564.1、XR_001782563.1、XR_388253.2(见图2)。它们在H30T组和各对照组中的表达量各不相同,除了NM_009212.2、XR_001782564.1、XR_001782563.1的表达无统计学意义上的差异外,其他2个转录本的表达在H30T组与各对照组之间的差异都具有统计学意义(q<0.05,见表2),而各对照组之间差异无统计学上的意义(q>0.05)。不过,除了Ighmbp2基因的转录本XM_006531702.1在各样本中的表达量都相对较高外,其他4个转录本表达量在各样本中都相对较低。也就是说,Ighmbp2基因在HCC组织中的过表达主要是转录本XM_006531702.1在HCC组织中的过表达。

与H30L组相比,*q<0.05;与SL组、H30NL、H3L组比较,#q<0.05

表2 H30T组和对照组中Ighmbp2基因表达有差异的转录本的表达量比较 (n=3)
2.2 Ighmbp2相关基因的PPI互作网络分析及不同组间样品间表达
对Ighmbp2相关基因进行分析的结果显示,存在大量与Ighmbp2具有互作关系的基因/蛋白,其中与Ighmbp2基因存在密切相关关系的基因/蛋白有43个(见图3)。

mRNA为Ighmbp2相关基因的个数;ppi的深浅为基因与基因之间的关联度
聚类热图显示,这43个基因的表达量在不同样本间及组间的表达与Ighmbp2基因总体上一致,仅小部分基因的表达在不同组间具有一定的差异性(见图4)。
2.3 Ighmbp2相关基因编码蛋白的功能
通过对Ighmbp2相关基因编码蛋白的功能富集分析发现,它主要分布在细胞核、核质、剪接复合体、外显子与外显子连接复合体、细胞质、线粒体等细胞组分中,通过mRNA的加工、RNA剪接、剪接复合体组装、凋亡调控等生物学过程,发挥蛋白结合、类泛素化、poly(A)结合、核酸结合、核苷酸结合等功能,参与mRNA监测、RNA转运、mRNA剪接、JAK-STAT信号通路、细胞凋亡、泛素介导的蛋白水解等途径(见图5)。

图5 Ighmbp2及相关基因的GO和KEGG富集分析
2.4 Ighmbp2相关ceRNA及miRNA
Ighmbp2相关基因的ceRNA、PPI和Target分析结果表明,Ighmbp2相关基因不仅与Ighmbp2密切相关,这些基因之间也有着密切的相关性。在这些相互作用中,既有多个相关基因mRNA或(和)lncRNA与Ighmbp2的miRNA互为ceRNA,也有不同Ighmbp2相关基因编码蛋白之间的相互作用或miRNA与Ighmbp2基因及其他相关基因的靶标关系(见图6)。其中,miR-107-5p、miR-3064-5p和miR-1968-5p在H30T组和各对照组中的表达量各不相同,并且它们在H30T组中的表达显著低于其他各组(见表3)。
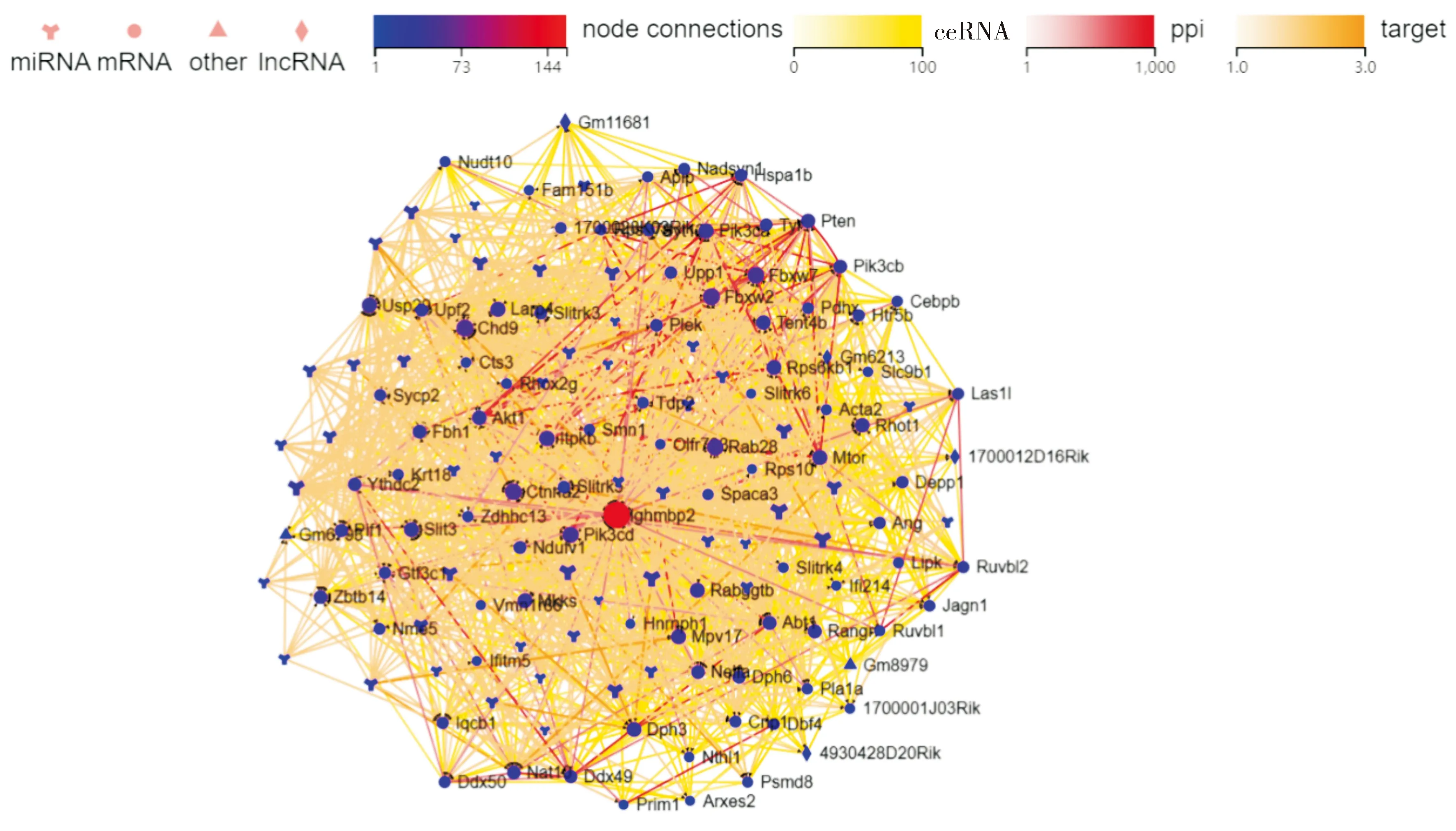
红色圆形为Ighmbp2基因;蓝色图形为Ighmbp2基因的相关分子;黄色、红色、橙色线条分别为有关联的ceRNA、具有互作关系的分子及具有靶向关系的分子

表3 H30T组和对照组Ighmbp2基因相关miRNAs的表达
3 讨论
Ighmbp2是一种能与核糖体和多聚体结合的细胞溶性蛋白质,与DNA复制、前mRNA剪接和转录有关,在mRNA代谢中起作用[17,18]。研究表明,该分子广泛分布于子宫内膜、皮肤、骨髓、肌肉等多种组织和器官中[19,20]。研究结果表明,Ighmbp2基因在HCC组织中过表达而在对照组织中低表达,它的表达量与各阶段对照组织的表达量存在统计学意义上的差异。但是,在注射H22肝癌细胞3 d和30 d均未成瘤小鼠的肝组织中表达差异并不明显,且注射30 d成瘤小鼠的肝组织比注射3 d和30 d未成瘤小鼠中的表达量还要低,这可能与机体对肿瘤异物的免疫有关。肿瘤细胞进入机体后,肿瘤微环境分泌大量细胞因子等相互作用,引起肝脏组织中Ighmbp2高表达;当肿瘤细胞战胜机体免疫快速生长,肝细胞受到极大的损伤,成瘤小鼠癌旁肝脏组织中Ighmbp2表达量减低,肿瘤组织分泌Ighmbp2增多。另外,肿瘤的发展不仅受限于细胞增殖和死亡之间的平衡,还受限于肿瘤抑制基因和凋亡信号致癌之间的平衡。Merino等[21]就曾报道凋亡细胞死亡的缺陷可以促进癌症的发生,并损害恶性细胞对抗癌治疗的反应。BMAL1和CLOCK通过控制Wee1和p21水平促进HCC细胞增殖,从而防止细胞凋亡和细胞周期停滞[22]。当然,这其中不排除Ighmbp2相关基因在其中起着重要作用。
Ighmbp2基因在各样本中都存在5个转录本,且这些转录本在各样本的表达变化趋势大致相同,且在瘤体组织中的表达都高于各对照组织,其中只有转录本XM_006531702.1和XR_388253.2的差异表达具有统计学意义,尤其转录本XM_006531702.1在HCC组织中的表达量远超其他转录本。这说明该基因在HCC中的作用可能主要通过转录本XM_006531702.1起作用,而其他的转录本可能只是从旁协助。
通过深圳华大基因的Dr.Tom多组学交互系统分析,获得了大量与Ighmbp2具有互作关系的基因,表明该基因功能的复杂性和作用机制的多样性。虽然Ighmbp2相关基因种类众多,但仅有143种差异表达于HCC组织和对照组织之间。Ighmbp2相关基因既有mRNA,也有miRNA和lncRNA,其中miR-107-5p、miR-3064-5p和miR-1968-5p这3种miRNA高表达于对照组织而低表达于HCC瘤体组织,而Ighmbp2恰恰相反,其高表达于瘤体组织而低表达于对照组织。由此推测,这3种miRNA可能在对照组织中过表达从而抑制Ighmbp2的表达,而在瘤体组织中低表达导致抑制效应的减弱进而促使Ighmbp2在瘤体组织中上调表达,其中miR-1968-5p在HCC瘤体组织与对照组织中的差异表达也远高于其他2种miRNA,说明作为其靶标分子的Ighmbp2基因的表达受到miR-1968-5p的影响可能远大于受到其他2种miRNA的影响。而各种lncRNA及多种相关基因的mRNA可能通过与Ighmbp2基因的mRNA互为ceRNA而进一步精细调控Ighmbp2基因的表达。如造血干细胞释放的CXCL1通过MIR4435-2HG/miR-506-3p/TGFB1轴加重了HCC细胞的恶性行为[23]。Circ_0007429通过miR/TRIM71/Ago2轴促进细胞增殖、迁移、侵袭和有氧糖酵解,抑制细胞凋亡,从而促进HCC的进展[24]。
Ighmbp2基因功能很多,但主要集中在核功能方面,如RNA聚合酶Ⅱ对转录的调节(GO:0006357)、RNA聚合酶Ⅱ对转录的负调节(GO:0000122)、蛋白质同源寡聚化(GO:0051260)等生物学过程。在翻译和mRNA代谢等细胞过程中发挥作用[25],其突变会导致α-运动神经元的缺失,进而导致肌肉萎缩,尤其是远端肌肉的萎缩[26]。这与该基因所编码的蛋白质存在的细胞部位及其所具有的分子功能相关。Ighmbp2基因编码蛋白存在部位包括细胞质核周区(GO:0048471)、细胞质(GO:0005737)、核糖核蛋白复合体(GO:1990904)、核(GO:0005634)等。其分子功能包括螺旋酶活性(GO:0004386)、ATP结合(GO:0005524)、5′-3′ DNA解旋酶活性(GO:0043139)、核糖体结合(GO:0043022)、富含G的单链DNA结合(GO:1990955)、RNA结合(GO:0003723)、核苷酸结合(GO:0000166)等。
Ighmbp2及其相关基因的功能富集结果还表明,该基因与其相关基因通过互为ceRNA、PPI或作为靶标,可能主要通过解旋酶活性、核苷酸结合、ATP结合和ATP依赖性5′-3′ DNA解旋酶活性等分子功能,在核、核仁、核糖核蛋白复合物和突触后细胞质等亚细胞部位,参与细胞大小的负调节、端粒维持的负调控、中性粒细胞凋亡的正调控等生物学过程,如ABT1与Ighmbp2的结合提高了ATPase和螺旋酶的活性以及Ighmbp2的处理能力[25]。实现Ighmbp2基因对HCC发生、发展和迁移的促进作用。
综上所述,Ighmbp2基因在H30T组中的表达高于其他对照组可能主要通过以下几个方面实现:一是Ighmbp2基因在HCC组织以转录本XM_006531702.1的过表达为主,转录本XR_388253.2过表达为辅,进而参与HCC的病理过程;二是原来在对照组织中高表达而在HCC瘤体组织中低表达的3种miRNA,尤其miR-1968-5p,与lncRNA和mRNA等分子形成ceRNA调控机制在HCC瘤体组织中异常表达,从而抑制了HCC中miR-1968-5p及其他2种miRNA的表达,进而间接促进了Ighmbp2基因的表达;三是Ighmbp2与其相关基因的异常表达从而使细胞内的多个细胞组分出现异常,进而通过影响对细胞大小的负调控,对端粒维持的负调控,对中性粒细胞凋亡的正调控等生物学过程而促进HCC的病理过程。另外,Ighmbp2相关基因还可能在肝癌、细胞衰老、细胞凋亡,甚至mTOR和趋化因子等信号通路中相互协同,共同调控机体的HCC的病理过程,但分析结果中未发现Ighmbp2基因参与这些KEGG通路,表明这些功能虽然也可能参与HCC的病理过程,但可能与Ighmbp2基因过表达及参与调控HCC的作用机制不同。

