miR-4465对喉癌Hep-2细胞增殖、侵袭和迁移的影响及其机制
高天乐,郭志强,孙 青,刘 建,李 俊
(复旦大学附属中山医院青浦分院耳鼻喉科,上海 201700)
喉癌是起源于喉腔黏膜的一种恶性肿瘤,其主要类型是黏膜来源的鳞状细胞癌,大约占95%左右[1]。近年来喉癌的发病率居高不下,呈现上升趋势,而且死亡率占所有癌症死亡率的1%[2]。喉癌的发病风险因素主要受吸烟、酒精、空气污染和病毒性感染的影响,据统计,70%以上的病例和吸烟有关,其次是酒精、空气污染和人乳头状瘤病毒(HPV)的病毒性感染[3],HPV感染多见于不吸烟和不饮酒的年轻人,通常预后良好[4]。喉癌早期可以通过手术或者放射治疗的方式达到临床治愈,晚期需要多模式的联合治疗,而且留喉率低,严重影响了患者的生活质量,预后较差。因此继续寻找喉癌发生发展的相关分子生物学机制,早期诊断对于喉癌的临床治疗具有重要意义。miRNAs是数据基因中最丰富的调控基因,降解靶基因或者抑制其翻译,实现对靶基因水平的转录和调控,从而参与细胞代谢、分化、增殖和凋亡等多种生物学过程[5]。相关研究表明,miR-29a-3p抑制表达能增强喉癌Hep-2细胞增殖,抑制细胞凋亡[6],说明miRNAs可能与喉癌头颈肿瘤的发生和发展有关。第10号染色体同源丢失性磷酸酶张力蛋白(PTEN)基因是具有磷脂酶活性的抑癌基因,PTEN具有抑制肿瘤细胞生长、血管生成、转移和促进凋亡等作用[7],它的甲基化与多种肿瘤的发生关系密切[8]。miR-26家族在肿瘤调控过程中具有重要的作用,属于肿瘤的一致因子[9]。miR-4465属于miR-26家族,相关研究表明,miR-4465可以抑制宫颈癌细胞增殖、迁移及侵袭[10]。基于上述研究结果,本研究拟探讨miR-4465调控PTEN甲基化对喉癌Hep-2细胞增殖、侵袭和迁移的影响,为喉癌的诊治提供新的思路。
1 材料和方法
1.1 实验材料
人喉鳞状细胞癌Hep-2细胞系购买于中科院上海细胞库。喉癌组织及相应的癌旁组织20例,均来自2017年1月至2022年1月本院耳鼻咽喉头颈外科手术治疗的患者,均经喉镜下病理组织活检确诊,属于冻存标本,采用qRT-PCR检测miR-4465和PTEN mRNA的表达。
1.2 主要试剂和仪器
胎牛血清、RPMI 1640培养基购自美国Hyclone公司;胰蛋白酶购自北京鼎国昌盛生物技术有限公司;mimic NC、miR-4465 mimic、pcDNA3.0质粒、pcDNA3.0-PTEN质粒购自上海生工生物工程股份有限公司;PTEN抗体、山羊抗鼠二抗购自北京中杉生物技术公司;RIPA裂解液、BCA蛋白浓度检测试剂盒购自上海碧云天生物技术公司;CCK-8细胞增殖检测试剂盒购自江苏凯基生物有限公司;离心机购自美国Thermo公司;PCR仪购自美国BIO-RAD公司。
1.3 实验方法
1.3.1 细胞培养和分组 将人喉鳞状细胞癌Hep-2细胞系置于含10%胎牛血清的1640完全培养基中,置于37 ℃、5%CO2孵箱中培养。当细胞融合度达到80%以上时进行转染。首先将Hep-2细胞分为空白组(不进行任何转染处理)、对照组(转染mimic NC)、miR-4465 mimic组(转染miR-4465 mimic),采用qRT-PCR检测PTEN mRNA表达,Western blot检测PTEN蛋白表达,CCK-8检测细胞增殖,Transwell实验检测细胞侵袭,细胞划痕愈合实验检测细胞迁移。再将Hep-2细胞分为pcDNA3.0组(转染pcDNA3.0质粒)和pcDNA3.0-PTEN组(转染pcDNA3.0-PTEN质粒),CCK-8检测细胞增殖,Transwell实验检测细胞侵袭,细胞划痕愈合实验检测细胞迁移。按照脂质体Lipofectamine 3000说明书进行严格操作。
1.3.2 实时荧光定量PCR(qRT-PCR)检测miR-4465和PTEN的表达 称取喉癌组织和癌旁组织适量,振荡研磨,采用RNA试剂盒分别抽提组织和细胞中总RNA,逆转录制备好cDNA,放在-20 ℃冰箱中保存。miR-4465引物序列F:5′-ACGCCTCTTGCAGCGCGGCGGCTTCGAA-3′,R:5′-ATTGCTGGGAGAGCGGGACGGTCCGGG-3′;PTEN引物序列F:5′-GCGGGACCCGACTCGCAAACTG-3′,R:5′-AGCCGCTCCAGTGCTGTACA-3′。PCR总反应体系10 μl,上游/下游引物混合物(5 μmol/L)为1 μl,2×SYRB Green Master为5 μl,Q水为3 μl,cDNA为1 μl。PCR反应步骤:95 ℃预变性10 min后,95 ℃变性15 s,60 ℃退火30 s,72 ℃延伸35 s,共进行40个循环,最后72 ℃终末延伸10 min。采用2-ΔΔCt计算miR-4465和PTEN mRNA的相对表达变化。
1.3.3 PTEN甲基化状态的检测 采用QIAamp DNA FFPE组织试剂盒提取喉癌组织和癌旁组织DNA,放于-20 ℃保存,采用亚硫酸氢盐对甲基化与非甲基化的DNA样品修饰作为对照。对喉癌组织和癌旁组织的DNA提纯和亚硫酸氢盐修饰、测序。PTEN基因甲基化引物,正向:5′-GAGCTAGGCCCTCGCCCAC-3′,反向:5′-TCCGAGATCCCGGGGAG-3′;PTEN基因非甲基化引物,正向:5′-ATCGCGCGAGCG-CCTCGCTCAC-3′,反向:5′-GCATATCGATTGCATCCGCTAG-3′;按照试剂盒的使用说明进行扩增。PCR总反应体系:10×PCR Buffer为5 μl,2.5 mmol/L dNTPs为5 μl,10 μmol/L混合基因引物为4 μl,甲基化回收产物为1.5 μl,5 U/μl TaqHS为0.2 μl。PCR扩增反应条件为:95 ℃进行预变性5 min;95 ℃进行变性30 s;72 ℃延伸30 s;操作40次后,温度72 ℃进行末端延伸5 min;保持温度16 ℃,2 min。得到的产物进行焦磷酸法测序,取下结合珠与PCR产物,冷却后,室温进行杂交。在反应仪器中加入底物混合物、脱氧核苷酸和所需要的酶,将96孔板和试剂舱置于焦磷酸测序检测仪中检测,应用Pyro Q-CpG软件对甲基化位点进行检测。本次检测的甲基化率的位点为连续的胞嘧啶和胸腺嘌呤片段,片段中有4个胞嘧啶和胸腺嘌呤,样本中4个胞嘧啶和胸腺嘌呤位点的甲基化率总和即为样本中PTEN基因启动子区甲基化率。
1.3.4 Western blot检测PTEN蛋白的表达 将转染后细胞以3×105个细胞的密度接种到6孔板中,加入RAPI裂解液进行蛋白提取,BCA法蛋白定量,聚丙烯酰胺凝胶(SDS-PAGE)电泳,转膜,封闭,加入含有PTEN一抗(1∶500稀释)的5%脱脂奶粉中,放入4 ℃冰箱过夜,加入辣根过氧化物酶偶联的二抗(浓度1∶5 000),室温孵育1 h后,TBST洗膜3次,GAPDH作为内参,ECL化学发光,将条带扫描至计算机,用Image J软件分析目的蛋白灰度值。
1.3.5 CCK-8检测细胞增殖 细胞转染6 h后,胰酶消化,以5×103个细胞/孔的浓度平铺在96孔板中,设置5个复孔,分别培养24,48,72 h,每个反应孔中加入10 μl的CCK-8溶液,37 ℃下避光培养2 h,在450 nm采用酶标仪测定OD值。
1.3.6 Transwell实验检测细胞侵袭 将转染后细胞置于Transwell小室置于24孔板内,采用无血清的培养基制成单细胞悬液,以2×105个/200 μl的浓度接种于Transwell小室的上室,Transwell小室的上室底部的膜表面涂抹Matrigel胶,下室内加入500 μl含10%FBS的培养基。12 h后取出24孔板,PBS洗涤3次,4%多聚甲醛固定15 min,吉姆萨染色约30 min,显微镜下随机选取3个视野照相并计数。
1.3.7 细胞划痕愈合实验检测细胞迁移 收集生长旺盛的细胞,以2×105个细胞/ml铺至6孔板中,6 h后,以直尺辅助,使用100 μl枪头在每孔内垂直背侧标记线划痕。PBS洗涤3次,按照划痕后0 h和48 h两个时间点进行漂洗细胞并拍照取样测距,计算迁移率,其公式如下:迁移率=(原始划痕距离-48 h后划痕距离)/原始划痕距离×100%。
1.4 统计学处理
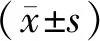
2 结果
2.1 miR-4465和PTEN在喉癌组织和癌旁组织中的差异表达和相关性
喉癌组织中miR-4465和PTEN mRNA的相对表达低于癌旁组织(P<0.001,见图1)。Person相关分析结果显示,癌组织中miR-4465表达和PTEN呈正相关性(r=0.524,P=0.021,见图1)。

与癌旁组织相比,***P<0.001
2.2 喉癌组织PTEN基因甲基化的情况及其与临床病理学的相关性
PTEN在癌组织的甲基化率明显高于癌旁组织(P<0.001);PTEN基因启动子甲基化率与性别、年龄、临床分型无相关性(P>0.05);与肿瘤分期、有无淋巴结转移具有一定的关系(P<0.001,见表1)。

表1 PTEN基因启动子甲基化率与临床病理学的相关性
2.3 miR-4465对PTEN mRNA和蛋白表达的影响
与空白组和对照组相比,miR-4465 mimic组Hep-2细胞中PTEN mRNA相对表达显著升高(P<0.001),PTEN蛋白表达显著升高(P<0.001,见图2)。
2.4 过表达miR-4465对Hep-2细胞增殖的影响
24,48,72 h时,空白组与对照组Hep-2细胞增殖能力比较,差异无统计学意义(P>0.05);miR-4465 mimic组Hep-2细胞增殖能力明显低于对照组(P<0.001,见图3)。
与对照组相比,***P<0.001
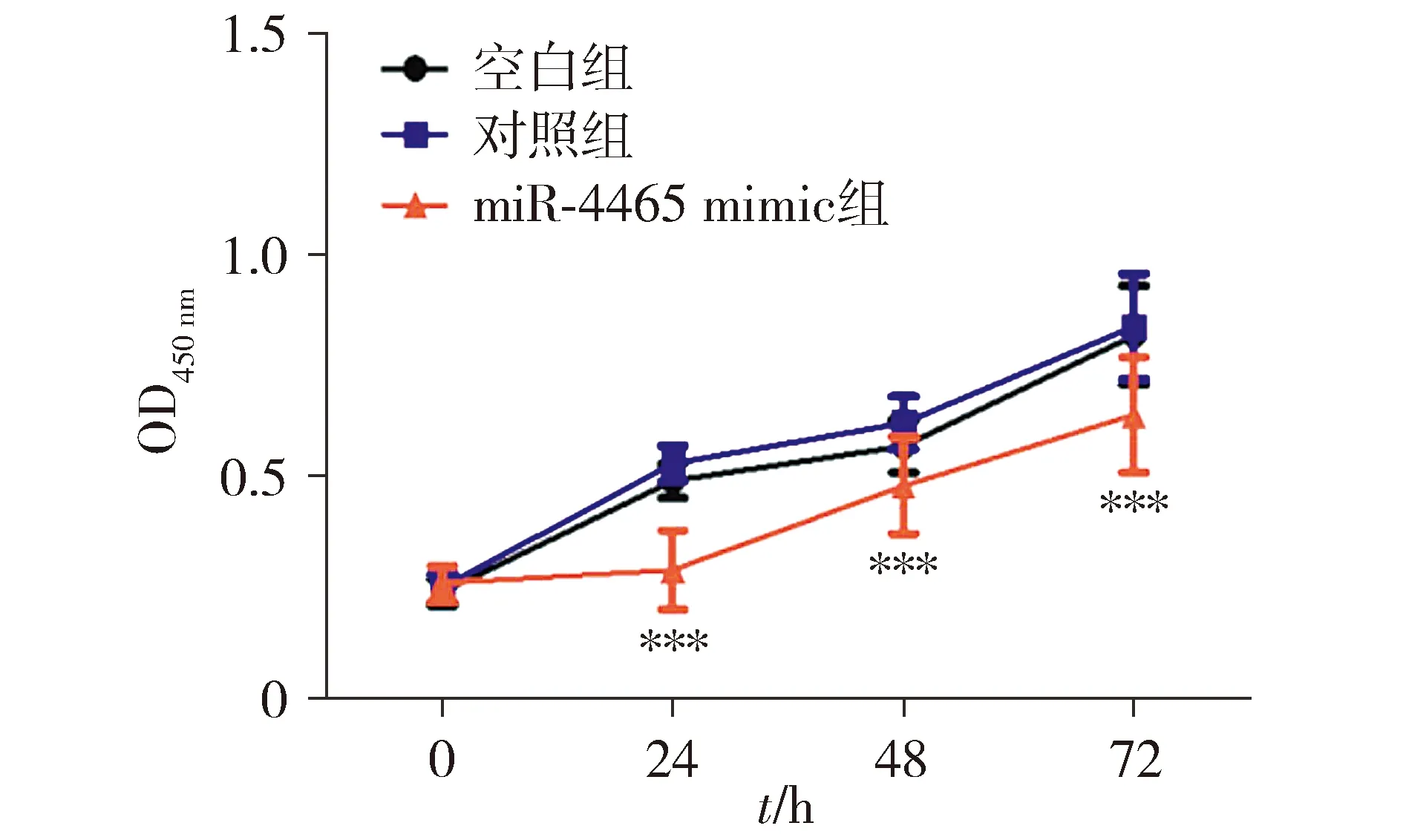
2.5 过表达miR-4465对Hep-2细胞侵袭的影响
空白组与对照组Hep-2细胞侵袭能力相比,差异无统计学意义(P>0.05),miR-4465 mimic组Hep-2细胞侵袭能力明显低于空白组和对照组(P<0.001,见图4)。
与对照组相比,**P<0.001
2.6 过表达miR-4465对Hep-2细胞迁移的影响
与空白组和对照组相比,miR-4465 mimic组Hep-2细胞迁移率明显降低(P<0.001,见图5)。

图5 过表达miR-4465对Hep-2细胞迁移的影响
2.7 PTEN对Hep-2细胞增殖的影响
与pcDNA3.0组相比,pcDNA3.0-PTEN组24,48,72 h的Hep-2细胞增殖能力明显降低(P<0.001,见图6)。

与pcDNA3.0组相比,***P<0.001
2.8 PTEN对Hep-2细胞侵袭的影响
与pcDNA3.0组相比,pcDNA3.0-PTEN组Hep-2细胞侵袭能力明显降低(P<0.001,见图7)。

与pcDNA3.0组相比,***P<0.001
2.9 PTEN对Hep-2细胞迁移的影响
与pcDNA3.0组相比,pcDNA3.0-PTEN组Hep-2细胞迁移能力明显降低(P<0.001,见图8)。

图8 PTEN对Hep-2细胞迁移的影响
3 讨论
miRNA在喉癌中的治疗、监测复发和判断预后方面也有着广阔的应用前景,很多研究表明,miRNA在喉癌的转移、复发上具有一定的预测作用,而且可以通过基因靶向调控喉癌的多耐药性[11]。除此之外,miRNA还可以通过其启动子区的甲基化修饰来促进喉癌的发展。喉癌是喉部的恶性肿瘤。近年来,喉癌的发病率虽然呈现下降趋势,但是喉癌患者的总生存率并未得到提高,而且该病有40%的喉癌患者一旦确诊即为晚期,甚至发生了转移[12],严重影响了患者预后。目前喉癌的发病机制尚不明确,并且在诊断、治疗和预后方面仍缺少有效的生物标志物,所以探索喉癌的分子发病机制,提高喉癌患者的临床疗效,对于喉癌的诊断和潜在的靶向治疗具有重要意义。
研究表明,miRNAs在喉癌的进展中起着关键作用[13]。越来越多的研究表明,miRNAs参与肿瘤的各个过程,包括肿瘤发生、增殖、转移、复发和耐药等[14]。miRNAs可以反映起源组织的病理生理状况,可能成为新的有前途的生物标志物。多项研究报道,miRNAs在喉癌中的表达差异[15],喉癌中miR-133b表达显著下调,过表达miR-133b可以显著抑制喉癌细胞的增殖、影响喉癌细胞周期、促进喉癌细胞凋亡以及抑制喉癌细胞迁移[16]。miR-181d在喉癌组织中的表达量明显升高,下调miR-181d能降低Hep2细胞的增殖、迁移、侵袭能力,并使细胞周期主要阻滞于G1期[17]。但目前关于miR-4465在喉癌的相关报道较少,miR-4465属于miR-26家族的主要成员,miR-26家族主要有4个成员,包括miR-26a、miR-26b、miR-1297和miR-4465,在乳腺癌、肝癌、胃癌在内的多种实体肿瘤都出现低表达,属于抑癌基因[18],所以推测miR-4465在喉癌中也具有类似的作用。本研究首先验证miR-4465和PTEN在喉癌组织和癌旁组织中的表达,结果显示,喉癌组织中miR-4465和PTEN的相对表达低于癌旁组织,提示miR-4465和PTEN在喉癌中均有可能属于抑癌基因。Person相关分析结果显示,miR-4465和PTEN又呈现正相关性。而且与pcDNA3.0组相比,pcDNA3.0-PTEN组Hep-2细胞增殖、侵袭、迁移能力明显降低。DNA甲基化属于表观遗传学的一种,是胞嘧啶转变为5-甲基胞嘧啶的一种反应,DNA被甲基化后将与蛋白结合,DNA高度紧密排列,结果无法生成转录复合物,影响基因表达[19]。DNA甲基化修饰作为基因表达调控的关键方式,在分化、发育和维持组织特异性等许多方向起着关键的作用[20]。DNA甲基化与许多种疾病的发生有关,研究表明,抑制PTEN基因启动子甲基化来减缓慢性粒细胞白血病的进展[21]。PTEN甲基化与多种肿瘤的发生关系密切,已有研究表明,在乳腺癌、结肠癌等肿瘤中均存在PTEN甲基化异常的情况[22]。本研究结果显示,PTEN在癌组织的甲基化率明显高于癌旁组织,而且与肿瘤分期、淋巴结转移具有一定的关系。相关研究表明,组织学分级为Ⅱ-Ⅲ级和淋巴结转移阳性的患者的膀胱组织中PTEN基因启动子甲基化率显著高于组织学分级为0-Ⅰ级和淋巴结转移阴性的患者[23],与本研究结果类似。本研究采用模拟体miR-4465 mimic在Hep-2细胞中成功过表达miR-4465后,明显提高了PTEN mRNA和蛋白表达,抑制了Hep-2细胞的增殖、侵袭和迁移。提示miR-4465可能在喉癌的发生和发展的过程中起着抑癌基因的作用,为临床喉癌的治疗提供新靶点。相关研究表明,miR-4465能够抑制宫颈癌细胞增殖、迁移及侵袭[24];也有研究表明,miR-4465过表达能够降低结肠癌细胞活性,促进细胞凋亡并抑制细胞侵袭[25],与本研究在肿瘤中的验证结果相似。
综上所述,miR-4465在喉癌组织中低表达,过表达miR-4465可以抑制Hep-2细胞的增殖、侵袭和迁移,这可能与PTEN启动子甲基化程度降低,促进PTEN表达有关。本研究为临床上喉癌的治疗提供了有利的依据,但关于miR-4465降低PTEN启动子甲基化水平的相关机制还需要进一步研究。本研究存在一定的局限性,本研究只进行了体外实验研究,下一步将探讨临床样本中的miR-4465的表达,以及对喉癌预后的影响,以期为喉癌的临床治疗提供依据。

