丙泊酚对脂多糖诱导的MHCC97H细胞增殖、凋亡和迁移的影响
秦李杨,刁玉刚,韩晓航
(北部战区总医院麻醉科,沈阳 110011;*通讯作者,E-mail:medicine0426@163.com)
肝癌是一种常见的恶性肿瘤,在我国发病率和死亡率较高,患者通常在晚期才被诊断,治疗选择少,手术及化疗等常规治疗效果不好,预后差[1]。开发新的药物治疗尤为迫切。肝癌跟炎症密切相关,肝癌通常由慢性肝病发展而成,而持续性炎症会促进和加剧肝癌发展[2]。因此,从炎症方向寻找抗肝癌药物有重要意义。脂多糖(LPS)被报道在体外能够诱导细胞炎症性反应,被Toll样受体4识别并激活丝裂原活化蛋白激酶,从而诱导促炎细胞因子基因表达[3],其中炎症因子肿瘤坏死因子-α(TNF-α)在肝损伤的形成和发展过程中起重要作用[4]。丙泊酚是一种短效静脉麻醉药,被报道可抑制卵巢癌细胞侵袭、迁移及血管生成[5],抑制子宫内膜癌细胞系的增殖、促进凋亡[6],说明丙泊酚有抗肿瘤功能;丙泊酚联合七氟醚能够明显改善血清炎症因子表达,保护肝炎患者肝肾功能[7],证明了其抗炎作用,但其抗炎及抗癌的作用机制尚不完全明确。核转录因子-κB(NF-κB)通路是一种对炎症反应至关重要的通路,NF-κB是将慢性炎症与癌症联系起来的最重要分子之一,NF-κB激活诱导多种靶基因转录,如促增殖和抗凋亡基因,参与多种肿瘤增殖、凋亡及迁移等行为[8]。但丙泊酚是否可以通过调控NF-κB信号通路影响LPS诱导的MHCC97H细胞的恶性行为尚未可知。因此,本研究探讨丙泊酚干预对LPS诱导的MHCC97H细胞增殖、凋亡、迁移及炎症因子的影响以及对NF-κB信号通路的调控机制,可为肝癌的治疗提供新研究方向,现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肝癌细胞MHCC97H购自上海赛百慷生物技术股份有限公司。
1.1.2 药品与试剂 丙泊酚(批号:N18GB168406,纯度≥98%)、LPS(批号:J07HS174755,纯度≥98%)均购自上海源叶生物科技有限公司;NF-κB通路抑制剂BAY 11-7082(批号:J07HS173399,纯度≥99%)购自上海源叶生物科技有限公司,酶联免疫吸附试验检测试剂盒(批号:Feb-22)购自睿信生物科技有限公司,活细胞计数(CCK-8)试剂盒(批号:C6205060)购自上海翌圣生物科技有限公司,5-乙炔基-2′脱氧尿嘧啶核苷(EdU)细胞增殖检测试剂盒(批号:042621211123)购自上海碧云天生物技术有限公司,Hoechst 33258染色试剂盒(批号:20220304)购自江苏凯基生物技术股份有限公司,鼠抗人IKKα、IκBα、p-IκBα、NF-κB p65、p-NF-κB p65、细胞周期素D1(Cyclin D1)、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)及β-actin一抗、辣根过氧化物酶标记的山羊抗鼠IgG(二抗)均购自美国CST公司。
1.1.3 仪器 MF52-N型倒置荧光显微镜(广州市明美光电技术有限公司);Multiskan Ascent型酶标仪(美国Thermo公司);H4-20kr型低温高速离心机(湖南可成仪器设备有限公司);DYCZ-24KF型四板垂直蛋白电泳仪(北京六一生物科技有限公司)。
1.2 实验方法
1.2.1 人肝癌MHCC97H细胞培养 在37 ℃,5% CO2培养箱中培养,将人肝癌MHCC97H细胞培养于DMEM培养基(含10%胎牛血清,1%青-链霉素)中,待细胞培养贴壁达80%以上时进行细胞传代,取第4代对数期生长MHCC97H细胞用于实验。
1.2.2 分组及给药 选取第4代对数期生长的肝癌MHCC97H细胞,调整密度至2×105个/ml,接种到96孔板中,每孔100 μl。将肝癌MHCC97H细胞分为对照组、LPS组、低剂量组、中剂量组、高剂量组和中剂量+BAY 11-7082组,对照组细胞不做干预,LPS组加入1 μg/ml LPS,低剂量组、中剂量组、高剂量组以1 μg/ml LPS分别与12.5,25,50 μmol/L丙泊酚同时给药共培养,中剂量+BAY 11-7082组1 μg/ml LPS与25 μmol/L丙泊酚和10 μmol/L NF-κB通路抑制剂BAY 11-7082同时给药共培养,每组设置3个复孔,后置于37 ℃,5% CO2培养箱中培养24 h。
1.2.3 ELISA试剂盒检测MHCC97H细胞培养液中炎症因子TNF-α表达水平 收集各组干预24 h后的细胞上清液,按照TNF-α ELISA试剂盒说明书操作步骤,根据标准曲线计算炎症因子TNF-α表达水平。
1.2.4 CCK-8法测定MHCC97H细胞的活力 选取第4代对数期生长的细胞,调整密度至2×105个/ml,接种到96孔板中,每孔加100 μl,实验重复3次。各组干预24 h后,加入CCK-8溶液10 μl,继续孵育2 h,使用酶标仪测定各组OD值(450 nm)。细胞活力(%)=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%。
1.2.5 EdU法测定MHCC97H细胞的增殖率 取各组干预24 h的细胞,进行EdU处理,去除培养液,加入4%多聚甲醛0.5 ml,固定,洗涤,去除BSA后再洗涤3次;加200 μl Click反应液(现配现用),室温避光孵育30 min,洗涤后去除Click反应液;加入Hoechst孵育10 min;洗涤后装片,拍照,再用ImageJ软件处理图片。EdU阳性染色细胞(红色)占总细胞(蓝色)的百分比表示细胞增殖率。
1.2.6 Hoechst 33258染色法测定MHCC97H细胞凋亡率 干预24 h的细胞,洗涤后加入多聚甲醛固定并洗涤,染色后洗涤,封固后荧光显微镜观察拍照。凋亡细胞的形态特征是细胞核染色不均浓染且所发荧光较强,呈亮蓝色。Image-J图像分析软件计算凋亡细胞数。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.2.7 Transwell小室法测定MHCC97H细胞的迁移能力 将Transwell小室放入24孔板中,在Transwell小室的上室中加细胞悬液(1×106/ml),下室加入600 μl含有10% FBS的培养基,继续培养24 h后,弃上清,棉签擦去小室薄膜上层细胞清洗后固定。晾干后染色并清洗。在显微镜下观察拍照。Image-J图像分析软件计算迁移细胞数。
1.2.8 蛋白免疫印迹法检测MHCC97H细胞中Cyclin D1、Caspase-3和NF-κB通路相关蛋白的表达水平 干预24 h时,收集各组细胞于RIPA液在冰上进行裂解,4 ℃,12 000 r/min离心20 min,取上清进行蛋白变性后,制胶,上样,电泳,转膜,并封闭2 h,然后参照抗体说明书加入一定稀释比例的一抗[IKKα(1∶1 000)、IκBα(1∶1 000)、p-IκBα(1∶1 000)、NF-κB p65(1∶2 000)、p-NF-κB p65(1∶1 000)、Cyclin D1(1∶5 000)、Caspase-3(1∶2 000)及β-actin(1∶5 000)],4 ℃孵育过夜,TBST洗涤3次后加入辣根过氧化物酶标记山羊抗鼠IgG二抗(1∶2 000),孵育2 h,弃去液体并洗涤,最后加显影液,拍照记录。蛋白相对表达量用目的蛋白与内参蛋白(β-actin)比值表示。
1.3 统计学分析
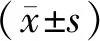
2 结果
2.1 丙泊酚抑制LPS诱导的MHCC97H细胞的炎症
人肝癌MHCC97H细胞的炎症水平用炎症因子TNF-α的表达水平进行评估。ELISA结果显示,与对照组相比,LPS组细胞炎症因子TNF-α表达水平显著升高(P<0.05);与LPS组相比,丙泊酚中、高剂量组细胞炎症因子TNF-α表达水平降低(P<0.05),而低剂量组差异无统计学意义(P>0.05),丙泊酚中、高剂量组之间差异有统计学意义(P<0.05,见图1)。

与对照组相比,*P<0.05;与LPS组相比,#P<0.05
2.2 丙泊酚抑制LPS诱导MHCC97H细胞的活力
CCK-8实验结果显示,干预24 h时,与对照组比较,LPS组细胞活力显著升高(P<0.05);与LPS组相比,丙泊酚中、高剂量组细胞活力降低(P<0.05),而低剂量组差异无统计学意义(P>0.05),丙泊酚中、高剂量组之间差异无统计学意义(P>0.05,见图2)。为避免细胞死亡过多对实验的影响,我们选择对细胞活力差异有统计学意义的较低浓度中剂量组加入NF-κB信号通路抑制剂BAY 11-7082进行NF-κB通路验证实验。
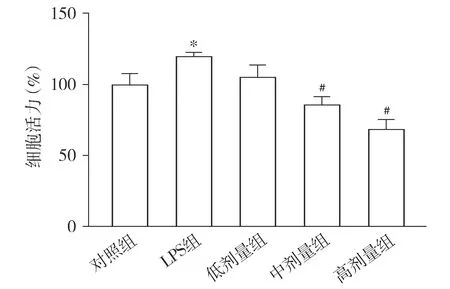
与对照组相比,*P<0.05;与LPS组相比,#P<0.05
2.3 丙泊酚通过抑制NF-κB通路抑制LPS诱导MHCC97H细胞的增殖
EdU结果显示,与对照组相比,LPS组细胞增殖率显著升高(P<0.05);与LPS组相比,中剂量组细胞增殖率显著降低(P<0.05);与中剂量组相比,中剂量+BAY 11-7082组细胞增殖率显著降低(P<0.05,见图3)。
2.4 丙泊酚通过抑制NF-κB通路促进LPS诱导MHCC97H细胞的凋亡
Hoechst 33258实验结果显示,与对照组相比,LPS组细胞凋亡率显著降低(P<0.05);与LPS组相比,中剂量组细胞凋亡率显著升高(P<0.05);与中剂量组相比,中剂量+BAY 11-7082组细胞凋亡率显著升高(P<0.05,见图4)。
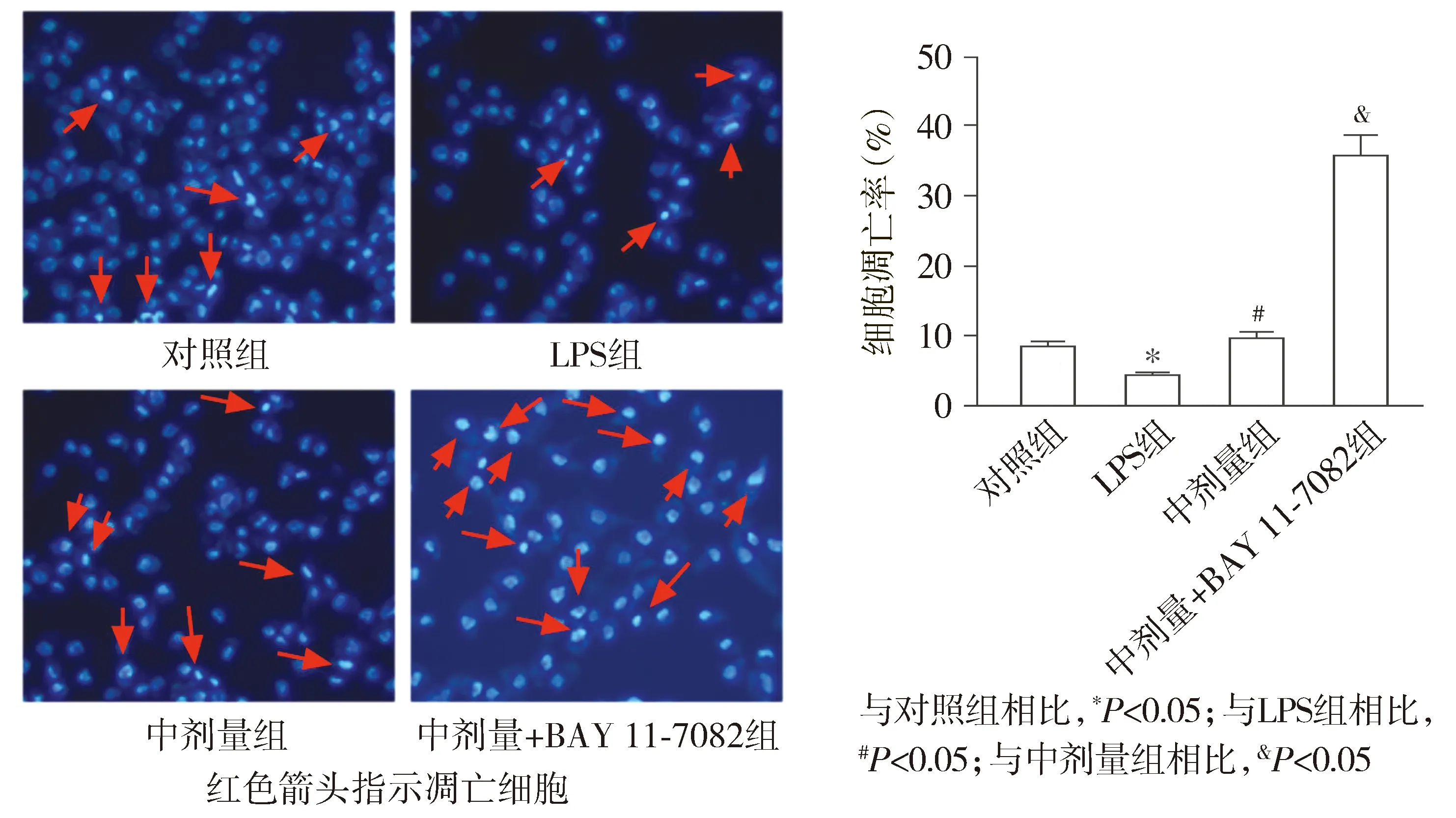
图4 Hoechst染色检测丙泊酚对LPS诱导MHCC97H细胞凋亡的影响 (×20)
2.5 丙泊酚通过抑制NF-κB通路抑制LPS诱导MHCC97H细胞的迁移
Transwell实验结果显示,与对照组相比,LPS组迁移细胞数显著增加(P<0.05);与LPS组相比,中剂量组迁移细胞数显著减少(P<0.05);与中剂量组相比,中剂量+BAY 11-7082组迁移细胞数显著减少(P<0.05,见图5)。
2.6 丙泊酚抑制LPS诱导MHCC97H细胞Cyclin D1蛋白表达并促进Caspase-3蛋白表达
Western blot实验结果显示,与对照组相比,LPS组Cyclin D1蛋白表达水平显著升高,Caspase-3蛋白表达水平显著降低(均P<0.05);与LPS组相比,中剂量组Cyclin D1蛋白表达水平显著降低,而Caspase-3蛋白表达水平显著升高(均P<0.05);与中剂量组相比,中剂量+BAY 11-7082组Cyclin D1蛋白表达水平显著降低,而Caspase-3蛋白表达水平显著升高(P<0.05,见图6)。
2.7 丙泊酚抑制LPS诱导MHCC97H细胞NF-κB通路的活化
Western blot实验结果显示,各组之间IκBα和NF-κB p65蛋白表达水平差异无统计学意义(P>0.05);与对照组相比,LPS组IKKα、p-IκBα和p-NF-κB p65蛋白表达水平显著升高(P<0.05);与LPS组相比,中剂量组IKKα、p-IκBα和p-NF-κB p65蛋白表达水平显著降低(P<0.05);与中剂量组相比,中剂量+BAY 11-7082组IKKα、p-IκBα和p-NF-κB p65蛋白表达水平进一步显著降低(P<0.05,见图7)。
3 讨论
肝癌是全球常见的恶性肿瘤之一,发病率高,往往诊断时已处于肝癌晚期,导致其预后不良,手术和放化疗是最佳选择,但治疗后病情易反复甚至加剧,影响患者生活质量[9],开发新的治疗方法是必要的。炎症已被认为是癌症的标志,并且已知在大多数癌症的发展和进展中发挥重要作用,肝炎通过分泌各种生长因子和细胞因子促进肝癌细胞的增殖和迁移,参与肿瘤进展[10,11]。丙泊酚是一种常用的镇静药物,在癌症手术用于全身麻醉,近来发现丙泊酚在各种癌症发挥抗肿瘤作用[12],但丙泊酚对LPS诱导肝癌细胞的抗肿瘤机制未见报道。所以本实验研究丙泊酚对LPS诱导的肝癌炎性作用、增殖、凋亡及迁移等恶性行为及对NF-κB信号传导的影响,结果发现,LPS诱导后细胞炎症因子TNF-α表达水平和细胞活力显著升高,提示LPS可以诱导MHCC97H细胞的炎症发生,促进细胞的活力。加入丙泊酚处理后,中剂量组和高剂量组TNF-α表达水平和细胞活力显著低于LPS组,说明25 μmol/L和50 μmol/L丙泊酚可抑制LPS诱导的MHCC97H细胞炎症和细胞活力,其中高剂量组细胞活力较低,为避免细胞死亡过多对实验的影响,我们选择对细胞活力差异有统计学意义且浓度较低的中剂量组进行后续的实验,结果表明,LPS组细胞增殖率和迁移数显著高于对照组,细胞凋亡率显著低于对照组,说明LPS促进MHCC97H细胞的增殖和迁移,抑制其凋亡,加入25 μmol/L丙泊酚处理后,显著扭转了这些指标的变化,证明了丙泊酚可以抑制LPS诱导的MHCC97H细胞增殖和迁移能力,促进其凋亡能力,与丙泊酚抑制肝癌细胞的增殖、迁移和侵袭这一报道结果相符[13]。细胞的增殖与凋亡是细胞功能中较为重要的两个指标,Cyclin D1作为细胞增殖标志物,其高表达可促进细胞增殖,调节从G1期到S期的转变[14]。细胞凋亡是一种多种因素诱导程序性细胞死亡的生物学过程,Caspase-3是执行细胞凋亡的关键因子,在细胞凋亡中起重要作用[15]。本研究发现,与对照组相比,LPS诱导促进Cyclin D1蛋白表达,抑制Caspase-3蛋白表达,加入25 μmol/L丙泊酚处理后,显著扭转了LPS诱导Cyclin D1和Caspase-3的表达,提示丙泊酚可能是通过下调Cyclin D1和上调Caspase-3来抑制LPS诱导的MHCC97H细胞增殖,诱导其凋亡。
NF-κB通路是炎症和癌症之间联系的重要通路,NF-κB激活主要发生在癌细胞中,受到多种机制的严格调控,由细菌内毒素(LPS等)和肿瘤坏死因子(如TNF-α)等促炎细胞因子启动,激活后诱导多种靶基因,串扰许多信号通路,参与调控多种癌细胞生长和分化[16]。NF-κB信号通路被报道在肝炎与肝癌的发展中均有重要调节作用,且与细胞的增殖、凋亡相关[17,18]。有研究表明,丙泊酚可以促进心肌细胞NF-κB信号通路的转导[19],丙泊酚通过抑制NF-κB活化抑制LPS诱导的羊膜细胞炎症[20]。但关于丙泊酚对LPS诱导的肝癌细胞中NF-κB信号通路的调控作用未见报道,因此本研究分析了丙泊酚对LPS诱导的MHCC97H细胞中NF-κB通路蛋白的表达水平,结果显示,LPS诱导后细胞IKKα、p-IκBα和p-NF-κB p65蛋白表达显著升高;而加入25 μmol/L丙泊酚处理后,IKKα、p-IκBα和p-NF-κB p65蛋白表达显著降低,提示了丙泊酚可能抑制了NF-κB通路的信号转导。在中剂量组中加入NF-κB信号通路抑制剂BAY 11-7082进行NF-κB通路验证实验,发现与中剂量组相比,加入抑制剂后,中剂量+BAY 11-7082组细胞增殖率、迁移数及Cyclin D1、IKKα、p-IκBα和p-NF-κB p65蛋白表达显著降低,细胞凋亡率和Caspase-3蛋白表达显著升高,提示丙泊酚可能是通过抑制NF-κB信号通路以及上调Caspase-3和下调Cyclin D1来抑制细胞的增殖和迁移,诱导其凋亡的。
综上所述,丙泊酚可能通过抑制NF-κB信号通路抑制LPS诱导的人肝癌MHCC97H细胞增殖和迁移,降低炎症,诱导凋亡。本实验证明丙泊酚可抑制LPS诱导的肝癌细胞的炎性作用及恶性行为,对治疗肝癌有重要意义,但本文仅在体外实验进行研究,还需进一步在动物模型上分析丙泊酚的抗癌作用,为肝癌的治疗提供更为全面的理论支持。

