白花蛇舌草对人舌鳞癌细胞Tca83 的作用机制研究
戚路晗,杜英南,陈靖怡,崔臻,常怀广,张蕾
舌癌是人类最常见的口腔癌之一,大部分恶性程度较高,浸润性强,生长快。因舌体的运动频繁和血运丰富,舌癌经常在早期就发生颈淋巴结转移,而且转移率比较高,亦可发生远处转移[1]。对于舌癌的临床治疗,目前国内和国外学者普遍认为,以手术为主,辅以放化疗的综合治疗是降低患者死亡率,减少术后复发,提高人生存率的最有效途径。
为了减少化疗副作用,中草药越来越多的应用于肿瘤术后。白花蛇舌草是茜草科的草本植物,是目前国内研究较多的抗癌中草药,从白花蛇舌草中已经提取分离出环蒽醌类、烯醚萜类、多糖类和黄酮类等数十种化合物,具有抗肿瘤、抗氧化、抗炎以及增强机体的非特异性免疫功能作用[2]。有研究报道白花蛇舌草能够诱导多种肿瘤细胞的凋亡[3]。因此,在胃癌、肝癌、直肠癌及子宫颈癌等治疗中被广泛应用。目前,白花蛇舌草对于口腔鳞癌,尤其是舌鳞癌的研究很少,本实验通过测定细胞存活率、凋亡率及抗凋亡蛋白Bcl-2 表达来研究白花蛇舌草提取物能否促进人口腔舌鳞癌细胞Tca83 的凋亡,现报道如下。
1 资料与方法
1.1 细胞株及药品 人舌鳞癌Tca83 细胞株购于北京大学口腔医院科研中心。白花蛇舌草购于同仁堂大药房,制备方法:取白花蛇舌草干品100 g,研磨成粉末状,用1 000 ml 水浸泡1 h,加热沸腾2 h,过滤后离心2 次,取上清液浓缩至100 ml,过滤除菌后获1.0 g/ml 白花蛇舌草提取液[4]。
1.2 主要试剂和仪器 RPMI-1640 培养基、胎牛血清、胰蛋白酶、噻唑蓝(MTT)、PI、RNA 酶等购于生工生物工程公司;台盼蓝、Bcl-2 免疫组化试剂盒和DEPC等购于新正好生物工程有限公司。罗氏Cedex HiRes高清图像细胞分析系统:艾力特生命科学有限公司;流式细胞仪:贝克曼库尔特公司产科研型。
1.3 Tca83 细胞株的传代培养及实验分组 取汇集成片、良好状态呈对数生长期的Tca83 细胞,经胰蛋白酶(0.5%)和EDTA(0.2%)混合消化,形成细胞悬液。以1×105/ml 的浓度接种在培养瓶中,放置在37℃、5%CO2的培育箱中培养。本实验分为5组,对照组是等量标准培养基,每天更换。实验组为白花蛇舌草提取液配制成100、300、600 和900g/ml 4 个浓度组。接种24h后,在进入对数生长期的Tca83 细胞中开始加药,并且每隔24 小时换液以维持药物浓度。每个浓度组的药物分别作用Tca83 细胞24、48 和72h后,测定白花蛇舌草提取液对细胞作用的时效关系。
1.4 光学显微镜下观察Tca83 细胞形态学变化 用胰蛋白酶消化Tca83 细胞,接种于96 孔培养板中,每孔浓度均为1×104/ml,在24 h 细胞完全贴壁后,分别加入各浓度药物,在倒置显微镜下观察不同时间Tca83 细胞生长的状况及形态变化。
1.5 免疫组化检测Tca83 细胞Bcl-2 蛋白表达 按上述分组加入不同浓度药物,分别于24、48、72 h 后制作细胞爬片,经酶消化液37 ℃消化,经山羊抗兔IgG、SABC 处理后,DAB 染色,空白对照组以PBS代替一抗。
1.6 MTT 法检测Tca83 细胞存活率 将Tca83 细胞接种在96 孔培养板中,每个实验组分别设6 个复孔,按照分组设计加4 种浓度的白花蛇舌草提取液,其中第一孔为空白对照,分别培养24、48、72 h;然后加入MTT 溶液,测定各孔吸光度值,重复3 次取平均值。细胞存活率计算方法:存活率=(实验组OD/对照组平均OD)×100%。
1.7 FCM 检测Tca83 细胞凋亡率和细胞周期变化将生长状态良好的Tca83 细胞经胰酶消化后制成细胞悬液,接种培养24 h 后,加入不同浓度的提取液,作用24、48 和72h后收集细胞,制备单细胞悬液,进行流式细胞仪检测。
1.8 统计方法 采用SPSS 13.5统计软件进行分析,计量资料以均数±标准差表示,采用方差分析,P <0.05 表示差异有统计学意义。
2 结果
2.1 Tca83 细胞形态学变化 光学显微镜下,正常的Tca83 细胞为多角形,伸展好,细胞质呈均匀状态,细胞核大,核仁清楚,透明度较好,见封三彩图1。经过白花蛇舌草提取液处理的Tca83 细胞形态会发生改变,细胞皱缩,不能附壁,大部分漂浮在培养液中。随着实验组药物作用时间的延长和药物浓度的加大,能够见细胞脱落,坏死细胞和细胞碎片漂浮在培养液中,见封三彩图2。

2.2 Bcl-2 蛋白免疫组化表达 对照组细胞的细胞膜及细胞质中均匀分布有深棕黄色和棕红色的细颗粒,这是Bcl-2 表达,有此特征的为阳性细胞。900g/ml 浓度组作用24 h 的细胞,其胞质内无染色,不见Bcl-2表达,为阴性结果。
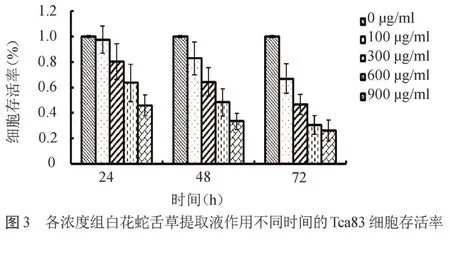
2.3 细胞存活率 各浓度组分别作用细胞24、48 和72 h,结果显示细胞存活率与白花蛇舌草提取物的浓度呈反比关系,且具有比较明显的剂量依赖性;除去空白对照组,细胞存活率与提取物的作用时间呈反比关系,具有明显时间依赖性,见封三彩图3。
2.4 流式细胞仪分析结果
2.4.1 细胞凋亡率 相同药物作用时间,随着药物浓度增加,细胞凋亡率也在增加。72 h 后,药物浓度虽然增加到900g/ml,但细胞凋亡率不再增加。900g/ml组72 h 的细胞凋亡率与48 h 相比没有增加,而其它实验组的细胞凋亡率随药物作用时间延长而增加,显示出明显时间依赖性,见封三彩图4。
2.4.2 细胞周期分布分析 低浓度提取液组在短时间内主要将细胞抑制在G0/G1 期,而随着药物浓度和(或)作用时间的增加,抑制在G2/M 期的细胞增多,见表1。

表1 白花蛇舌草提取液作用后Tca83 细胞周期分布情况 %
3 讨论
舌癌是口腔常见恶性肿瘤之一,术后药物治疗可有效降低复发率和死亡率。传统西药化疗副作用大,而中药有多靶点效应,毒副作用小,被广泛应用于临床。白花蛇舌草作为一种应用广泛的抗癌中草药,通过抑制肿瘤血管及淋巴管生成,诱导肿瘤细胞凋亡,调控肿瘤信号通路等方式作用于癌细胞[4]。孙超等[5]研究证实中药白花蛇舌草有效成分为2-羟基-3-甲基蒽醌(HMA),其对人肝癌Hep G2 细胞有体外抑制及诱导凋亡作用。汪增秀等[6]研究同样证实白花蛇舌草能抑制肝癌HepG2 细胞增殖,诱导凋亡。现代药理学研究表明,白花蛇舌草与半枝莲联合应用,对肝癌、结肠癌、乳腺癌及直肠癌等有显著的抑制作用,发现其仍是通过抑制癌细胞增殖,促进癌细胞凋亡[7]。因此,本实验侧重研究白花蛇舌草对舌癌细胞的促凋亡和抑制增殖作用。
Bcl-2 家族蛋白在细胞凋亡的内源性途径中发挥至关重要的作用,Bcl-2 家族蛋白失调会导致细胞凋亡失衡,促进肿瘤形成[8]。因此,抗凋亡因子Bcl-2蛋白的表达是检测细胞凋亡的重要手段之一,Bcl-2蛋白与一系列凋亡调节因子互相作用,抑制细胞凋亡。本实验中,白花蛇舌草作用后,Tca83 细胞的Bcl-2 表达水平下调,因此Bcl-2 抑制舌癌细胞凋亡的作用减弱。虽然本实验的设计并没有检测白花蛇舌草与Bcl-2 作用的具体机制,但从Bcl-2 与白花蛇舌草浓度和作用时间的负相关性,间接证实白花蛇舌草能够促进舌癌细胞凋亡。
细胞周期是细胞复制的过程,分为G1(DNA 合成前期)、S(DNA 合成期)、G2(DNA 合成后期)、M(分裂期)四个时期,细胞周期与细胞增殖紧密相关。本实验结果显示白花蛇舌草将Tca83 细胞抑制在G0/G1 期或G2/M 期,从而抑制癌细胞分裂增殖,促进凋亡。本研究还发现低浓度药物在短时间内主要将细胞抑制在G0/G1 期;而高浓度和(或)作用时间的增加,主要将癌细胞抑制在G2/M 期。不过将癌细胞分别抑制在这两个不同时期对临床治疗是否有实际意义,有待进一步研究。
本研究还发现经过白花蛇舌草作用的舌癌细胞存活率降低,并且随着药物浓度增加和/或药物作用时间增加,舌癌细胞的存活率也在降低。同时也发现药物浓度和作用时间增加到一定程度,舌癌细胞的存活率不再降低,这提示白花蛇舌草对舌癌的作用有一定的剂量和时间临界点,在临床应用时要找到合适的剂量和使用时间。
利益冲突 所有作者声明无利益冲突
作者贡献声明 戚路晗:实验操作、论文撰写;杜英南、陈靖怡、崔臻:数据整理、统计学分析;常怀广、张蕾:研究指导、论文修改、经费支持

