QuEChERS-GC-MS/MS 法快速测定地黄中12 种多环芳烃
何成军,王 颖,钟慈平,付 苓,杨超林,余晓琴*,吴平谷
(1.四川省食品检验研究院,四川 成都 611731; 2.四川省药品检验研究院,四川 成都 611731; 3.浙江省疾病预防控制中心,浙江 杭州 310051)
多环芳烃(PAHs) 是指分子中含有2 个或2 个以上苯环以稠环形式排列的碳氢化合物,主要来源于矿物燃料及其他有机物的不完全燃烧和对废弃物的不妥当处置,是最早发现的具有致癌、致畸、致突变的环境污染物之一[1-3]。按照结构和理化性质可以分为有2~3 个苯环的低分子量多环芳烃和有4~7 个苯环的高分子量多环芳烃2 类。随着人类对化石产品开采和使用量的增加,大量的多环芳烃被排入环境中。多环芳烃污染问题也日益受到关注,已经被世界许多国家列为有机污染物的研究重点[4]。目前多环芳烃的检测方法主要有液相色谱法(HPLC)[5-6]、气相色谱法(GC)[7-8]、超高效液相色谱-串联质谱法 (UPLC-MS/MS)[9-10]、气相色谱-串联质谱法(GC-MS/MS)[11-13]等。
生地黄为玄参科植物地黄RehmanniaglutinosaLibosch.的干燥块根,始载于《神农本草经》,是著名的“四大怀药” 之一,至今已有千年的应用历史。将生地黄酒制后再干燥即得熟地黄。生地黄和熟地黄均具有滋阴补肾的功效,凡阴虚血虚肾虚者食之,颇有益处,被大量应用于临床[14-16]。关于多环芳烃污染的研究大多集中在环境和食品等方面。近年来,对于中药中多环芳烃的污染也开始受到关注。但是目前关于地黄中多环芳烃检测的研究很少,特别是能够快速、准确的同时测定药材中多种多环芳烃的检测技术更是鲜见报道。
QuEChERS 技术是一种适用于复杂基质样品中多种污染物分析的样品制备和净化技术,由于具有回收率高、测定结果准确、高通量以及低溶剂使用量等优点,使得该方法自发布以来,获得了美国分析化学家协会、欧盟等多个国际机构认可,广泛应用于食品及药品中各种污染物的分析研究[17]。
为研究地黄中多环芳烃的风险暴露情况,本文以地黄为基质,采用QuEChERS 前处理,联合气相色谱-串联质谱法(GC-MS/MS) 对地黄中12 种多环芳烃残留量进行了含量测定研究,以期为地黄的用药安全风险提供一定的借鉴与参考。
1 材料
1.1 仪器 TQ 8050 气相色谱-质谱联用仪(日本Shimadzu公司); DB-5 MS 石英毛细管柱(30 m×0.25 mm,0.25 μm) (美国Agilent 公司); Heraeus Multifuge X3R 高速冷冻台式离心机、Barnstead Gen Pure 超纯水机(美国Thermo Fisher Scientific 公司); XSE 105 分析天平 (瑞士Mettler Toledo 公司); T25 Digital 涡旋振荡仪(德国IKA 公司);KQ-500DE 超声仪(江苏昆山超声仪器公司); N1 全自动氮吹浓缩仪(上海屹尧仪器科技发展有限公司)。
1.2 试剂与药物 12 种多环芳烃(PAHs) 混合标准品溶液(单个化合物质量浓度均为100 μg/mL,批号S059017),包括菲(Phe)、蒽(Ant)、荧蒽(Flua)、芘(Pyr)、苯并[a] 蒽(BaA)、艹屈 (Chr)、苯并[b] 荧蒽(BbF)、苯并[k] 荧蒽(BkF)、苯并[a] 芘(BaP)、茚并[1,2,3-c,d] 芘(IcdP)、二苯并[a,h] 蒽(DahA)、苯并[g,h,i] 芘(BghiP)、苯并 [a] 芘-d12(BaP-d12)内标溶液(100 μg/mL,批号S043605),均购于天津阿尔塔科技有限公司;N-丙基乙二胺(PSA) 吸附剂、十八烷基键合硅胶吸附剂(C18粉末)、C18小柱、中性氧化铝小柱(天津博纳艾杰尔科技公司); MIPs、Florisil 小柱(上海安谱试验科技股份有限公司); HLB 小柱(美国Waters 公司)。二氯甲烷、丙酮、乙腈、正己烷均为色谱纯(美国Thermo Fisher Scientific 公司); 水为超纯水。
地黄(16 批生地黄、7 批熟地黄) 均购自当地专业药材市场或饮片公司,经四川省药品检验研究院黎跃成主任中药师鉴定为玄参科植物地黄RehmanniaglutinosaLibosch.的干燥块根或炮制品,具体见表1。

表1 样品信息
2 方法与结果
2.1 GC-MS/MS 分析条件
2.1.1 色谱 DB-5MS 石英毛细管柱 (30 m×0.25 mm,0.25 μm); 进样口温度300 ℃; 程序升温 (70 ℃保持2 min,以35 ℃/min 升至160 ℃,以10 ℃/min 升至260 ℃,以6 ℃/min 升至310 ℃,保持5 min); 载气高纯氦气; 体积流量1.5 mL/min; 进样量1 μL; 不分流进样。
2.1.2 质谱 电子轰击离子源(EI 源); 电子能量70 eV;离子源温度230 ℃; 传输线温度310 ℃; 溶剂延迟时间8 min; 多反应监测(MRM) 模式。总离子流图见图1,质谱参数见表2。

图1 12 种多环芳烃总离子流图

表2 12 种多环芳烃质谱参数
2.2 溶液制备
2.2.1 对照品溶液 精密吸取混合标准品溶液1 mL,置于25 mL 量瓶中,正己烷定容至刻度,摇匀,正己烷稀释至400 ng/mL,即得。
2.2.2 内标溶液 精密吸取苯并[a] 芘-d12对照品1 mL至25 mL 量瓶中,正己烷定容至刻度,摇匀,正己烷稀释至400 ng/mL,即得。
2.2.3 供试品溶液
2.2.3.1 提取 取地黄适量,在-40 ℃下冷冻12 h 后迅速粉碎,精密称取1 g 至50 mL 离心管中,准确加入内标溶液100 μL,混匀后再准确加入10 mL 正己烷,超声提取10 min,涡旋振荡提取10 min,8 000 r/min 离心5 min,收集上清液,残渣再加入10 mL 正己烷重复提取1 次,合并2次上清液,混匀,即得。
2.2.3.2 净化 精密吸取“2.2.3.1” 项下提取液5 mL 至10 mL 离心管中,加入C18、PSA 粉末各100 mg,涡旋60 s后8 000 r/min 离心5 min,吸取所有上清液,40 ℃氮吹至近干,准确加入正己烷1.0 mL,涡旋混匀,0.22 μm 微孔滤膜过滤,进样分析。另外,多环芳烃属于环境污染物,故在实验过程中应随样品前处理过程制备全试剂空白溶液,以判断实验环境是否对检测造成影响。
2.3 方法学考察
2.3.1 提取方式选择 以加入25 μg/kg 多环芳烃的地黄样品为研究对象,分别考察了10 mL 二氯甲烷、正己烷、乙腈、丙酮提取2 次对提取效率的影响。结果表二氯甲烷、正己烷、乙腈、丙酮提取效率依次降低。但二氯甲烷提取溶液中色素等杂质较多,容易对仪器造成污染并影响检测结果; 乙腈、丙酮的极性相对较大,不利于多环芳烃的溶出,综合对比了提取溶液颜色、对目标物的提取效率,本实验选择正己烷。另外,还考察了美国环境保护署推荐的PAHs 提取方法——超声提取对样品中多环芳烃提取效率的影响,发现超声提取能够加快多环芳烃的溶出,提高了提取效率,最终确定提取方式为10 mL 正己烷超声提取2 次。
2.3.2 净化方式选择 本实验以5 mL 离心后的25 μg/kg加标样品提取液为对象,考察了中性氧化铝小柱、HLB 小柱、C18小柱、高分子印迹多环芳烃专用萃取柱(MIPs)、Florisil 小柱、QuEChERS 粉末的净化效果,结果见图2。由此可知,C18小柱、中性氧化铝小柱对多环芳烃类化合物基本没有保留能力; HLB 小柱、MIPs 小柱、Florisil 小柱、QuEChERS 粉末净化均具有较高的回收率,但HLB、MIPs小柱对样品溶液中色素的净化效果不理想,溶液颜色仍较深,不利于仪器进样分析,而Florisil 小柱、QuEChERS 粉末回收率均较高,尤其是除去色素能力强,可满足实验要求。考虑到前处理操作方便性和实验成本,最终确定净化方式为QuEChERS 粉末。

图2 不同净化方式对多环芳烃净化效果的影响
2.3.3 QuEChERS 粉末填料量优化 目前,常用的QuEChERS 净化剂有N-丙基乙二胺(PSA)、十八烷基键合硅胶吸附剂 (C18)、石墨化碳黑 (GCB)、无水硫酸镁等[18],其中GCB 表面具有正六元环结构,对平面分子有极强的亲和力,能有效除去样品溶液中的色素和甾醇类干扰物,但由于多环芳烃结构中含有平面芳香环,会被GCB 不同程度的吸附,导致各目标化合物的加样回收率较低; PSA能够吸附样品溶液中的糖类、脂肪酸、有机酸、脂类以及某些色素等; C18的主要作用是除去长链脂类化合物、甾醇及其他非极性杂质等; 无水硫酸镁能吸附样品溶液中多余的水分。由于地黄含水量较小,本实验比较了不同用量PSA、C18粉末对样品溶液的净化效果,发现两者对色素均有明显的净化效果,随着其用量增加溶液颜色逐渐变浅,但进一步增加后会引入菲的二次污染,考虑到进化和二次污染之间的平衡,最终确定QuEChERS 净化剂为PSA、C18粉末各100 mg。另外,对于含水量较大的药材,可以考虑加入硫酸镁来验证其除水、净化效果。
2.3.4 线性关系考察及精密度、加样回收率试验 考虑到基质效应对目标化合物准确定量的影响,本实验采用基质匹配系列校正曲线,内标法定量。空白样品按“2.2.3” 项下方法处理,得到空白供试品,加入25 μL 内标溶液和适量多环芳烃标准工作液,依次稀释至1、2、4、8、16、32 ng/mL,在“2.1” 项条件下进样测定。以多环芳烃质量浓度为横坐标(X),峰面积为纵坐标(Y) 进行回归,并以信噪比为3 时的浓度为检测限,为10 时的浓度为定量限,结果见表3,可知各多环芳烃在各自范围内线性关系良好。
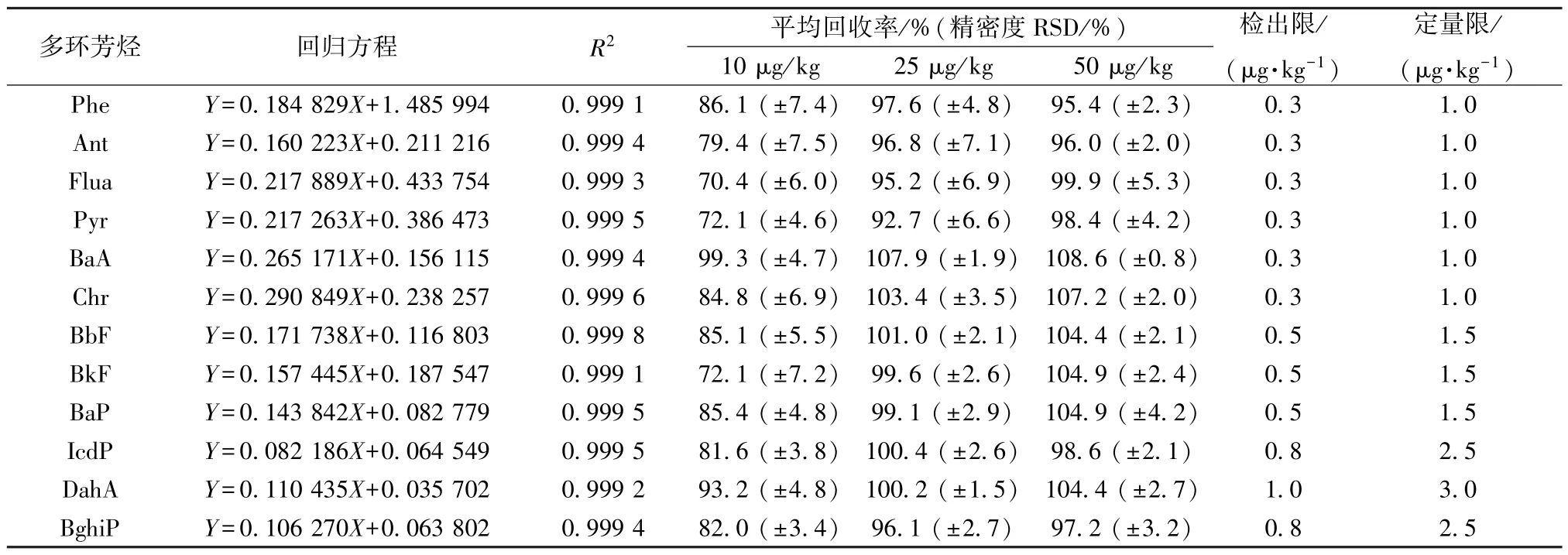
表3 各多环芳烃线性关系及精密度、加样回收率试验结果(n=6)
2.3.5 加样回收率、精密度试验 在空白样品中加入不同体积的对照品溶液,分别得到低、中、高3 个水平的加标样品,每个水平6 份,按“2.2.3” 项下方法制备供试品溶液,在“2.1” 项条件下进样测定,结果见表3。
2.3.6 样品含量测定 取16 批生地黄(DH01~DH16)、7批熟地黄(DH17 ~DH23),按“2.2.3” 项下方法制备供试品溶液,在“2.1” 项条件下进样测定,计算含量,结果见表4。由此可知,所有批次样品中均检出多环芳烃,含量范围32.7~3 628.9 μg/kg; 10 批样品(2 批熟地黄、8 批生地黄) 检出全部多环芳烃,占总数的43.5%,最高达3 628.9 μg/kg (DH04); 菲、苯并 [a] 蒽、艹屈及苯并[b] 荧蒽在所有批次样品中的检出率为100%,最高达1 119.5 μg/kg,值得引起重视; 苯并[a] 芘在多环芳烃中毒性最大,也是备受关注的典型代表[19],该成分在所有批次样品中的检出率为61.5%,含量为12.8~85.2 μg/kg。

表4 各多环芳烃含量测定结果(μg/kg)
3 讨论
目前,对中药外源性污染物的关注重点主要集中在重金属[20-21]、二氧化硫残留[22]、真菌毒素污染[23-25]和农药残留[26-28]等方面。虽然现在关于中药材中多环芳烃的报道较少,但是从上述结果和部分报道[12-13,29-30]中可以看出,部分中药材中多环芳烃污染的情况值得引起重视。尤其是这类化合物又具有典型的致癌、致畸、致突变的特性,这可能会成为影响中药材用药安全性的另一风险问题。
中药材中多环芳烃的污染可能来源于多种因素、多个环节,产业链中的相关环节都应该树立防止多环芳烃污染的意识。在种植环节,植物可能会吸收土壤和环境中的PAHs,并在生长过程中富集,种植基地可以选择建立在远离污染的地方。药材在干燥、加工和运输的过程中也应该注重环境卫生,尽量避免药材被废气或废烟污染。药材在烘烤、高温炮制等过程中,脂肪、蛋白质和碳水化合物可能会发生热裂解反应,再经过环化和聚合反应形成PAHs,应该通过科学合理的方法优化炮制工艺。同时,相关部门应该引起重视,加大对这方面的投入,利用现代科学技术和方法找出这类化合物的污染途径或代谢途径。
目前我国尚无相关法律和标准规定中药材中多环芳烃的残留限量,相关监管部门应该关注此类物质在中药材中的污染情况,在科学的方法指导下制定合理的防范措施,以保证中药的安全用药。
4 结论
本研究通过对提取试剂、提取方式和净化方式进行选择和优化,建立了能够快速、准确地测定地黄中12 种多环芳烃的方法。采用正己烷超声提取2 次,使用QuEChERS(含PSA、C18各100 mg) 粉末净化,氮吹浓缩后,结合基质匹配标准曲线,内标法定量。与文献[12-13,29-30] 中采用固相萃取、皂化后液液萃取等前处理方法相比,本方法具有前处理操作简单、对色素净化效果好、成本低廉、定量准确等优点,适合在短时间内完成大批量的样品分析,能够满足实验室中大批量检测的需要。可以考虑在此方法的基础上,开展其他药材样品的普查,掌握基础本底数据,明确污染程度,为进一步制定相应的限量标准提供实质性的数据支撑。

