亚甲基四氢叶酸还原酶和纤溶酶原激活剂抑制物基因多态性与老年慢性肾衰竭的相关性
胡常晖,侯儆,张建军,靳志雄
张家口市第一医院,a 肾内科,b 急诊科,c 普外一科,张家口 075000
慢性肾衰竭(CRF)是临床常见疾病,其患病率在老年群体中日益增加,据统计,全球每年约有数百万人死于肾脏疾病,老年CRF是其中的主要原因之一[1]。肾衰竭是一种临床综合征,通常由各种病因引起,如糖尿病、高血压、肾小球肾炎等,然而研究表明遗传因素也可能对肾衰竭的发生和进展起到重要作用[2]。亚甲基四氢叶酸还原酶(MTHFR)基因和纤溶酶原激活剂抑制物-1(PAI-1)基因是与老年CRF密切相关的两个基因,其中MTHFR基因参与了体内甲基代谢途径,与血液中同型半胱氨酸水平的调节有关,PAI-1基因编码血管内皮细胞产生的重要调节因子,与血管内皮功能紊乱相关,因此这些基因的变异可能导致肾脏结构和功能的改变,从而增加肾衰竭的风险[3]。本研究旨在探究MTHFR和PAI-1基因多态性与老年CRF的关系,以期为肾衰竭的预防和治疗提供更有效的基因遗传学方面的指导。
1 对象与方法
1.1 研究对象 纳入2020年2月至2023年2月张家口市第一医院收治的100例老年CRF患者作为CRF组,同时期老年健康体检者100例作为对照组。纳入标准:①符合CRF诊断标准[4](CRF组);②尿毒症期CKD 3~4期(CRF组);③肾功能正常(对照组);④年龄≥60岁;⑤能够配合完成研究相关的检查;⑥签署知情同意书并同意参与本研究。排除标准:①肝功能异常者;合并心肌梗死、心力衰竭、严重心律失常等心血管疾病者;②合并活动性感染或正在接受抗生素治疗者;③急性肾损伤或肾功能不稳定者;④妊娠或哺乳期女性;⑤存在其他严重疾病或严重生活不能自理的情况。CRF组男53例,女47例;年龄62~78(68.3±3.5)岁;对照组男51例,女49例;年龄60~80(67.9±5.1)岁。2组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究方案经张家口市第一医院医学伦理委员会批准。
1.2 检测方法
1.2.1 样本采集 采集所有受试者外周血样本及CRF组患者尿液样本。
1.2.2 MTHFR基因型测定 采用酚/氯仿法提取血液样本白细胞基因组DNA。根据选取的MTHFR、PAI-1等位基因,参照NCBI GeneBank进行引物序列设计,MTHFR C677T正向引物1:5-GAGAAGGTGTCTGCGGGAGC-3,正向引物2:5-GGAGAAGGTGTCTGCGGGAGT-3,反向引物:5-CGCTGTGCAAGTTCTGGACC-3,引物均由上海invitrogen生物工程公司合成。以基因组DNA为模板,进行聚合酶链式反应(PCR)扩增,扩增产物通过限制性内切酶切割,获得目标DNA片段,通过凝胶电泳分析,得到不同基因型对应的DNA条带图谱,根据分析结果确定MTHFR C677T基因型。
1.2.3 PAI-1基因型测定 采用酚/氯仿法提取血液样本白细胞基因组DNA。根据选取的MTHFR、PAI-1等位基因,参照NCBI GeneBank进行引物序列设计,PAI-1基因4G/5G多态性片段引物设计:正向4G引物P1:5′-GTCTGGACACGTGGGGA-3′;上游正向5G引物P2:5′-GTCTGGACACGTGGGGG-3′;上游远端对照正向引物P3:5′-AAGCTTTTACCAT-GGTAACCCCTGGT-3′;共同的下游反向引物P4:5′-TGCAGCCAGCCACGT-GATTGTCTAG-3′,引物均由上海invitrogen生物工程公司合成。以基因组DNA为模板,进行PCR扩增,扩增产物通过限制性内切酶切割,获得目标DNA片段,通过凝胶电泳分析,得到不同基因型对应的DNA条带图谱,根据分析结果确定PAI-1基因型。
1.2.4 肾功能指标 采用酶法测定血尿素氮、肌酐水平,肾小球滤过率采用改良MDRD公式进行估算。
1.3 观察指标 比较CRF组与对照组MTHFR、PAI-1基因型与基因频率分布情况,以及CRF患者MTHFR、PAI-1不同基因型血尿素氮、血肌酐、肾小球滤过率水平,采用logistics回归分析MTHFR、PAI-1基因多态性与CRF患病的关系。

2 结果
2.1 2组MTHFR、PAI-1基因型与基因频率分布比较 CRF组MTHFR C677T基因位点TT基因型、T等位基因占比及PAI-1 4G/5G基因位点4G/4G基因型、4G等位基因占比均高于对照组(P<0.05)。见表1、表2。
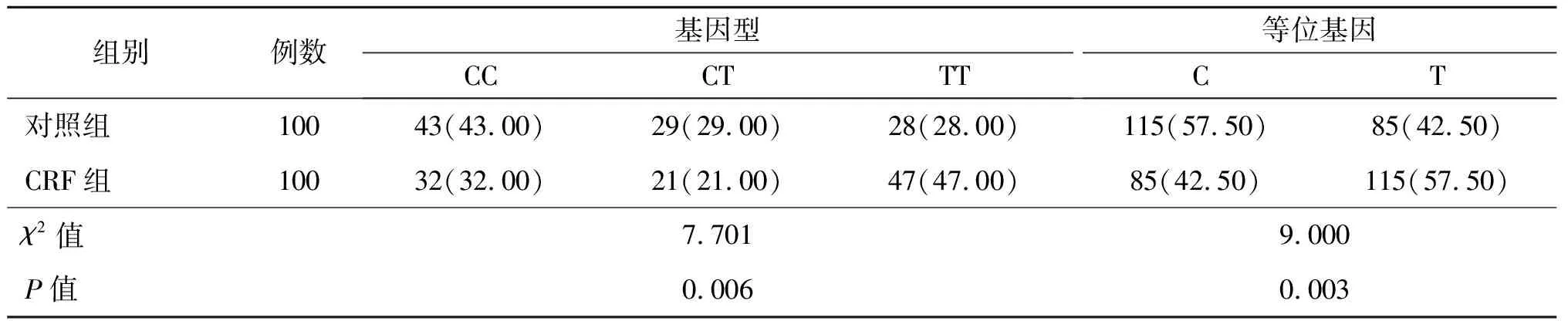
表1 2组MTHFR C677T基因型、基因频率分布比较[例(%)]

表2 2组PAI-1 4G/5G基因型分布[例(%)]
2.2 CRF患者MTHFR不同基因型尿素氮、肌酐水平比较 MTHFR基因TT基因型的CRF患者尿素氮、肌酐水平均高于其他基因型(P<0.05),肾小球滤过率低于其他基因型(P<0.05)。见表3。

表3 CRF患者MTHFR C677T各基因型尿素氮、肌酐水平比较
2.3 CRF患者PAI-1不同基因型尿素氮、肌酐水平比较 PAI-1基因4G/4G基因型的CRF患者尿素氮、肌酐水平均高于其他基因型(P<0.05),肾小球滤过率低于其他基因型(P<0.05)。见表4。

表4 CRF患者PAI-1各基因型尿素氮、肌酐水平比较
2.4 MTHFR、PAI-1基因多态性与CRF的关系分析 多因素logistics回归分析显示,MTHFR TT基因型、PAI-1 4G/4G基因型均为老年人CRF患病的独立危险因素(P<0.05)。见表5。
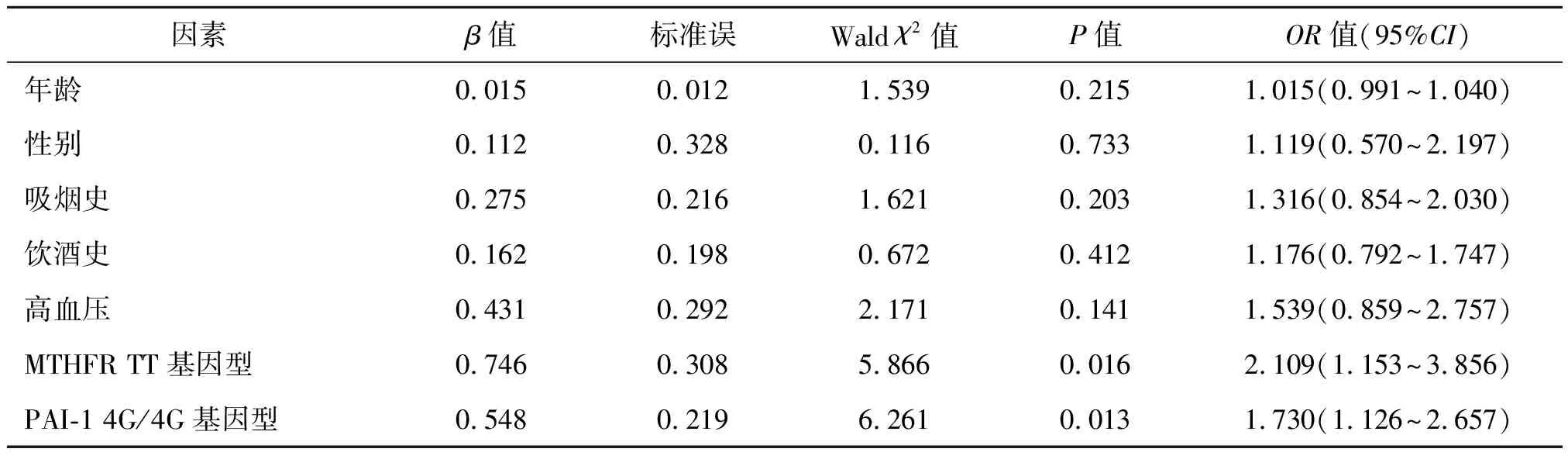
表5 MTHFR、PAI-1基因多态性与CRF的关系分析
3 讨论
老年人群中CRF的发病率较高,且其病因复杂,涉及多种遗传和环境因素,研究基因多态性与老年CRF的相关性,可帮助我们深入了解该疾病的病因和发病机制,为CRF的诊断、预防和个体化治疗提供科学依据和理论支持。
本研究探讨了MTHFR和PAI-1基因多态性与老年CRF的相关性,结果表明,MTHFR C677T位点的TT基因型和PAI-1 4G/5G位点的4G/4G基因型与老年CRF的发生相关。MTHFR是一种关键的酶,在维持同型半胱氨酸代谢过程中发挥着重要的作用,其功能是在脱氧核苷酸合成途径中将5,10-甲基四氢叶酸还原为5-甲基四氢叶酸,从而供给单碳基团进行DNA和RNA的合成[5]。MTHFR酶活性与C677T位点的基因型密切相关,其中TT基因型与酶活性的降低有关,因此会导致同型半胱氨酸水平升高。同型半胱氨酸是一种代谢产物,已经被证实与多种疾病的发生相关,可经肾脏过滤并通过肾小管排出体外,而高水平的同型半胱氨酸可导致肾小管细胞的损伤和肾小球的硬化,尤其是老年人体内肾小球硬化和肾小管细胞损伤的累积,可进一步增加CRF的发生风险[6-8]。本研究结果显示,MTHFR C677T位点的TT基因型与老年CRF的发生相关,且MTHFR基因TT基因型的CRF患者尿素氮、肌酐水平均高于其他基因型,肾小球滤过率低于其他基因型,与既往研究[9]一致,表明MTHFR C677T位点TT基因型的个体更容易患上CRF,且该基因型的CRF患者肾功能损害更明显。
PAI-1是一种重要的凝血系统调节因子,其主要作用是抑制纤溶酶原激活物的活性,从而影响纤溶酶原系统[10]。PAI-1的基因位点4G/5G位于PAI-1基因的启动区域,已被证实与PAI-1的表达水平相关,4G等位基因的存在导致PAI-1表达水平增加,从而引起凝血和纤溶平衡失调[11-12]。本研究结果显示,CRF组PAI-1 4G/5G基因位点4G/4G基因型和4G等位基因占比高于对照组,与既往相关研究[13]一致。本研究还发现PAI-1基因4G/4G基因型的CRF患者尿素氮、肌酐水平均高于其他基因型,肾小球滤过率低于其他基因型,这一结果表明PAI-1基因的多态性可能与老年CRF患者的肾功能损伤程度有关。分析其原因,PAI-1可能通过影响血管内皮功能、血液凝固和纤溶系统的平衡,从而影响肾小球的血流动力学,导致肾小球硬化,进一步影响肾小管功能。PAI-1基因4G/4G基因型在其他疾病中也被发现是一个危险因素,包括心脏病、糖尿病、高血压等,这些疾病与肾脏疾病有许多共同的危险因素,如高胆固醇、肥胖等,这些共同的危险因素也可能与老年CRF的发生有关[14]。此外,MTHFR、PAI-1的遗传多态性可能与环境因素相互作用,共同导致CRF的发生,因此进一步研究MTHFR、PAI-1基因多态性与老年CRF的关系,还需考虑环境因素和其他危险因素的影响[15]。本研究通过进一步的多因素logistics回归分析显示,MTHFR TT基因型、PAI-1 4G/4G基因型均为老年人CRF患病的独立危险因素,提示MTHFR TT基因型和PAI-1 4G/4G基因型均为老年人CRF患病的独立危险因素,且他们的影响可能是相互独立的。
综上所述,MTHFR C677T位点的TT基因型及PAI-1 4G/5G位点的4G/4G基因型均与老年CRF的发生相关,在老年人中应重视这两种基因遗传多态性对肾功能的影响。通过研究MTHFR和PAI-1基因多态性与老年CRF的相关性,还可以为其他相关疾病的研究提供参考和借鉴,许多疾病如心血管疾病、糖尿病、下肢深静脉血栓等,也涉及基因多态性的影响。对基因与疾病之间关系的研究,不仅对于CRF的治疗和预防具有重要的意义,也有助于推动其他疾病的研究和治疗进程以及遗传学和基因医学领域的发展。

