男性2型糖尿病患者周围神经病变影响因素分析*
于易真 吴 敏 黄淑玉,#
2019年国际糖尿病联盟公布的流行病学调查数据显示,我国糖尿病患者高达1.15亿-1.30亿[1]。而糖尿病周围神经病变(Diabetic Peripheral Neuropathy,DPN)是糖尿病最常见的慢性并发症之一[2]。目前研究显示DPN是多因素共同作用的结果,其主要发病机制为炎症、氧化应激、代谢紊乱、微循环障碍等。本研究旨在探讨男性2型糖尿病(T2DM)患者DPN的影响因素,以期更早进行临床干预,减少或延缓DPN的发生及发展。
1 资料与方法
1.1 一般资料
选取武汉科技大学附属孝感医院内分泌科2022-01-2023-03住院的男性T2DM患者145例。根据《中国2型糖尿病防治指南2020年版》中DPN的诊断标准[3],将患者分为DPN组(n=75)和非DPN组(n=70)。DPN确诊标准:(1)有临床症状表现(感觉异常、有疼痛或麻木等),温度觉、踝反射、压力觉、针刺痛觉、震动觉5项检查中任1项异常;(2)无临床症状表现(感觉异常、有疼痛或麻木等),上述5 项检查中任2项异常。
1.2 患者纳入和排除标准:
纳入标准:(1)明确的糖尿病病史(符合中国2型糖尿病防治指南2020年版中T2DM的诊断标准);(2)诊断糖尿病时或之后出现的神经病变;(3)临床症状和体征与DPN的表现相符。排除标准:当出现病情进展迅速、病变部位不对称、运动功能损伤明显重于感觉功能损伤等情况时,需排除其它病因引起的神经病变,如颈腰椎病变(神经根压迫、椎管狭窄、颈腰椎退行性变)、脑梗死、格林-巴利综合征;严重动静脉血管性病变(静脉栓塞、淋巴管炎)等;维生素 B12 缺乏;感染(如人类免疫缺陷病毒等);由药物(尤其是化疗药物)引起的神经毒性作用以及肾功能不全引起的代谢毒物对神经的损伤。
1.3 研究方法
1.3.1 一般资料收集:收集患者年龄、糖尿病病程,对患者的腰围、小腿围、身高、体重3次测量并取平均值,计算小腿围与腰围的比值、身体质量指数(BMI)。
1.3.2 血液学指标检测:采集患者空腹肘静脉血,用电阻抗法检测中性粒细胞数(N)、流式细胞计数法检测淋巴细胞数(L)、荧光免疫学检测血红蛋白。用酶标法检测空腹血糖(FBG)、总胆固醇(CHOL)、超敏C反应蛋白(hs-CRP)。用电化学发光法检测胰岛素(INS),用高效液相层析法检测糖化血红蛋白(HbA1c)。用速率法检测血尿酸(UA)。用电极法检测血钾(K+)、血钙(Ca2+)。计算HOMA-β[(20×空腹胰岛素)/(FBG-3.5)]、HOMA-IR(空腹胰岛素×FBG/22.5)、中性粒细胞/淋巴细胞比值(NLR)。
1.3.3 踝肱指数(ABI)和人体成分分析:使用Handydop-Pro四肢多普勒血管检查仪器检测患者ABI;使用韩国InBody S10人体成分分析仪测量患者的下肢肌肉质量(Lower Extremity Muscle Mass,LEMM)、全身肌肉质量(Whole Body Muscle Mass,WBMM)、骨骼肌含量(Skeletal Muscle Content,SMC)、体脂百分比(Body Fat Percentage,BFP)、内脏脂肪面积(VFA),计算下肢肌肉质量与全身肌肉质量(L/W)的比值。
1.4 统计学处理

2 结 果
2.1 两组一般资料比较
DPN组年龄、糖尿病病程高于非DPN组(P<0.05);小腿围低于非DPN组(P<0.05);两组患者腰围、小腿围/腰围、身高、体重、BMI差异无统计学意义(P>0.05),见表1。
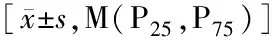
表1 两组患者一般资料比较
2.2 两组实验室指标比较
DPN组HbA1c、N、NLR、hs-CRP高于非DPN组(P<0.05或P<0.01);两组FBG、INS、HOMA-β、HOMA-IR、UA、CHOL、HGB、L、K+、Ca2+水平差异无统计学意义(P>0.05),见表2。
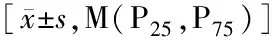
表2 两组实验室指标比较
2.3 两组患者四肢多普勒血管检查、体成分检查指标比较
DPN组VFA高于非DPN组(P<0.05);LEMM低于非DPN组(P<0.05);两组患者ABI、L/W、SMC、BFP、WBMM差异无统计学意义(P>0.05)。见表3。
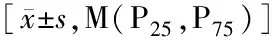
表3 两组四肢多普勒血管检查、体成分检查指标比较
2.4 影响男性T2DM患者DPN的单因素Logistic回归分析
单因素Logistic回归分析显示患者的年龄、糖尿病病程、小腿围、LEMM、VFA、HbA1c、N、NLR、hs-CRP等因素与DPN的发病密切相关。见表4。
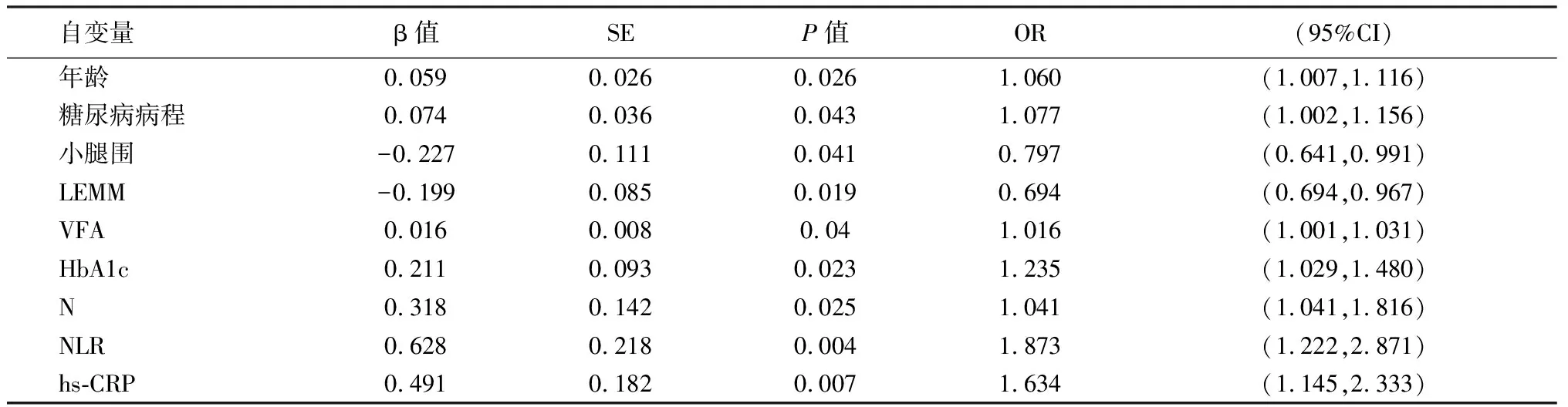
表4 影响男性T2DM患者DPN的单因素回归分析
2.5 影响男性T2DM患者DPN的多因素Logistic回归分析
多因素Logistic回归分析显示糖尿病病程、VFA、HbA1c、NLR、hs-CRP是男性T2DM患者DPN的独立危险因素,而LEMM是其保护性因素。见表5。

表5 影响男性T2DM患者DPN的多因素回归分析
3 讨 论
目前DPN的发病机制复杂,多因素共同作用促进DPN的发生发展,包括血管内皮损伤、微血管功能障碍、氧化应激、血糖和血脂代谢紊乱等。
本研究结果显示,DPN组平均年龄高于非DPN组(P<0.05),其可能机制是随着糖尿病患者年龄的增长,患者血管硬化加重,周围神经微循环障碍,神经细胞营养供应不足,促进DPN的发生发展。DPN组病程长于非DPN组,而HbA1c高于非DPN组(P<0.05)。
横断面和前瞻性流行病学研究已证实HbA1c是 DPN强大且独立的预测因子[4]。HbA1c水平升高易引发DPN[5]。长期高血糖状态时机体会产生过量的ROS,导致机体氧化与抗氧化机制失衡,直接损害神经细胞DNA、蛋白质及脂质,阻碍轴索的运输和信号转移,加重神经细胞的损伤;ROS也可促进晚期糖基化终产物(AGEs)的产生,而AGEs可促进大量炎症因子分泌,引起微血管增厚、内皮功能障碍和血小板聚集,致使血流动力学障碍,导致神经组织缺血、缺氧; AGEs也可直接沉积在神经组织中破坏细胞功能,从而引发神经病变。
近年来,越来越多的证据表明肥胖程度与T2DM患者合并 DPN的风险有关[6-8]。内脏脂肪面积增加和异位脂肪沉积导致游离脂肪酸过量升高,长链脂肪酸和炎性介质可直接损伤感觉神经元、感觉神经末梢和血液神经屏障[9],引起炎症和氧化应激,损伤神经细胞,导致神经不可逆的损伤。本研究发现BMI、腰围与DPN无明显相关性,而内脏脂肪面积是DPN的独立危险因素,可能是因为BMI和腰围都不能完全客观反映体内内脏脂肪含量。
本研究亦显示下肢肌肉质量减少是DPN的独立危险因素。DPN的发生与肌肉功能障碍直接相关,骨骼肌是处理葡萄糖的主要组织,下肢肌肉质量的下降会导致代谢异常,加重神经细胞的损伤。
魏微等[10]研究报道,hs-CRP 等炎性因子与 DPN 发生密切相关,炎性因子可直接引起神经轴索的损伤;也有研究表明NLR 所代表的低度慢性炎症在DPN病理生理过程中发挥重要作用[11]。本研究显示,NLR和hs-CRP水平与DPN 的发生密切相关,且NLR是DPN 发生的独立危险因素。NLR升高可释放或促进ROS及多种细胞因子的产生,引起神经内膜营养血管内皮损伤,损伤的内皮细胞又可进一步诱导中性粒细胞趋化、聚集,同时导致血小板粘附、活化,使毛细血管内血栓形成,致使神经内膜血管微循环障碍,神经组织缺血、缺氧,神经纤维变性、坏死。
综上所述,糖尿病病程、HbA1c、LEMM、VFA、NLR、hs-CRP是T2DM患者DPN的影响因素,临床上需重视早期有效降糖治疗,以减少长期血糖控制不佳所致DPN发生。减少内脏脂肪、增加下肢肌肉质量可减少及延缓DPN发生发展。有效抗氧化、减轻炎症反应等治疗方式有助于DPN的缓解。

