NGALR干扰抑制NF-κB通路阻断肾小管细胞上皮间充质转分化*
方 珣 曾星若 陈隆敏 申江曼 董 艳 吕会娟 高 思 陈文莉
高糖饮食会诱发2型糖尿病和肥胖,严重威胁人类健康。研究表明,在喂食高糖饮食的果蝇幼虫体内,免疫反应途径和先天免疫系统均被异常激活,大量细胞凋亡[1]。狼疮性肾炎是一种潜在具有致命危害的自身免疫性疾病,目前的治疗方法无效且通常具有较严重的毒副作用。自1974年世界卫生组织引入狼疮性肾炎组织学分类以来,对狼疮性肾炎的关注都集中在肾小球损伤上,而临床实验在近三分之一的儿童狼疮性肾炎患者中发现了肾小管间质异常[2]。狼疮性肾炎与小管间质病变的关系比与肾小球纤维化的关系更密切,肾小管和肾间质是其主要靶点[3]。肾脏中成熟的肾小管上皮细胞上皮-间充质转化(EMT)是肾脏中高糖毒性的特征表现,且与肾小管间质纤维化进展高度相关[4]。肾小管上皮细胞可通过EMT转为肌成纤维细胞,进入间质合成细胞外基质,阻断EMT可以抑制疾病进程[5,6]。
中性粒细胞明胶酶相关脂钙蛋白(NGAL)及其受体(NGALR)均属于糖蛋白的一种,并且与先天免疫系统有关,已在多种疾病中检测到表达水平增加,被证明可预测肾小管损伤[7]。本课题组前期研究结果显示,狼疮性肾炎患者血液、尿液及肾组织中NGAL和NGALR表达水平显著高于非狼疮性肾炎患者,且尿液中NGALR的表达水平与狼疮活动指标呈正相关[8]。有研究证实NGAL可调控NF-κB/Snail信号通路上游启动子[9],而激活的NF-κB通路能诱导肾脏炎症反应直接参与狼疮性肾炎和EMT[10,11]。但NGALR对NF-κB的调控作用及在狼疮性肾炎中的作用机制尚不明确。因此,本研究通过构建NGALR干扰表达载体,结合NF-κB通路抑制剂,基于高糖诱导的肾小管上皮细胞评估NGALR通过调控NF-κB通路对细胞EMT的影响。探讨NGALR在肾小管上皮细胞表型变化中的作用,进一步阐明NGAL/NGALR对狼疮性肾炎发生发展的影响。
1 材料与方法
1.1 主要试剂和仪器
HK-2人肾近曲小管细胞购自上海赛百慷公司,Defined K-SFM来源于iCell(iCell-h096-001b),胰蛋白酶、CCK8、D-无水葡萄糖、D-甘露醇、Tween-20、RIPA(强)组织细胞快速裂解液、BCA蛋白浓度测定试剂盒购自北京索莱宝公司(T1350、CA1210、G8150、M8140、T8220-100、R0010、PC0020),Trizol购自美国Ambion公司(15596026),Opti-MEM购自美国Gibco公司(31985-062),Lipofectamine®RNAiMAX购自美国Invitrogen公司(13778030),AnnexinV-PE/7 AAD凋亡检测试剂盒购自美国BD公司(559763),PVDF转移膜、化学发光试剂购于美国Millipore公司(IPVH00010、WBKLS0500),抗体NGALR、NGAL、p65、p-p65、Snail、Vimentin、GAPDH、Goat anti-Rabbit IgG购于武汉Bioswamp公司(ab124506、PAB33190、PAB33379、ab76302、PAB33921、PAB30841、PAB36269、SAB43714)。倒置荧光显微镜来源于Leica公司(DMIL LED),酶标仪来源于杭州奥盛公司(AMR-100),流式细胞仪来源于艾森仪器公司(NovoCyte),荧光定量PCR仪来源于Bio-Rad公司(CFX-Connect 96),全自动化学发光分析仪来源于上海天能仪器公司(Tanon-5200)。
1.2 筛选高糖诱导细胞模型构建的最佳时间
HK-2用Defined K-SFM培养基置于37℃、5%CO2培养箱中培养,倒置显微镜下观察细胞汇合度达到80%以上时,胰蛋白酶消化细胞,1∶2传代培养。取处于对数生长期的HK-2细胞,加入30mM葡萄糖分别诱导12、24、36、48h,同时设置正常对照组(5.5mM葡萄糖)和渗透压组(5.5mM葡萄糖+24.5mM甘露醇),置于37℃、5%CO2培养箱中培养,通过细胞活性和NGALR mRNA表达确定高糖诱导最佳作用时间。与正常对照组和渗透压组相比,高糖诱导后各组细胞增殖能力下降(P<0.01),NGALR mRNA相对表达水平上升(P<0.01)。同时,高糖诱导构建模型的时间为24h时,细胞增殖能力趋于稳定,NGALR mRNA相对表达水平最高。因此,高糖诱导细胞模型构建最佳作用时间为24h。见表1。

表1 高糖诱导对HK-2细胞增殖活力和NGALR mRNA表达的影响
1.3 NGALR干扰慢病毒载体构建及细胞转染
基于人NGALR(Gene ID:51310)的序列,构建干扰载体(si-NGALR 1、si-NGALR 2、si-NGALR 3)及si-NGALR NC(阴性对照)。过程为:基因合成目的基因序列,进行引物退火获取基因片段。通过酶切反应体系进行载体线性化,将双酶切后的目的基因片段与载体进行连接,转化后进行阳性克隆鉴定。将酶切和PCR检测均为阳性的克隆子进行测序,将测序结果与NCBI中基因比对,检测是否成功构建。待接种于6 孔板的HK-2细胞融合度为90%时,取质粒和Lipofectamine®RNAiMAX分别稀释于Opti-MEM中,两者混匀后室温孵育20min。将复合物加到含有细胞和新鲜培养基的培养板孔中,置于37℃、5% CO2培养箱中,转染4h后换新鲜培养基,继续培养48h。以未转染的HK-2细胞为对照,qRT-PCR检测NGALR mRNA表达。转染NGALR干扰慢病毒载体后,对照组、si-NGALR 1、si-NGALR 2、si-NGALR 3和阴性对照组细胞中NGALR mRNA的表达分别为(1.00±0.09)、(0.58±0.02)、(0.34±0.01)、(0.41±0.01)和(1.03±0.02)。与对照组相比,转染si-NGALR质粒的细胞NGALR的mRNA相对表达均显著下降(F=181.30,P<0.01),阴性对照组无显著变化(P>0.05),即细胞成功转染si-NGALR质粒。
1.4 细胞分组
实验细胞分为6 组:对照组,正常培养的HK-2细胞;模型组,用30mM高浓度的葡萄糖诱导HK-2细胞24h;si-NGALR NC组,先用30mM高浓度的葡萄糖诱导HK-2细胞24h,然后再转染si-NGALR NC质粒4h;si-NGALR组,先用30mM高浓度的葡萄糖诱导HK-2细胞24h,然后再转染NGALR干扰质粒4h;PDTC组,先用30mM高浓度的葡萄糖诱导HK-2细胞24h,然后加入100μM NF-κB抑制剂PDTC[12];PDTC+si-NGALR组,先用30mM高浓度的葡萄糖诱导HK-2细胞24h,然后加入100 μM NF-κB抑制剂PDTC作用1h,再转染NGALR干扰质粒4h。各组细胞均在37℃、5% CO2的环境中培养。
1.5 CCK8法检测细胞增殖活力
取各组HK-2细胞悬液,调整浓度为3×103个细胞/孔接种于96 孔板,每孔100μl,在37℃、5%CO2培养箱中培养过夜,使细胞贴壁。用5.5mM葡萄糖和24.5mM甘露醇处理细胞,继续培养48h,向每孔加入10μl CCK8溶液,培养4h。于450nm波长处检测各组细胞吸光度值代表细胞增殖活力。
1.6 qRT-PCR检测NGALR mRNA表达
收集各组待测HK-2细胞,胰蛋白酶消化,离心后加入Trizol提取细胞总RNA,反转录获取cDNA,将制备好的cDNA进行PCR扩增。扩增体系为95℃ 3min,95℃ 5s,56℃ 10s,72℃ 25s共40个循环。以GAPDH为内参,采用2-ΔΔCt计算NGALR mRNA相对表达水平。PCR引物由武汉天一华煜基因科技有限公司合成,序列为:NGALR-F:GTG AAG CGG CAG ATT GAG;NGALR-R:CAG GCT GGT AGC AGT GGC;GAPDH-F:GGG AAA CTG TGG CGT GAT;GAPDH-R:GAG TGG GTG TCG CTG TTG A。
1.7 流式细胞仪检测细胞凋亡
收集各组待测HK-2细胞,取1×106个培养基重悬的细胞,离心重悬于200μl PBS,加入5μl AnnexinV-PE和5μl 7-AAD,轻轻混匀,4℃避光孵育30min,加入300μl PBS,进行流式检测。
1.8 Western Blot检测p-NF-κB p65、NF-κB p65、Snail、NGALR、NGAL和Vimentin蛋白表达
收集各组待测HK-2细胞,每1×106个细胞加入含有200μl蛋白酶和磷酸酶抑制剂的裂解液,4℃充分裂解细胞,离心取上清液,用BCA试剂盒定量总蛋白。配置12%的SDS-PAGE凝胶,每孔上样20μg蛋白进行电泳分离,转膜。在4℃孵育过夜前,用5%脱脂奶粉室温下封闭1h。与稀释后的一抗(1∶1000)孵育1h,用含有Tween-20的PBS洗涤膜三次,并与二抗(1∶20 000)室温孵育1h。用ECL发光液与膜接触检测印迹。使用TANON GIS软件分析条带灰度值。
1.9 统计学处理

2 结 果
2.1 各组细胞增殖水平比较
各组细胞增殖水平差异有统计学意义(P<0.01)。与对照组比较,模型组细胞增殖活力显著下降(t=22.03,P<0.01)。与模型组比较,si-NGALR组和PDTC组细胞增殖活力显著增加(t=6.38、7.60,P<0.01)。与PDTC组相比,PDTC+si-NGALR组细胞增殖活力显著增加(t=4.94,P<0.01)。见表2。

表2 各组细胞增殖能力和凋亡率
2.2 各组细胞凋亡率比较
各组细胞凋亡率差异有统计学意义(P<0.01)。与对照组相比,模型组细胞凋亡率显著上升(t=26.03,P<0.01)。与模型组相比,si-NGALR组和PDTC组细胞凋亡率显著下降(t=5.17、8.22,P<0.01)。与PDTC组相比,PDTC+si-NGALR组细胞凋亡率显著下降(t=3.66,P<0.01)。见图1和表2。

图1 各组细胞凋亡情况(流式细胞术)
2.2 各组细胞p-NF-κB p65、NF-κB p65、Snail、NGALR、NGAL和Vimentin蛋白表达水平比较
各组细胞p-NF-κB p65、NF-κB p65、Snail、NGALR、NGAL和Vimentin蛋白表达水平差异均有统计学意义(P<0.01)。与对照组比较,模型组细胞中p-NF-κB p65、Snail、NGALR、NGAL及Vimentin蛋白表达均显著增加(t=20.08、32.24、44.46、36.06、40.15,P<0.01)。与模型组比较,si-NGALR组和PDTC组细胞中p-NF-κB p65、Snail、NGALR、NGAL及Vimentin蛋白表达均显著下降(t模型组 vs siNGALR组=11.81、5.62、33.02、9.14、11.26,t模型组 vs PDTC组=17.02、14.99、37.27、13.61、20.76,P<0.01)。与PDTC组比较,PDTC+si-NGALR组细胞中p-NF-κB p65、Snail、NGALR、NGAL及Vimentin蛋白表达均显著下降(t=5.21、4.46、5.28、6.08、7.54,P<0.01)。见图2和表3。

图2 各组细胞中p-NF-κB p65、NF-κB p65、Snail、NGALR、NGAL及Vimentin蛋白水平(Western Blot)
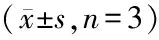
表3 各组细胞中p-NF-κB p65、NF-κB p65、Snail、NGALR、NGAL及Vimentin蛋白相对表达表达变化
3 讨 论
由于人口老龄化,肾脏疾病的患病率在世界范围内不断增加,并导致社会经济负担增加以及发病率和死亡率增加。狼疮性肾炎是一种累及多系统的自身免疫性疾病,主要由免疫复合物在肾小球内的形成和沉积引起[13]。目前狼疮性肾炎的治疗主要以糖皮质激素和免疫抑制剂为主,但对部分患者的临床缓解和复发抑制效果差[14]。因此,需要新型的靶向生物制剂准确及时地监测狼疮性肾炎的发生发展。NGAL是早期诊断急性肾损伤和预测肾脏预后的极佳生物标志物[15]。与健康对照相比,系统性红斑狼疮患者的血清NGAL水平显著升高,其中与非狼疮性肾炎患者相比,狼疮性肾炎患者的血清NGAL水平显著更高[16]。NGALR是NGAL特异性受体之一,在NGAL内吞过程中起着重要作用。与正常肾组织及其它类型肾小球肾炎相比,狼疮性肾炎的肾小球中NGALR蛋白表达明显增高,阳性染色结果表明其主要分布在系膜[17]。本研究中,与正常培养的人肾近曲小管细胞相比,高糖诱导损伤的细胞中NGALR蛋白表达显著升高,与前期临床结果一致[8]。而干扰NGALR的表达后,与高糖诱导的细胞模型相比,细胞增殖活力上升,凋亡率下降,说明抑制NGALR的表达能保护细胞正常生长,抑制非正常凋亡。
研究表明,EMT是组织损伤后纤维形成的一个组成部分,在器官纤维化过程中EMT被异常激活,诱导上皮细胞附近间充质肌成纤维细胞的形成,然后聚集和分泌纤维促进因子,促进组织变性[19]。EMT过程复杂,在此过程中上皮细胞失去极性并获得间充质特性[20]。Vimentin、Snail等作为关键诱导因子,以各种组合方式诱导促进间充质形态的基因表达,并抑制维持上皮状态的基因表达,促进细胞EMT发生[21]。Snail活化可以上调Vimentin进而诱导细胞骨架的改变介导EMT和成年转基因小鼠的肾纤维化[22],而抑制Snail和Vimentin表达能阻断EMT过程,降低细胞纤维化程度[23]。本研究中,干扰NGALR的表达后,细胞模型中Snail和Vimentin表达均下调,说明NGALR沉默抑制高糖诱导的细胞EMT过程,从而抑制细胞异常的表型转变。
在间质纤维化、肾纤维化等过程中,NF-κB信号通路发挥着重要作用[24]。同时,NF-κB信号通路的过度激活已被确定是EMT的关键诱导物[25]。NF-κB是参与调节细胞活化、炎症和存活的关键转录因子,在炎症和癌症的发展中起着核心作用。Kim等[26]研究发现,抑制NF-κB活化和p65磷酸化及易位到细胞核中,能下调间充质标志物、Snail的蛋白水平,抑制癌细胞迁移、侵袭和增殖。本研究中,NF-κB抑制剂作用于高糖诱导损伤细胞模型时,HK-2细胞增殖能力增强,凋亡率、Snail和Vimentin表达及NF-κB p65磷酸化水平均下降,且NGALR、NGAL表达下调。同时,干扰NGALR的表达后,HK-2细胞NF-κB p65磷酸化下调。这说明NGALR沉默对NF-κB信号通路的激活有负反馈调节作用,从而抑制高糖诱导的HK-2细胞EMT过程。
综上所述,结合课题组的前期临床研究,提示NGALR对狼疮性肾炎靶向治疗具有重要的理论意义和临床应用价值。其机制可能是NGALR通过与NGAL结合,激活HK-2细胞内部NF-κB信号通路,抑制EMT进程,减少HK-2细胞异常凋亡。

