马铃薯黑痣病生防芽胞杆菌的筛选及其次级代谢产物的抑菌特性
高学策,张 岱,魏笑薇,杨志辉,朱杰华,韩志校
(1. 河北农业大学植物保护学院,河北 保定 071001;2. 河北农业大学国有资产管理处,河北 保定 071001)
【研究意义】马铃薯是中国四大作物之一,因具有抗旱、抗贫瘠以及高用水效率而被广泛种植。随时间推移,由立枯丝核菌(Rhizoctoniasolani)引起的马铃薯黑痣病发生逐年加重[1],对马铃薯的产量、品质造成了极大影响[2],阻碍了马铃薯产业的发展,甚至有些地区的发病率达70%~80%[3]。目前,化学防治仍然是最有效的预防措施,但过度使用化学药剂会导致黑痣病菌抗药性增加,造成大量的农药残留和环境污染[4]。因此,迫切需要寻求一种安全有效的防控方法。生物防治具有安全、高效、绿色、环保等特点,应用前景十分广阔[5-6]。【前人研究进展】芽胞杆菌作为一种应用广泛的微生物资源,在研究中备受关注[7-8]。芽胞杆菌抗病机制多样,其中,抗生作用作为最重要的抗病机制之一,芽胞杆菌通过分泌大量具有抗菌作用的次级代谢物来抑制多种病原菌的生长。目前,关于芽胞杆菌次级代谢产物的研究主要包括脂肽类化合物、抗菌蛋白和挥发性物质等[9-11]。脂肽类化合物具有广谱抗性,能与传统抗生素协同作用[12]。姚博等[13]从解淀粉芽胞杆菌JK10发酵液检测得到脂肽类化合物BacillomycinD和Fengycin、大环内酯类抗生素DivergolideD和聚酮类化合物Bacillaene,揭示了JK10防治蓝莓根癌病的生防机制。挥发性有机物(Volatile organic compounds, VOCs)是微生物产生的一类分子量低(<300 Da)的化合物[14],是芽胞杆菌起拮抗作用的关键活性物质,目前已有很多关于VOCs抑菌作用及机制的报道。解淀粉芽胞杆菌XJ5释放的VOCs能够很好地拮抗苹果褐腐病菌(Moniliniafructigena)等多种病原真菌,抑菌率为47.9%~84.8%[15]。梁艳琼等[16]发现菌株Czk1释放的VOCs能够抑制橡胶树炭疽病菌孢子萌发,所产挥发性物质组分包括碳氢化合物、胺类、醇类、酮类等33种挥发性物质。植物病原真菌细胞壁主要成分是几丁质、β-1,3-葡聚糖和纤维素,芽胞杆菌在生长过程中可产生溶菌酶,溶解病原菌菌丝,使其菌丝断裂、原生质体凝结或细胞质消解,从而抑制病原菌菌丝的生长[17-18]。要雅倩等[19]筛选出一株对桃树根腐病有拮抗效果的解淀粉芽胞杆菌T-6,该菌株具备产蛋白酶、几丁质酶与溶磷、解磷和解钾的能力。【本研究切入点】目前,从抗菌肽、溶菌酶、挥发性物质出发,全面系统研究芽胞杆菌次级代谢物对黑痣病菌的影响相关报道较少。【拟解决的关键问题】本研究以筛选得到的优良生防菌株G32为研究对象,从芽胞杆菌分泌的多种次级代谢产物为切入点,全面鉴定其所产生的抗菌肽、挥发性物质和溶菌酶等抗菌活性,系统分析各次级代谢产物对马铃薯黑痣病菌拮抗作用,丰富生防菌种资源,为新型生防菌剂的开发提供理论依据,且系统明确了菌株G32 3种不同种类的抑菌物质的活性成分,为抑菌物质的协同增效作用提供了应用前景。
1 材料与方法
1.1 材料
1.1.1 供试土壤 采自河北省保定市河北农业大学三分厂试验基地(115.41604 E,38.809678 N)。
1.1.2 供试菌株 病原菌马铃薯黑痣病菌(R.solani)AG-3融合群,由河北农业大学马铃薯病害实验室提供,芽胞杆菌菌株G32由本试验分离获得。
1.1.3 供试培养基 采用PDA、LB、LBA、酪蛋白、果胶、纤维素、几丁质和淀粉培养基[20]。
1.2 方法
1.2.1 芽胞杆菌的分离和筛选 使用五点取样法采集马铃薯植株根际土壤,土壤稀释法进行菌株分离纯化[21]。拮抗菌株发酵液的制备按照李扬凡等[3]的方法制备种子液和发酵液。拮抗菌株的筛选采用生长速率法[20]筛选出马铃薯黑痣病菌抑菌效果好的生防芽胞杆菌。
1.2.2 菌株G32鉴定菌株G32形态学鉴定 将G32菌液涂布于LB平板上,37 ℃培养24 h后观察菌落的形态特征,使用革兰氏染色法鉴定菌株类型[22]。gyrB序列测定及分析:以G32菌株基因组DNA为模板,选用引物gyrB-F(5’-TTGRCGGHRGYGGHTATAAAGT-3’)和gyrB-R(5’-TCCDCCSTCAGARTCWCCCTC-3’)扩增gyrB基因,将PCR产物送往上海生工测序。使用NCBI对测序结果进行同源性分析,采用MEGA 6.0软件使用邻接法构建系统发育树。
1.2.3 菌株G32次级代谢产物抑菌活性测定 脂肽类物质:采用酸沉淀法提取脂肽粗提物,采用小杯法检测脂肽类抑菌物质对马铃薯黑痣病菌的抑菌作用,具体方法为:配制粗提液浓度为100、50、25、12.5 mg/mL,以甲醇为对照,加药量为100 μL,25 ℃黑暗培养至对照长满全皿,测量抑菌带宽度,使用光学显微镜观察菌丝形态并拍照。
挥发性化合物:采用双皿对扣法测定挥发性气体对病菌菌丝生长的抑菌作用[23]。用LB液将摇好的菌液稀释成1×108、1×106和1×104cfu/mL,一组培养皿中倒入PDA培养基,另一组添加LB培养基。将打好的马铃薯黑痣病菌菌饼接入PDA板中央,LB板接不同浓度梯度的菌液,将PDA板与LB板对扣,封口膜密封,25 ℃培养,重复3次,以无菌水为空白对照。当对照组菌丝长至全皿测量菌落直径,光学显微镜下观察马铃薯黑痣病菌丝形态。
1.2.4 菌株G32次级代谢产物的鉴定 菌株G32脂肽类物质合成基因的扩增:产脂肽基因合成sfp、ituA、fenB、bacD、mycB5个目的基因的引物(表1),以芽胞杆菌菌株G32的基因组DNA为模板进行PCR扩增[20]。

表1 产脂肽目的基因的引物
关于菌株G32挥发性物质的收集与GC-MS检测,样品前处理:准确量取 5.0 mL菌液于20 mL顶空瓶中,将DVB/CAR/PDMS萃取头萃取,于50 ℃平衡30 min,萃取40 min,解析5 min。气相色谱条件:一维色谱柱HP-innowax (30 m×0.25 mm×0.25 μm);二维色谱柱DB17-MS(1.2 m×0.18 mm×0.18 μm); 升温程序:初温50 ℃,4 ℃/min 升至240 ℃,240 ℃保持10 min; 进样口250 ℃,分流比40.0 mL/min。质谱条件: EI 70 eV,离子源230 ℃。四级杆150 ℃。质子扫描范围(m/z)40~550。GC-MS所得质谱图经NIST质谱数据库检索分析,选取相对峰面积大于1%及保留指数大于800的组分进行成份动态分析。
菌株G32蛋白酶类分析:取活化的G32菌液5 μL分别接种到生防因子测定培养基中,37 ℃培养48 h,观察是否有透明圈产生,重复3次,拍照并记录[24]。
2 结果与分析
2.1 菌株的分离筛选与鉴定
从采集的土样中筛选得到50株菌株,其中,有11株芽胞杆菌对马铃薯黑痣病菌拮抗效果好,抑菌带均>12.28 mm;其中,G32菌株对马铃薯黑痣病菌的抑菌作用最强,抑菌带为20.68 mm(图1-A)。由图1-B可知,菌株G32对黑痣病菌菌丝有致畸作用。对照组黑痣病菌丝形态表面光滑,呈直角分枝;发酵液处理后的菌丝畸形严重,菌丝节间变粗缩短,出现弯曲,局部肿大形成囊泡。
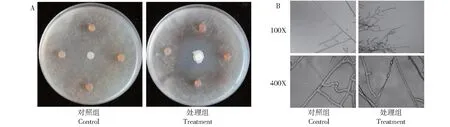
A. G32发酵液对黑痣病菌菌落生长的影响;B. G32发酵液对黑痣病菌菌丝形态的影响。A. Effect of G32 fermentation broth on colony growth of R.solani; B. Effect of G32 fermentation broth on mycelial morphology of R.solani.图1 对峙培养中G32发酵液对马铃薯黑痣病菌的抑制作用Fig.1 Inhibition of G32 fermentation broth on R.solani in confrontation culture
在LB平板上培养24 h后,菌株G32形成近圆形且具有乳白色菌膜的菌落,菌落表面有凹陷的褶皱,边缘不规则(图2-A)。革兰氏染色结果为阳性菌(图2-B)。

A. 菌落形态;B. 革兰氏染色形态特征。A. Colony morphology; B. Gram stain morphology.图2 菌株G32菌落形态和革兰氏染色形态Fig.2 Colony morphology and gram stain morphology of strain G32
对G32菌株的gyrB序列扩增产物进行序列比对,gyrB序列与B.amyloliquefaciensstrain 3-5等聚为一支(图3),相似度为99%,结合菌株G32的形态特征,将菌株G32鉴定为解淀粉芽胞杆菌(B.amyloliquefaciens)。

图3 基于gyrB序列构建G32菌株系统发育树Fig.3 Phylogenetic tree for strain G32 based on gyrB gene sequences
2.2 菌株G32次级代谢产物的抑菌活性
2.2.1 脂肽类物质的抑菌作用 利用酸沉淀法分理出脂肽类物质,并研究其对马铃薯黑痣病菌的拮抗作用。脂肽提取物浓度100、50、25、12.5 mg/mL,其抑菌圈直径分别为10.72、9.89、8.38、8.05 mm(图4-A)。光学显微镜下观察发现,对照组中马铃薯黑痣病菌丝生长正常,形态均匀,呈直角状分枝(图4-B);经脂肽提取物处理后,菌丝出现畸形膨大、菌丝粘连等现象。

A. 不同浓度脂肽提取物对黑痣病菌菌落生长的抑制;B. 脂肽类物质对黑痣病菌菌丝的形态影响。A. Inhibition of colony growth of R.solani in different concentrations of lipopeptide extract; B. Mycelial micrographs of R.solani treated with lipopeptide extract.图4 菌株G32脂肽提取物对黑痣病菌的抑制作用Fig.4 Inhibitory effect of strain G32 lipopeptide on R.solani
2.2.2 菌株G32挥发性物质对马铃薯黑痣病菌的拮抗作用 菌株G32产生的挥发性物质对马铃薯黑痣病菌生长有显著的抑制作用(P<0.05)。当菌液浓度分别为1×104、1×106、1×108cfu/mL时,抑菌率分别为42.64%、56.78%、66.31%(图5-A)。由图5-B可知,对照组黑痣病菌丝生长正常,形态均匀,直角分枝明显;而经G32产生的挥发性物质处理后,菌丝杂乱,局部膨大。
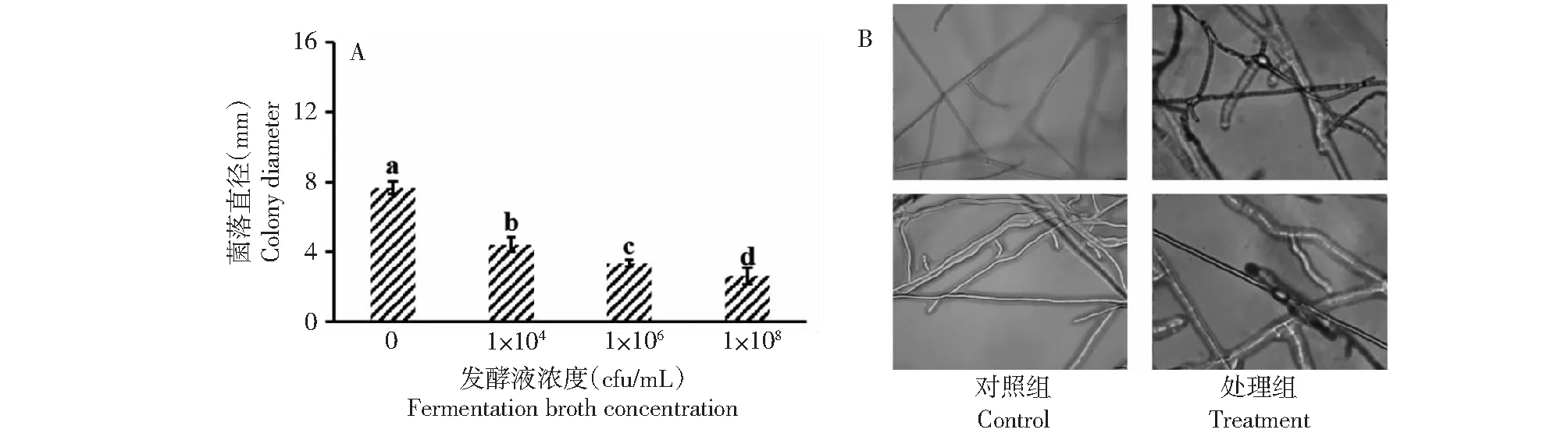
A. 不同浓度发酵液产生的挥发性物质对黑痣病菌菌落生长的抑制;B. 挥发性物质处理后黑痣病菌的菌丝形态。A. Inhibition of volatiles produced by different concentrations of fermentation broth on the growth of colonies of R.solani; B. Mycelia micrographs of R.solani treated with volatiles.图5 菌株G32挥发性气体对马铃薯黑痣病菌的抑制作用Fig.5 Effect of volatiles produced by strain G32 on the growth of R.solani
2.3 菌株G32次级代谢产物的鉴定
2.3.1 菌株G32脂肽类物质分析 使用PCR技术扩增5个脂肽类合成基因,将扩增产物进行琼脂凝胶电泳,有4对引物分别扩增出相应的目的条带(图6),分别是sfp(675 bp)、ituA(1150 bp)、bacD(540 bp)和mycB(2024 bp)基因,未扩增到fenB的目的条带。结果表明,G32可产生脂肽类物质Sufactins、IturinA、BacillomycinD、Mycosubtilin。

泳道:M. DM2000 marker; 1. sfp;2. ituA;3. fenB;4. bacD;5. mycB。Track:M. DM2000 marker; 1. sfp;2. ituA;3. fenB;4. bacD;5. mycB.图6 菌株G32脂肽合成基因的PCR产物电泳Fig.6 PCR product electrophoresis of strain G32 lipopeptide synthesis gene
2.3.2 菌株G32挥发性物质的GC-MS鉴定 VOCs成分检测结果表明,G32共产生13种挥发性物质(图7,表2),主要包括酮类4种、醇类5种、芳香族类2种、醚类1种和有机酸类1种,含量依次为69.73%、23.97%、2.95%、2.21%和1.14%。其中,酮类和醇类为其主要物质,3-羟基-2-丁酮含量最高,为48.90%,其次是2-壬酮(11.33%)和正辛醇(10.84%)。
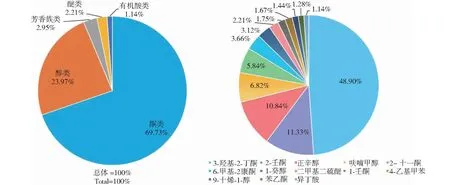
A. 5类挥发性有机化合物的峰值面积;B. 各挥发性有机化合物的相对含量。A. Peak area of five identified classes of VOCs from G32; B. The relative content of volatile organic compounds released by strain G32.图7 基于GC-MS数据峰面积的菌株G32释放的挥发性有机化合物的相对含量Fig.7 The relative content of identified volatile organic compounds released by strain G32 based on the peak area of GC-MS data
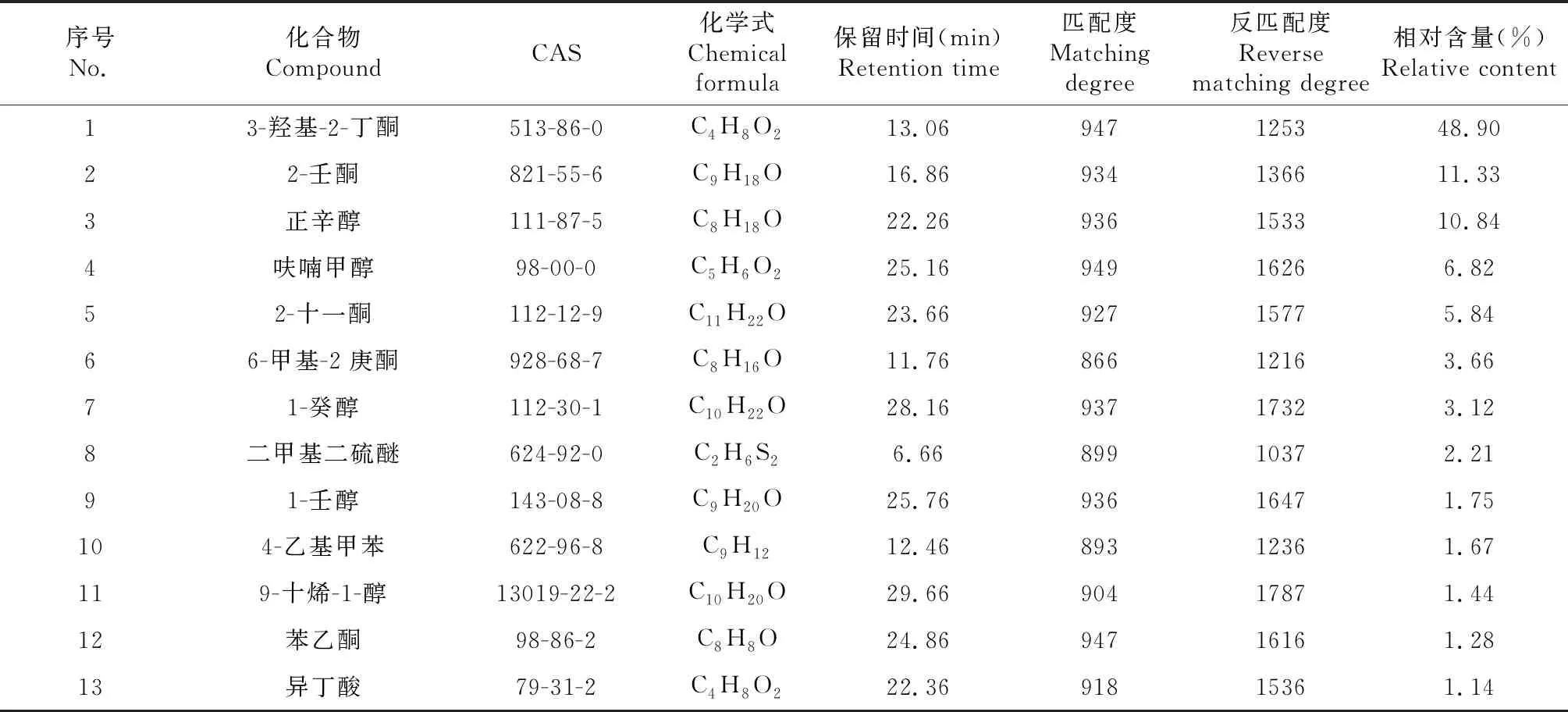
表2 菌株G32释放的挥发性有机化合物
2.3.3 菌株G32产细胞壁水解酶活性 采用透明圈法,测定菌株G32胞外酶活性,如图8所示,在刚果红纤维素培养基上接种G32后能看见边缘清晰的酶解圈,说明菌株G32具有降解纤维素的能力,可产生纤维素酶,无产蛋白酶、果胶酶、几丁质酶作用。

A. 蛋白酶;B. 纤维素酶;C. 果胶酶;D. 几丁质酶。A. Protease; B. Cellulase; C. Pectinase; D. Chitinase.图8 菌株G32产酶活性分析Fig.8 Analysis of enzyme production activity of strain G32
3 讨 论
国内外研究发现芽胞杆菌拮抗植物病原真菌的主要机制之一为抗生作用[25],芽胞杆菌可产生多种次级代谢产物起抑菌作用,从而达到生防目的[26]。其中,脂肽类抗生素是芽胞杆菌产生的一种重要的抑菌活性物质。本研究在筛选到的生防枯草芽胞杆菌G32中,检测到sfp、ituA、mycB、bacD等脂肽合成基因,说明生防菌G32可产生多种抗菌肽发挥其生防效果,如Sufactins、IturinA、BacillomycinD、Mycosubtilin。这些脂肽类抗生素已在多项研究中报道其抑菌活性,萎缩芽胞杆菌QHZ-3菌株可分泌Surfactin、Iturin和Fengycin 3种脂肽类抗生素,能够显著降低土壤中立枯丝核菌的含量[27]。解淀粉芽胞杆菌fqhm-13主要抑菌物质为SurfactinA和IturinA[28]。
利用微生物产生的挥发性有机化合物进行生物熏蒸防治病害,具有广泛的研究价值和应用前景。已有相关研究表明芽胞杆菌可产生多种mVOCs,且抑菌谱非常广[29],B.amyloliquefaciensL3可以产生多种VOCs,其中,2-庚酮、2-乙基-1-己烷和2-壬酮完全抑制西瓜枯萎病的生长[30]。枯草芽胞杆菌Y13产生VOCs对果生炭疽菌(Colletotrichumfructicola)等10种植物病原菌具有抑菌活性,抑菌率在19.2%~83.9%[31]。本研究采用全二维相色谱质谱法对G32菌株挥发性物质进行测定,可获得更高的灵敏度和分辨率,对于复杂样品例如同分异构体和杂化物的分离也有更好的效果[32],其产生的VOCs类型为酮类、醇类、芳香族类等,其中2-壬酮、苯乙酮等已被证实有抑菌活性。由解淀粉芽胞杆菌JB68株产生2-壬酮对茶炭疽病抑菌率为84.51%[33],贝莱斯芽胞杆菌C16产生苯乙酮可完全抑制对早疫病菌生长[34]。
此外,芽胞杆菌还可以通过生防因子来抑制病原菌,B.subtilisXC-1菌株具有产纤维素酶、蛋白酶的能力,酶能降解病原菌细胞壁,破坏菌丝结构,从而降低病原菌存活率[35];B.subtilisBS193分泌的蛋白酶和纤维素酶可以破坏疫霉菌的细胞壁,抑制菌丝生长和游动孢子产生[36]。本研究分离得到的解淀粉芽胞杆菌G32菌株具有产生纤维素的能力,破坏菌丝形态,与上述研究结果一致。
本研究分离得到的解淀粉芽胞杆菌G32在马铃薯黑痣病生物防治中具有开发利用潜力,但有关其生防机制和抑菌机理尚需进一步研究。
4 结 论
本研究筛选获得了对马铃薯黑痣病具有良好拮抗效果的解淀粉芽胞杆菌G32,其可分泌多种次级代谢产物,包括抗菌肽、挥发性有机物和溶菌酶。脂肽类粗提物和挥发性有机物均能够抑制黑痣病菌生长,且使菌丝产生畸形;对菌株G32次级代谢产物进行鉴定,该菌株主要产生Sufactins、IturinA、BacillomycinD、Mycosubtilin 4种脂肽类抗生素,产生的挥发性有机物包括酮类、醇类、芳香族类、醚类、有机酸类等5类13种,其中3-羟基-2-丁酮、2-壬酮和正辛醇为其主要成分,占比48.90%、11.33%和10.84%;该菌株可分泌纤维素酶,能够破坏病原菌细胞壁,达到抑制菌丝生长的效果。

