茶树3个TPT基因的鉴定与表达
曹 丹,刘艳丽,马林龙,李 娟,金孝芳
(1. 湖北省农业科学院果树茶叶研究所,武汉 430064;2. 茶学教育部重点实验室/国家植物功能成分利用工程技术研究中心/植物功能成分利用省部共建协同创新中心/农业农村部园艺作物基因资源评价利用重点实验室/湖南农业大学,长沙 410128)
【研究意义】茶树[Camelliasinensis(L.) O. Kuntze]是一种重要的经济作物,茶因富含多种有益的次级代谢产物,如儿茶素、茶氨酸、咖啡碱、茶多糖等,具有很好的健康属性和品饮属性[1-2]。茶树在全世界广泛种植,其在生长和发育过程中常遭受季节性干旱、冷害冻害、盐碱等引发的非生物胁迫以及由病虫害造成的生物胁迫,严重制约茶叶的产量和品质,进一步影响茶叶的经济效益[3]。研究茶树的抗逆机理,挖掘抗逆相关基因并解析其作用机制,对茶树抗逆育种具有重要意义。【前人研究进展】目前为止,越来越多的基因被证实参与了茶树的逆境响应,如病程相关基因非表达子CsNPR3(Non-expresser of pathogenesis-related gene 3)[4]、丝裂原活化蛋白激酶CsMAPK15(Mitogen-activated protein kinase 15)[5]、脂肪酸去饱和酶基因CsFAD2/5(Fatty acids desaturation 2/5)[6]、小GTP酶基因CsRAC1(RAC/ROP 1)[7]、9-顺式-环氧类胡萝卜素双加氧酶基因CsNCED2(Nine cis epoxide carotenoid dioxygenase 2)[8]、转录因子CsNAC28(NAM、CUC2、ATAF1/2)[9]和CsWRKYIIcs[10]等分别参与了茶树的冷胁迫、干旱胁迫、盐胁迫、高温胁迫等。磷酸丙糖转运蛋白(Triose phosphate translocator,TPT)是叶绿体中重要的内膜蛋白,其功能严格按照1∶1反向交换的原则,将光合初级产物从叶绿体运入胞质,同时将磷酸从胞质运到叶绿体基质。自1981年第一个TPT蛋白从菠菜叶绿体被膜中分离纯化出来后,TPT基因在植物中的功能逐渐被挖掘。孙金月等[11]利用SDS-PAGE和同位素标记等试验发现,小麦TPT约占叶绿体内膜总蛋白的15%,TPT对底物的转运活性受光的调节,TPT基因的表达量可作为高产小麦品种的筛选标准之一。Zirngibl等[12]研究证实,为适应高光胁迫,TPT通过转运光合产物促进细胞中的糖含量快速增加,进而激活花青素生物合成的转录和代谢。另外,渗透胁迫处理可诱导TPT基因的表达。薛春生等[13]研究发现,甘蔗花叶病毒可诱导玉米TPT基因高表达,推测可能的防御机制是通过提高TPT活性促进蔗糖含量的增加来抵御甘蔗花叶病毒的侵染。【本研究切入点】目前,有关茶树TPT基因的研究鲜有报道。本研究采用生物信息学方法,在茶树基因组数据库中进行检索,对得到的TPT基因进行基因结构、进化关系、保守结构域、启动子顺式元件以及不同逆境下的表达模式进行分析。【拟解决的关键问题】明确茶树TPT基因的特性,为其在茶树中的功能验证和分子育种提供理论依据。
1 材料与方法
1.1 材料
供试材料为1年生扦插苗‘金茗1号’,种植于湖北省茶树种质资源圃。
1.2 茶树TPT基因成员鉴定
通过将拟南芥(https://www.arabidopsis.org/)、水稻(https://rice.plantbiology.msu.edu/)、苹果(https://phytozome.jgi.doe.gov/pz/portal.html)、杨树(https://phytozome.jgi.doe.gov/pz/portal.html)中的TPT基因序列与茶树基因组数据[14-15]进行比对,将得到的序列提交至NCBI进行Blast比对,去除不完整序列和冗余序列,所得序列用于后续分析。利用ProtParam程序(https://web.expasy.org/protparam/)对TPT氨基酸序列进行理化性质分析。利用WOLF PSORT在线软件(https://wolfpsort.hgc.jp/)进行亚细胞定位预测[16]。
1.3 系统进化、蛋白结构、保守基序及启动子顺式作用元件分析
使用软件MEGA7构建拟南芥和茶树TPT氨基酸序列的系统进化树,利用相邻连接法,BootStrap设置为1000,其余参数均为默认值[17]。利用MEME(https://meme-suite.org/meme/)、GSDS2.0 (http://gsds.cbi.pku.edu.cn/)在线软件分析CsTPT基因的结构域和保守基序[18-19]。取起始密码子上游2 kb的基因组序列,采用PlantCARE数据库对启动子中所含的顺式元件进行分析[20]。
1.4 总RNA提取与荧光定量表达分析
在茶树基因组数据库(TPIA:http://tpdb.shengxin.ren/)中下载TPT基因在不同组织(顶芽,花,果实,嫩叶,成熟叶,老叶,根,茎)、冷胁迫、干旱胁迫、茉莉酸甲酯胁迫以及盐胁迫的表达数据,利用omicshare平台(https://www.omicshare.com/tools)进行数据处理并绘图。
基于CsTPT基因序列,利用软件Primer 5设计引物(表1),由北京天一辉远生物科技有限公司合成。采用EASYspin plus试剂盒提取茶树根系总RNA,并不同浓度亚硒酸盐(0、0.03、0.05、0.50、5.00、10.00 mmol/L)[21]处理茶树根系总RNA,利用M-MLV进行逆转录反应。qRT-PCR反应体系为:10 μL 2×KAPA SYBR®FAST qPCR Master Mix ABI Prism,1 μL cDNA模板,上、下游引物各0.4 μL,补充PCR-grade water 至20 μL。反应程序:95 ℃预变性3 min,95 ℃变性3 s,60 ℃退火30 s,72 ℃延伸30 s,进行30个循环,以GAPDH为内参基因,每个基因3次重复。采用2-ΔΔCt法计算基因的相对表达量,运用Microsoft office 2010整理试验数据,利用Omicshare平台绘制热图。

表1 qRT-PCR 引物信息
2 结果与分析
2.1 茶树TPT基因的鉴定及理化性质分析
利用拟南芥、水稻、苹果和杨树的核苷酸序列信息,在茶树基因组数据库中进行搜索,利用在线软件SMART和CDD对保守结构域进行验证,得到3个含有TPT结构域的基因(表2),分别命名为CsTPT1、CsTPT2、CsTPT3。茶树CsTPTs基因的序列长度为807(CsTPT3)~1635(CsTPT2) bp,编码268(CsTPT3)~544(CsTPT2)个氨基酸;3个CsTPT蛋白的等电点均大于7,表明呈弱碱性或者碱性;CsTPT3蛋白的不稳定系数小于40,为稳定蛋白,CsTPT1和CsTPT2蛋白则反之;平均疏水值均大于0,说明均为疏水性蛋白。亚细胞定位分析显示,3个蛋白分别定位到质膜(CsTPT1、CsTPT2)和叶绿体(CsTPT3)。

表2 茶树CsTPT基因信息
2.2 茶树TPT系统进化、基因结构及保守结构域分析
进化分析(图1)显示,茶树TPT基因成员共分为2组,第1组有6个成员,分别是TEA019760(CsTPT3)、TEA013170(CsTPT1)、AY081479.1、AY042874.1、NM001334001.1、NM104862.4。第2组有2个成员,分别为TEA017682(CsTPT2)和NM001085251.1,且二者同源性较高。

TEA013170、TEA019760、TEA017682 茶树,AY081479.1、AY0428 74.1、NM001334001.1、NM104862.4、NM001085251.1 拟南芥。TEA013170,TEA019760,TEA017682 tea plant,AY081479.1,AY042874.1,NM001334001.1,NM104862.4,NM001085251.1 Arabidopsis thaliana.图1 茶树和拟南芥TPT的系统进化Fig.1 Phylogenetic assay of TPP in tea plant and Arabidopsis thaliana
基因结构分析(图2)发现,3个TPT基因的外显子数目在6~13,内含子数目在5~12,其中CsTPT1和CsTPT3含有相同数量的外显子(6个)和内含子(5个)。

图2 茶树CsTPT基因外显子-内含子结构Fig.2 Exon-intron of CsTPT genes in tea plant
Motif分析共预测出7个保守基序,利用TBtools软件绘制基序分布图(图3),发现除了个别差异外,3个TPT蛋白包含的保守基序基本一致,均包含motif1、motif2、motif4、motif6,暗示其具有相似的功能。

图3 茶树TPT蛋白结构域分布Fig.3 Distribution of TPT protein motifs in tea plant
2.3 茶树TPT基因顺式作用元件分析
通过对茶树TPT基因上游2000 bp序列进行顺式元件预测(表3),CsTPT启动子含有典型的CAAT-box(135个)和TATA box(127个)核心启动子元件,还包含多种与逆境胁迫、激素及生长发育相关的顺式作用元件。其中植物生长发育相关响应元件24个,包括光响应元件(ATCT-motif,ACE,Box4,G-box,GT1-motif,chs-CMA1a,AE-box,I-box,ATC-motif,TCT-motif等)、胚乳表达相关顺式作用元件(GCN4_motif)、玉米醇溶蛋白代谢调控相关顺式作用元件(O2-site)和分生组织表达相关响应元件(CAT-box);激素响应元件14个,包括脱落酸响应元件(ABRE)、茉莉酸甲酯响应元件(CGTCA-motif,TGACG-motif)和水杨酸响应元件(TCA);逆境胁迫相关响应元件53个,包括缺氧响应元件(ARE)、压力响应元件(STRE)、WRKY蛋白结合位点(W-box)、创伤响应元件(WUN-motif)、干旱响应元件(MBS)、低温响应元件(LTR)、脱水应答元件(DRE core)等。

表3 茶树TPT基因启动子顺式作用元件分析
2.4 茶树TPT基因的表达模式分析
基因在植物不同组织的表达情况与其生长发育调控紧密相关。从图4可知,CsTPT基因在茶树多种部位中均有不同程度的表达,其中CsTPT2(TEA017682)在根、幼叶、成熟叶、老叶、芽、花中的表达量显著高于种子和茎,且在根中的表达量最高;CsTPT3(TEA019760)主要在茎中表达;CsTPT1(TEA013170)在各部位均有较高表达,在成熟叶中表达量最高。说明CsTPT基因在茶树各部位具有不同的调控作用,且其中的高表达也说明其参与调控茶树生长发育过程的重要性。

图4 茶树TPT基因在不同组织的表达分析Fig.4 Expression analysis of CsTPT genes in different tissues
在冷胁迫处理(0 h,1.6 h,1.7 d,2.7 d,7.0 d,图5-A)下,CsTPT1表达量在0 h~2.7 d随着处理时间增加表达量逐渐升高,在处理时间为7 d时降低;CsTPT2的表达量随着处理时间的增加呈下降趋势;CsTPT3只在处理时间为2.7 d时有微弱表达。推测TPT基因在茶树应对冷胁迫过程中起着一定作用,且不同成员在不同时期发挥作用。
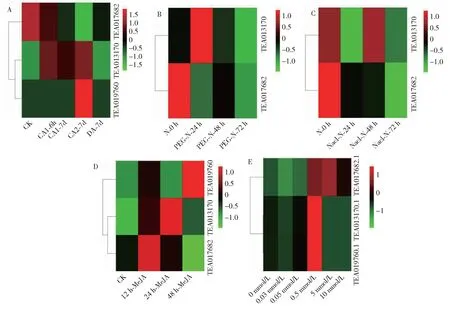
图5 茶树TPT基因在冷(A),干旱(B),盐(C),MeJA(D),硒(E)胁迫中的表达分析Fig.5 Expression analysis of CsTPT genes under cold(A), drought(B), salt(C), MeJA(D) and selenium(E) stress treatments
干旱胁迫处理(0,24,48,72 h,图5-B)下,CsTPT1表达量随着处理时间的延长呈先升高后降低的趋势,24 h达到最高值;CsTPT2不同处理时间均呈现下调的表达趋势;CsTPT3在各个处理时间点表达量均为零。
盐胁迫处理(0,24,48,72 h,图5-C)下,CsTPT1在处理48 h时上调表达,处理24和72 h时均下调表达;CsTPT2在不同处理时间点均下调表达;CsTPT3在各个处理时间点的表达量均为零。
MeJA处理(0,24,48,72 h,图5-D)下,CsTPT1表达量随着处理时间的延长先升高后降低,但均处于上调趋势,其中在24 h时达到峰值;CsTPT2呈现先升后降的表达趋势,12 h达到峰值;CsTPT3仅在12和48 h微弱表达。推测CsTPT1在应对MeJA处理时起着正调控作用。
外源硒处理(0,0.03,0.05,0.50,5.00,10.00 mmol/L,图5-E)下,CsTPT1和CsTPT2均在硒浓度为0.50 mmol/L时上调表达,表达量分别是对照组的5.2和6.2倍,而在其它浓度(0.05 mmol/L除外)处理下均呈现不同程度的下调;CsTPT3的表达量随着外源硒的增加呈先下调后上调的趋势。
3 讨 论
目前,已从拟南芥[22]、小麦[23]和玉米[2]等植物鉴定并分离得到TPT基因,但大多集中于研究单个基因的功能。本研究在茶树全基因组内筛选并鉴定到3个TPT基因。CsTPT1和CsTPT3基因在系统进化树中聚在同一组,同时二者具有相同数目的外显子和内含子,推测可能具有相似或相关的功能。Motif分析发现,3个TPT基因保守基序的数量和位置大致相同,具有较高的保守性,暗示了其结构域和功能单位大致相似[24]。
启动子决定了基因的时空特性和表达水平,是调控基因的“开关”。本研究发现,茶树TPT基因启动子包括许多光响应元件,表明其可能参与光合作用。另外,还发现茉莉酸甲酯、水杨酸和脱落酸响应元件,这些激素响应元件可能参与植物对逆境胁迫的响应[25-27]。同时,TPT基因启动子还含有低温、干旱、压力、缺氧等响应元件。因此,推测CsTPT基因不仅与茶树光合作用有关,还参与了激素调控和逆境胁迫。
早期研究认为TPT基因只局限在叶片、胚芽鞘等绿色组织中表达[23],后续的研究发现TPT基因也在小麦分蘖节中表达[28]。在本研究中,茶树TPT基因在不同组织均有不同程度的表达。其中CsTPT3基因在芽和叶片中有较高的表达,这可能与叶和芽是茶树的主要光合作用器官,TPT基因是光合作用相关的重要功能基因有关。此外,CsTPT2基因在不同逆境条件下均呈显著下调的表达趋势(0.50 mmol/L外源硒处理除外),推测该基因在应对茶树低温、干旱、MeJA、盐和外源高浓度硒(亚硒酸盐浓度高于0.10 mmol/L时即可出现中毒症状)[29]等胁迫过程中起着负调控的作用。CsTPT1基因在低温胁迫1.6 h~7 d上调表达,这与其在小麦中的研究一致,可能是因为CsTPT1基因通过促进可溶性糖的累积提高植株的抗寒性[28]。
4 结 论
CsTPT3基因的高表达可能与茶树光合作用有关,CsTPT2可能参与了茶树对逆境胁迫的响应过程。本研究为探索CsTPT基因功能和茶树抗性育种提供理论参考。

