乌菜BcVIL2基因克隆及春化响应表达分析
桂尚枝,刘雪晴,王 英,唐小燕,赵龙龙,李 广,吴思文,温宏伟,汪承刚,陈国户
(1. 安徽农业大学园艺学院蔬菜遗传育种实验室/安徽省园艺作物育种工程实验室,合肥 230036;2. 安徽省皖江蔬菜产业研究院,安徽 马鞍山 238200)
【研究意义】乌菜(BrassicacampestrisL. ssp.chinensisvar.rosularis)又称乌塌菜、塌棵菜、塌地松、黄心乌等,属于不结球白菜,是十字花科芸薹属白菜亚种的一个变种[1]。乌菜起源于中国,喜冷凉气候,常在秋冬季节栽培,是江淮流域秋冬季节最主要的叶菜品种之一,在调剂蔬菜“冬缺”和“春淡”市场中具有重要地位。乌菜一般具有很强的抗寒能力,但在生产中,乌菜极易完成春化,导致未熟抽薹,严重影响商品品质与营养价值。目前通过分子遗传学等手段,调控蔬菜抽薹时间已成为非常有应用前景的先进技术方法。因此,探究乌菜抽薹开花关键基因功能,解析其抽薹开花时间调控机制,对提高耐抽薹种质资源的利用效率具有指导意义。【前人研究进展】抽薹开花是高等植物生命周期中重要的生理与形态变化[2]。据报道,拟南芥中已发现306个抽薹开花相关基因,参与温度、光周期、春化、年龄、赤霉素、自主开花、脱落酸和油菜素甾醇等八大途径[3-4],并且各途径相互交织,形成复杂的调控网络。春化途径是白菜类蔬菜抽薹开花的主要调控途径之一[5]。植物春化过程中,主要开花抑制因子FLOWERINGLOCUSC(FLC)可感知环境温度的变化,通过直接抑制SUPPRESSOROFOVEREXPRESSIONOFCONSTANS1(SOC1)的表达及阻止茎尖分生组织中的FLOWERINGLOCUSD(FD)上调,来响应FLOWERINGLOCUST(FT)信号,调节开花时间[3]。植物经历低温春化后,VIVIPAROUSI/ABI3-LIKEfactor1(VAL1)等转录因子可抑制FLC的表达,从而促使植物在春季有利条件下抽薹开花[6]。VERNALIZATIONINSENSITIVE3(VIN3)/VERNALIZATIONLIKE(VEL)是一类小的PHD-Finger基因家族[7],各成员可响应环境因素,参与春化途径控制开花时间。该基因家族包括VIN3、VIN3-LIKE1(VIL1)/VERNALIZATION5(VRN5)、VIL2/VEL1、VIL3/VEL2和VIL4/VEL3。其中,VIN3是春化介导抑制FLC表达所必需的基因[8],在长时间冷环境中VIN3mRNA水平缓慢上升,通过修饰染色质标记缓慢抑制FLC的转录[9];VIL1/VRN5参与春化和光周期途径,与VIN3相互作用,同样通过染色质修饰,抑制FLOWERINGLOCUSM(FLM)/MADSAFFECTINGFLOWERING1(MAF1)的表达[10-11];而VIL2可与Polycomb Repressive Complex 2 (PRC2)结合,对MAF5进行表观修饰,使其沉默表达[12]。到目前为止,对VIL2基因功能的研究仍较少,并且关于乌菜BcVIL2基因在春化过程中的作用目前还未见报道。【本研究切入点】VIL2基因编码的蛋白与VRN5和VIN3蛋白相似,在十字花科植物抽薹开花过程中发挥着重要作用。本研究以乌菜为试验材料,采用序列比对及同源克隆的方法获得BcVIL2基因并进行生物信息学和组织特异性表达分析,探究春化途径关键基因BcVIL2在乌菜中的功能。【拟解决的关键问题】本研究针对VIN3/VEL家族中VIL2基因进行研究,从乌菜‘徽乌19’中克隆BcVIL2基因,利用生物信息学方法对BcVIL2基因序列进行分析,通过转录组测序与实时荧光定量PCR技术,分析该基因响应春化的表达情况。研究结果旨在为进一步解析乌菜春化途径的分子机制提供理论依据。
1 材料与方法
1.1 试验材料
试验材料‘徽乌19’为安徽农业大学园艺学院蔬菜遗传育种实验室自主选育的品种,表现出晚抽薹性状。种子萌发后置于人工气候室进行培养,温度为22 ℃/18 ℃(光照/黑暗),相对湿度为70%,光照时间为16 h/8 h (光照/黑暗),光强为100 μmol/(m2·s)。一月苗龄(四叶一心)时进行低温春化处理,温度为4 ℃,其他条件不变;春化处理0、15、30 d时,取茎尖分生组织及幼嫩叶片,用于转录组及荧光定量PCR分析。人工气候室培养至开花期,分别取根、茎、叶、花、荚果等组织,用于组织表达分析。所有样品取样均为3次生物学重复。
1.2 试验方法
1.2.1 乌菜样品总RNA提取及反转录 乌菜不同样品采用Invitrogen TRIzol试剂(Thermo Fisher)进行总RNA提取,采用NanoDrop Lite Plus核酸自动定量仪(Thermo Fisher)测定总RNA浓度。采用PrimeScript RT reagent试剂盒(TaKaRa),取0.5 μg RNA进行反转录(10 μL体系:5×PrimeScript Buffer 2 μL, PrimeScript RT Enzyme Mix I 0.5 μL, Oligo dT Primer 0.5 μL, Randome 6 mers 0.5 μL, RNA 0.5 μg, RNAase Free dd H2O up to 10 μL)。
1.2.2 转录组测序及分析 对不同春化时间的乌菜茎尖及幼嫩叶片组织混样后提取总RNA后构建测序文库;利用Nanopore全长转录组三代测序平台进行测序(百迈克,北京)。获得原始测序数据经质控过滤后,利用hisat2软件比对至白菜基因组(V3.0;http://brassicadb.cn);利用featureCounts计算各基因的couns,再采用FPKM值(Fragments Per Kilobase of exon model per Million mapped fragments)计算基因表达丰度,以|log2(fold change)|≧1与P<0.05为阈值,筛选差异表达基因(DEG)。
1.2.3BcVIL2基因克隆 结合全长转录组测序获得的基因注释信息和白菜BrVIL2基因(BraA06g029730.3C)的序列,采用Primer 5.0软件进行特异性引物设计(表1)。再利用PCR试剂盒(TaKaRa,大连)扩增乌菜BcVIL2基因,扩增程序:95 ℃,5 min;94 ℃,30 s;58 ℃,30 s;72 ℃,150 s,30个循环;72 ℃,10 min。PCR产物利用凝胶回收试剂盒(Axygene,杭州)回收后,克隆至pMD-18载体中,再转化至DH5α大肠杆菌中;挑选单克隆,经菌液PCR后测序验证。

表1 基因引物序列
1.2.4BcVIL2基因生物信息学分析 利用在线工具Expasy (https://web.expasy.org/protparam/)分析BcVIL2蛋白理化性质;利用在线工具SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)及SWISS-MODEL (https://swissmodel.expasy.org/interactive)分别预测BcVIL2氨基酸的二级及三级结构。利用在线工具Protscale (https://web.expasy.org/protscale/)、TMHMM (https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)、SignalP (https://services.heal- thtech.dtu.dk/service.php?SignalP-5.0)、NetPhos (https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)、NetNGlyc (https://mybiosoftware.com/netnglyc-1-0a-n-linked-glycosylation-sites-human-proteins.html)分别分析BcVIL2蛋白的亲疏水性、跨膜结构、信号肽、潜在的糖基化及磷酸化位点[14-15]。利用在线工具wolfpsort (https://wolfpsort.hgc.jp/)与YLOC(https://abi-services.informatik.uni-tuebingen.de/yloc/webloc.cgi)预测BcVIL2蛋白的亚细胞定位。利用BRAD网站(http://brassicadb.cn/#/)BLAST工具,查找十字花科植物同源蛋白序列;再利用DNAMAN(LynnonBiosoft,美国)软件进行多重序列比对,同时利用MEGA 7.0软件(Mega Limited,Auckland,新西兰)构建同源进化树(NJ法;bootstrap:1000)[16]。采用STRING数据库(https://string-db.org/)分析BcVIL2蛋白互作网络关系。
1.2.5 基因表达及数据统计分析 利用SYBR Premix ExTaqII试剂盒(TaKaRa,大连),以Actin为内参基因,利用表1中特异引物,进行qRT-PCR表达分析;每个样本进行3次生物重复,每个基因进行3次技术重复。荧光定量PCR结果使用2-ΔΔCt法计算基因相对表达量[17],并使用SPSS 20.0进行方差分析。
2 结果与分析
2.1 BcVIL2基因克隆与分析
根据乌菜全长转录组数据注释信息及白菜基因组注释信息(V3.0),设计特异性引物,同源克隆获得约1200 bp条带(图1);单克隆测序结果发现,该基因ORF长度为1296 bp,较白菜BrVIL2基因5’端缺失15个碱基,与全长转录组测序结果一致,将该基因命名为BcVIL2。该基因编码431个氨基酸,蛋白分子式为C2054H3351N585O665S32,蛋白分子量为47.91 kDa;该基因蛋白序列含有66个正电荷氨基酸残基(精氨酸+赖氨酸)和60个负电荷氨基酸残基(天冬氨酸+谷氨酸),等电点为8.27,脂肪族系数为73.25,蛋白不稳定系数为48.36,预测为不稳定蛋白(表2)。利用ProtScale在线工具预测BcVIL2的亲疏水性,发现该蛋白第99位氨基酸亲水性最强(赖氨酸,分值:-3.667),第236位氨基酸疏水性最强(精氨酸,分值:1.789)(图2-A),总平均亲水性为-0.508 (表2),预测为亲水性蛋白。

M:DL2000;1:BcVIL2基因扩增产物。M: Marker DL2000; 1: Products of BcVIL2 gene.图1 乌菜BcVIL2基因克隆Fig.1 Cloning of BcVIL2 gene from Wucai

红框表示PHD结构域。相似性:深蓝色=100%;浅红色≥75%;青色≥50%。 Al:琴叶拟南芥(AL3G53040.t1);At:拟南芥(AT2G18880);Bni:黑芥(BniB02g015120.2N.1);Bju:芥菜(BjuVA06G32070);Bo:甘蓝(BolC03g053910.2J);Br:白菜(BraA06g029730.3C);Cru:荠菜(Carubv10015589);Csa:芥蓝(Csa01g042070.1);Rs:萝卜(Rsa10041874);Sp:条叶盐芥(Tp3g32350)。The red box represents the PHD domain. Similarity: Dark blue=100%; Light red≥75%; Cyan≥50%. Al: Arabidopsis lyrata (AL3G53040.t1); At: A. thaliana (AT2G18880); Bju: Brassica juncea (BjuVA06G32070); Bni: B. nigra (BniB02g015120.2N.1); Bo: B. oleracea (BolC03g05 3910.2J); Br: B. rapa (BraA06g030830.3.5C); Csa: Camelina sativa (Csa01g042070.1); Cru: Capsella rubella (Carubv10015589); Rs: Raphanus sativus (Rsa10041874); Sp: Schrenkiella parvula (Tp3g32350).图2 BcVIL2蛋白疏水性预测(A)、蛋白序列多重比对(B)及进化树分析(C)Fig.2 Protein hydrophobicity prediction of BcVIL2 (A), multi-sequence alignment (B) and phylogenetic tree analysis (C)

表2 乌菜BcVIL2基因序列分析
2.2 BcVIL2基因生物信息学分析
利用DENMAN软件对乌菜BcVIL2蛋白序列与白菜(Brassicarapa, syn.B.campestris)、黑芥(B.nigra)、甘蓝(B.oleracea)及拟南芥(Arabidopsisthaliana)的VIL2蛋白序列进行多重序列比对分析(图2-B),结果显示BcVIL2与BrVIL2 (BraA06g02 9730.3C)、BniVIL2 (BniB02g015120.2N.1)、BoVIL2 (BolC03g053910.2J)、AtVIL2 (AT2G18880)蛋白序列的相似度分别为98.85%、80.67%、86.74%、41.88%;此外,这些VIL2蛋白均含有PHD结构域(图2-B)。利用BLAST工具,从BRAD数据库中获得十字花科植物VIL2蛋白序列,采用MEGA软件进行进化树分析(图2-C),结果显示11个VIL2蛋白聚类为3个分支,乌菜BcVIL2蛋白与白菜、芥菜(B.juncea)、萝卜(Raphanussativus)、黑芥及甘蓝的VIL2聚为1个分支;拟南芥、琴叶拟南芥(A.lyrata)、芥蓝(Camelinasativa)、荠菜(Capsellarubella) VIL2聚为1个分支;条叶盐芥(Schrenkiellapar-
vula) VIL2单独为1个分支。
利用WoLF PSORT及YLOC在线工具预测BcVIL2的亚细胞定位,结果显示该蛋白位于细胞核中(表3)。TMHMM及SignalP预测BcVIL2蛋白跨膜结构域及信号肽,结果显示该蛋白无跨膜结构域、无信号肽,属于膜外非分泌蛋白(图3-A、3-B)。NetNGlyc及NetPhos预测BcVIL2蛋白糖基化与磷酸化位点,结果表明该蛋白含有1个潜在的糖基化位点(第48位:NLTK;概率为78.81%;图3-C);59个潜在的磷酸化位点和蛋白激酶结合位点,其中33个丝氨酸位点、20个苏氨酸位点、6个酪氨酸位点(图3-D)。

图3 BcVIL2跨膜结构(A)、信号肽(B)、糖基化位点(C)与磷酸化位点(D)预测Fig.3 Transmembrane structure (A), signal peptide (B), N-glycosylation potential site (C) and phosphorylation potential site (D) prediction of BcVIL2 protein

表3 BcVIL2蛋白亚细胞定位预测
2.3 BcVIL2基因蛋白结构预测
利用SOPMA在线工具预测BcVIL2蛋白二级结构,结果显示该蛋白由α-螺旋(53.36%,230个aa)、β-转角(4.64%,20个aa)、延伸链(4.41%,19个aa)及无规则卷曲(37.59%,162个aa)组成(图4-A),表明该蛋白主要以α-螺旋及无规则卷曲为主。利用SWISS-MODEL,以5z28.1.A蛋白(AtVAL2 PHD-Like domain)为模板,构建BcVIL2蛋白三级结构(122~212位氨基酸),序列覆盖度为18%,一致性为28.21%,相似度为36%(图4-B),表明BcVIL2蛋白为PHD蛋白家族。

二级结构:蓝色为α-螺旋,紫红色为无规则卷曲,青色为β-转角,红色为延伸链。The second structure: Blue is alpha-helix, purple red is random coil, cyan is beta-turn and red is extended strand.图4 BcVIL2氨基酸二级(A)与三级(B)结构预测Fig.4 The second (A) and tertiary (B) structure prediction of BcVIL2
2.4 BcVIL2基因表达分析
BcVIL2基因在根中表达最低,在荚中表达最高,而叶中表达量显著低于茎和花中的表达量(图5-A)。为研究BcVIL2基因应答春化的表达情况,本研究对1月苗龄(四叶一心)植株进行低温春化,利用转录组测序技术及荧光定量PCR技术分析该基因的表达水平,其结果均显示BcVIL2基因的表达水平在春化后显著降低,但该基因在春化后期的表达水平差异不显著(图5-B)。
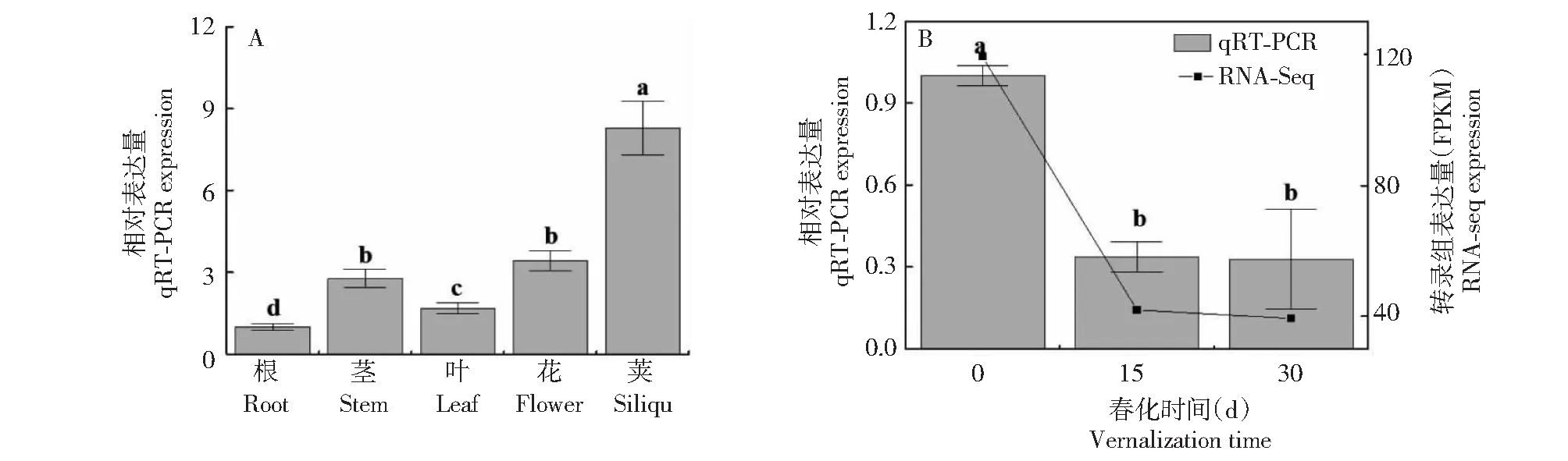
字母不同表示Duncan’s多重比较在P<0.05水平上差异显著。下同。Different lowercase letters indicate significant difference between different groups by Duncan’s new multiple rang test at P<0.05 level. The same as below.图5 BcVIL2基因表达分析Fig.5 Expression analysis of BcVIL2
2.5 BcVIL2基因蛋白互作网络分析
为进一步研究BcVIL2基因的功能,利用STRING数据库构建了BcVIL2蛋白互作网络(图6-A),表现出复杂的相关性;10个可能与BcVIL2蛋白互作的基因,均为春化反应相关基因(表4)。利用转录组数据分析,检测到共有4个基因(BraA08g012100.3C、BraA01g032910.3C、BraA10g016160.3C、BraA05g026410.3C)具有表达差异性(图6-B);对其应答春化表达情况进行分析,发现BraA08g012100.3C基因随春化时间延迟,其表达量持续降低(图6-C),而BraA01g032910.3C、BraA10g016160.3C与BraA05g026410.3C基因随春化时间延长,其表达量均先上升后下降(图6-D~6-F)。

图6 BcVIL2基因蛋白互作网络(A)及其互作基因表达(B~F)分析Fig.6 Analysis of protein-protein interaction network (A) of BcVIL2 gene and their expression levels (B-F)

表4 乌菜BcVIL2蛋白互作基因分析
3 讨 论
适当的开花时间是开花植物繁殖成功的关键[18]。乌菜属于两年生冬性白菜类蔬菜作物,低温春化是诱导乌菜抽薹开花的主要途径之一,但秋冬季节低温春化极易导致其未熟抽薹,严重影响产量与品质。本研究根据全长转录组数据,挖掘出乌菜春化调控途径中的一个关键基因VIL2;利用同源克隆技术,从乌菜中克隆出BcVIL2基因,该基因ORF为1269 bp,编码431个氨基酸,含有一个PHD-Finger保守结构域,亚细胞定位预测于细胞核中。该蛋白二级结构主要由α-螺旋(53.36%)与无规则卷曲(37.58%)组成。预测BcVIL2蛋白含有1个潜在的N-糖基化位点,但由于无信号肽,该蛋白不太可能被糖基化。据报道,水稻OsVIL1基因可被qGL3(编码一种水稻蛋白磷酸酶)去磷酸化[10]。本研究预测BcVIL2蛋白含有大量的磷酸化位点,表明该基因在行使功能过程中可被磷酸化。多重序列比对与系统进化树分析显示,乌菜BcVIL2与白菜、甘蓝、黑芥等芸薹属植物VIL2序列具有很高的相似度,并与芥菜、萝卜等植物的VIL2蛋白聚为一类,表明BcVIL2基因在进化上具有较高的保守性。
VIN3-LIKE1基因家族成员有VIN3、VIL1、VIL2、VIL3、VIL4,属于PHD-Finger基因家族,均含有PHD-Finger结构域[7],PHD锌指结构蛋白可使相关染色质的空间结构发生改变,从而使相关基因表达沉默。其中,VIN3基因是春化过程中的重要基因,低温春化可诱导VIN3基因表达,与PRC2结合甲基化H3K9与H3K27组蛋白,从而抑制FLC基因表达[9-11],最终促进植物开花。VIL1基因不仅可以调控FLC基因的表达,还可以调控FLC同源基因FLM的表达。VIL1基因依赖VIN3与PRC2结合,春化结束后,VIL1接替VIN3继续修饰FLC与FLM染色质,抑制其表达[19]。VIL1与VIL2不仅与低温春化有关,还与光周期有关,拟南芥vil2突变体只在短日照条件下延迟开花时间[12],而水稻vil2突变无论在短日照还是长日照条件下,均表现出晚开花[20]。此外,VIL2基因在非诱导光周期下是维持MAF5表观遗传抑制状态所必须的[12]。VIN3、VIL1与VIL2均与春化过程密切相关,但他们响应春化反应模式却不相同。VIN3基因只在春化过程中表达,随春化时间延长,其表达量逐渐升高,但在较长的冷环境条件下不能继续上调[7]。申浩冉等[21]报道不结球白菜BcVIL1基因的表达与品种相关,其表达量在PC-175材料的春化过程中维持较高水平。拟南芥中,VIL2mRNA和蛋白质水平均与光周期变化相关[12]。但在长时间低温过程中,VIL2基因的表达量逐渐降低。本研究中,BcVIN2基因低温春化后的表达量显著低于春化前。本研究还分析了前人3份白菜材料(JWW、XBJ、4004)春化转录组数据[22-23],结果显示BcVIN2基因在春化前后的表达变化与本结果一致,表明白菜类蔬菜中VIL2基因在春化过程中可能行使与VIN3、VIL1基因不同的功能。
VIN3-LIKE1家族蛋白可相互作用,或与PRC2形成复合体,富集在特定染色体位置,调控相应目的基因的表达。水稻中OsVIL1~OsVIL4蛋白在酵母系统中可相互作用;其中OsVIL2蛋白与组蛋白H3和OsEMF2b (水稻PRC2的一个组成部分)形成复合物,修饰H3K27me3,通过抑制FUSCA3-LIKE1(OsLFL1)的表达,诱导水稻开花[20, 24]。本研究中,利用STRING数据库及转录组分析,共获得4个可能与BcVIL2互作的差异表达基因;KEGG分析发现,BraA08g012100.3C为VRN2基因,BraA01g032910.3C与BraA05g026410.3C为FIE1家族基因,均是多梳蛋白家族基因[25];而BraA10g016160.3C为组蛋白结合蛋白MSI1基因,是组蛋白脱乙酰酶复合物的一部分[26],这4个基因均可相互作用,参与染色质修饰,但与BcVIL2蛋白的互作功能,需要进一步分析。
4 结 论
乌菜VIL2基因ORF长为1296 bp,属于亲水性蛋白,预测含有多个磷酸化位点,与芸薹属植物VIL2基因具有较高的同源性;该基因在春化过程中表达量降低,且可能与BraA08g012100.3C、BraA01g032910.3C、BraA10g016160.3C、BraA05g026410.3C等存在互作关系,共同调控抽薹开花时间。

