产胞外多糖的海洋动物共附生细菌的分离及生物学活性分析
项燕华,覃美玲,李宜海,何秀苗
(广西民族大学海洋与生物技术学院/广西多糖材料与改性重点实验室,南宁 530006)
【研究意义】胞外多糖(Exoplysaccharide,EPS)是微生物分泌到细胞壁外且具有多种生物活性的多糖化合物[1-2],具有抗肿瘤[3]、抗氧化[4]、抗生物膜[5]、免疫调节[6]等生物学活性,同时还能稳定膜结构而保护细胞免受外部环境压力,并具有碳和能量储备的作用[7]。海洋环境的高盐、高压和高温等特殊性使得海洋微生物产生的代谢物在化学结构上具有多样性[8],而不同的环境条件会影响EPS的含量和质量[1]。海洋共附生微生物是海洋微生物的重要类群,其EPS特殊的化学结构和功能已引起学界广泛关注[9]。【前人研究进展】近年来,国内外学者已对不同海域微生物EPS活性进行了大量研究。Arena等[10]从地中海中筛选的海洋耐热地衣芽孢杆菌产生的EPS-1可能通过触发有利于Th1亚群的极化改善人外周血单个核细胞(PBMC)对病毒感染的免疫监测;Sandrine等[11]发现海洋假交替单胞菌产生的EPS衍生物对骨肿瘤具有抗转移性;Hassler等[12]从远洋南大洋中分离到的海洋假交替单胞菌EPS可延长生物有效铁在透光带的停留时间,从而维持和控制南大洋等海域的初级生产力;Wu等[13]从东海沉积物中分离出1株斯氏假单胞菌不仅能有效抑制生物膜的形成,而且能分散已形成的生物膜。可见海洋细菌EPS在医疗和生态等方面具有良好应用前景。针对广西海域内微生物EPS的研究,王松柏[14]从广西北部湾红树林海泥中筛选到的海洋短小芽孢杆菌EPS对Hep-2癌细胞系具有高抑制率;房耀维等[15]从连云港海域筛选获得1株产高抗氧化活性EPS的枯草芽孢杆菌;龙寒等[16]在广西北部湾红树林中分离获得产EPS的芽孢杆菌和弧菌均具有明显免疫增强活性和抗肿瘤细胞生长活性。【本研究切入点】广西北部湾近海海域独特的地理位置和气候决定了微生物所产EPS可能具有特殊性,但针对该海域内的共附生微生物产EPS的生物学活性研究鲜有报道。【拟解决的关键问题】对广西北部湾海域一些海洋动物体内和体表产EPS的共附生微生物进行分离鉴定,并对其所产EPS的抗氧化活性和抗病毒活性进行初步研究,以期对广西北部湾近海海域海洋共附生微生物资源的开发利用提供参考依据。
1 材料与方法
1.1 试验材料
1.1.1 试验样品和病毒 从北部湾钦州(21°30′50″ N,108°34′30″ E)和防城港(21°31′20″N,108°39′05″ E)两处海域收集梭鱼、鲳鱼、棘鱼、日本方头鱼、梭子蟹、口虾蛄和日本沼虾。10日龄无特定病原体(Specific pathogen-free,SPF)鸡胚购自北京梅里亚维通实验动物科技有限公司;传染性法氏囊病病毒(IBDV)为广西多糖材料与改性重点实验室保存,经测定鸡胚半数感染量(EID50)为5×10-6mL。
1.1.2 试剂和引物 DNA Marker、Taq酶、1,1-二苯基-2-三硝基苯腆(DPPH)、TRIzon总RNA提取试剂和qPCR SYBR Green Master Mix等购自康为世纪生物科技有限公司,超薄DNA产物纯化试剂盒购自天根生化科技有限公司,2216E培养基购自索莱宝生物科技有限公司,其他试剂均为国产分析纯。16S rDNA扩增引物27F/1492R参照赵雅慧等[17]的引物序列,IBDV病毒载量扩增引物参考何秀苗等[18]的引物序列。
1.2 试验方法
1.2.1 产EPS细菌的筛选和多糖含量测定 无菌采集供试鱼的鳃、肠胃、表皮鳞片,虾的壳和虾线,蟹的外壳,研磨后分别装入2216E液体培养基中,于30 ℃ 180 r/min摇床培养24 h。取上层培养液用灭菌生理盐水梯度稀释,取适当稀释液涂布于LB固体培养基上,30 ℃倒置培养24 h。把具有黏性的菌落作为产EPS的潜在生产者,根据黏液比色法[19],将初筛菌株接种到2216E培养基中,30 ℃培养48 h。然后通过苯酚硫酸法[20]检测EPS含量,首先按照徐汪伟等[21]的方法制作葡萄糖标准曲线,然后采用醇沉法[22]提取EPS,加入蒸馏水制成1.0 mg/mL多糖母液,使用时取0.5 mL多糖溶液加水补至2.0 mL,并加入1.0 mL 5%苯酚溶液和5.0 mL浓硫酸,混匀后沸水浴20 min。利用酶标仪测定OD490,重复3次并取平均值,按标准曲线计算多糖含量。
1.2.2 菌株16S rDNA序列测定和序列分析 取菌液1.0 mL于1.5 m LEP管中,100 ℃沸水水浴15 min后以12 000 r/min离心5 min,上清液用于PCR扩增。PCR扩增反应总体系:2×TaqMix 12.5 μL,DNA模板4.0 μL,上、下游引物各2.0 μL,加4.5 μL ddH2O补足至25.0 μL。扩增程序:94 ℃预变性 3 min;94 ℃ 1 min,50 ℃ 1.5 min,72 ℃ 3 min,进行30个循环;72 ℃ 延伸6 min。PCR扩增产物进行琼脂糖凝胶电泳检测,测序由武汉奥科鼎盛生物科技有限公司完成。结果通过SeqMan软件进行拼接后输入EzBioCloud网站(www.ezbioclound.net)进行序列比对,最后用MEGA X构建系统发育进化树。
1.2.3 DPPH自由基清除率测定 参照李伟等[23]的方法,称取7.9 mg DPPH,加入无水乙醇配置成0.0079%的DPPH母液备用。取5 mL试管18支,分成3个试验组(每组6支),分别是①试验组:1.0 mL浓度为0.5 mg/mL的EPS溶液+1.0 mL DPPH溶液,②对照组:1.0 mL蒸馏水+1.0 mL DPPH溶液,③空白组:1.0 mL浓度为0.5 mg/mL的EPS溶液+1.0 mL无水乙醇。各组试管分别置于常温恒温培养箱中,黑暗静置30 min,收集上清液,用酶标仪测定517 nm处的吸光值。重复3次,结果取平均值。
DPPH清除率(%)=[1-(Ai-Aj)/Ac]
式中,Ai代表试验组数值,Aj代表空白组数值,Ac代表对照组数值。
1.2.4 抗病毒活性检测 首先测定EPS对鸡胚的安全浓度,经测定,EPS浓度为25 mg/mL时对鸡胚无毒性作用;然后将纯化EPS用无菌去离子水溶解配制成50 mg/mL溶液,并与不同滴度的IBDV溶液等体积混合备用,接种剂量0.2 mL/只,如表1所示。取10日龄SPF鸡胚72枚平均分为3大组,每大组IBDV的滴度不同,其接种作用方式分为3种:IBDV和EPS混合后直接接种、IBDV和EPS混合后37 ℃孵育2 h后接种、IBDV直接接种,每种接种方式8枚鸡胚,接种途径为绒毛尿囊膜途径。接种后每天观察鸡胚活力,去除24 h内死亡的鸡胚,记录死亡鸡胚,如鸡胚不死,则分别于84 和120 h收获鸡胚绒毛尿囊膜,IBDV的病毒载量测定参照何秀苗等[18]建立的IBDV荧光定量RT-PCR检测方法。

表1 EPS抗病毒株活性试验方案
1.3 统计与分析
试验数据采用 GraphPad Prism5 和Excel 2016进行处理与统计分析。
2 结果与分析
2.1 产EPS细菌筛选结果及代表菌株多糖产量
从北部湾近海地区采集到的梭鱼、鲳、棘鱼、日本方头鱼、梭子蟹、口虾蛄和日本沼虾7种海洋生物样品中共获得37株产EPS海洋细菌。绘制葡萄糖标准曲线:Y=0.0074X+0.0153,R2=0.9979(图1-A),测得EPS含量差异明显的菌株结果如图1-B所示,其中,菌株15G2-7(蕈状芽孢杆菌)产糖量最高,为2.5013 mg/mL,其次是17I1-6、15D1-3和15D1-4。EPS产量大于1.000 mg/mL的菌株共4株,占总测菌株数的25.00%,EPS产量大于0.500 mg/mL的菌株共有11株,占总测菌株数的68.75%,有31.25%的菌株EPS产量介于0.500~0.100 mg/mL。
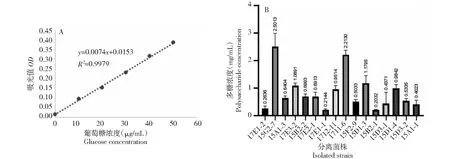
图1 代表菌株EPS产量测定Fig.1 Determination of the EPS yield of the representative strains
2.2 代表菌株16S rDNA序列扩增
结合菌落颜色、大小与细菌形态等特征,选取28株差异显著的产EPS菌株作为代表株进行16SrDNA扩增,结果表明28株代表菌株均能得到1500 bp单一条带(图2)。

M:DL5000 DNA Marker;1:阴性对照;2~5:菌株15F2-9、15H1-5、17I2-11和 15D3-2。M:DL5000 DNA Marker;1:Negative control;2-5:Strains 15F2-9,15H1-5,17I2-11 and 15D3-2.图2 部分代表菌株16S rDNA序列的扩增结果Fig.2 Electrophoretic result of amplification of 16S rDNA sequence of some representative strains
2.3 基于16S rDNA序列的细菌分类
28株代表菌株的16S rDNA序列经过EzBioCloud网站的统计分析,如表2所示,分离菌株分别属于黄杆菌纲(1株)、芽孢杆菌纲(14株)和γ-变形菌纲(13株)3个纲。在黄杆菌纲中,有1株属于黄杆菌目黄杆菌科类香味菌属。在芽孢杆菌纲中,有12株属于核衣细菌目芽孢杆菌科芽孢杆菌属,1株属于微小杆菌科微小杆菌属,1株属于核衣细菌科动性球菌属。在γ-变形菌纲中,有7株属于肠杆菌目摩根菌科普罗威登斯菌属,6株属于弧菌目弧菌科弧菌属。芽孢杆菌属占代表菌株的42.86%,为优势菌株,普罗威登斯菌属(25.00%)和弧菌属(21.43%)次之。

表2 代表菌的16S rDNA序列经过EzBioCloud比对结果
将28株产EPS的代表菌株进行分类后,选取与代表菌株16S rDNA序列相似度最高种的标准株进一步比对,根据16S rDNA序列相似度评判标准[24],可将代表菌株分为10种(表2),其中,15G2-7等10株为蕈状芽孢杆菌,17E3-2和15B2-2为巨大芽孢杆菌,17E2-1为海岸微小杆菌,17E1-1为柠檬色游动球菌,15D1-1-1等4株为日本弧菌,15D3-2为溶藻弧菌,15A1-1为海类香味菌,15G2-5等7株代表菌株与普罗威登斯菌分别属于同一属,但只有6株与普罗威登斯菌的相似度超过99.00%,属于同一种;而17I1-6与普罗威登斯菌同属不同种;15D1-3与需钠弧菌属于同一种。
2.4 代表菌株16S rDNA的系统发育进化树
结果显示28株产EPS的海洋细菌可分为3大分支,分属于3个纲(图3),遗传距离在0.050上又可细分为普罗威登斯菌属、弧菌属、微小杆菌属、动性球菌属、芽孢杆菌属和类香味菌属6大聚类。其中15F2-9等7株菌与普罗威登斯菌属聚为一类,15D1-3等6株菌与弧菌属聚为一类,17E2-1与微小杆菌属聚为一类,17E1-1与动性球菌属聚为一类,15B2-2等12株菌与芽孢杆菌属聚为一类,15A1-1与类香味菌属聚为一类,遗传进化分析结果与细菌分类结果一致。
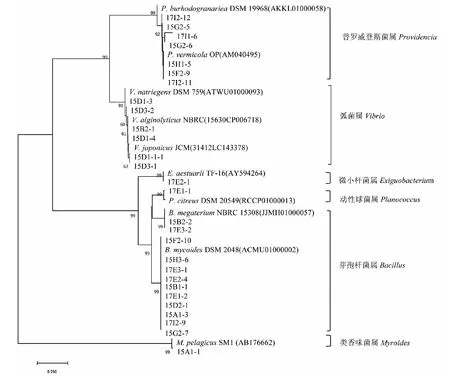
图3 代表菌株16S rDNA序列的系统发育进化树Fig.3 The phylogenetic tree of the representative strains based on 16S rDNA sequence
2.5 EPS抗氧化能力测试
对2.1中产EPS差异明显的菌株进行DPPH清除能力试验,结果(表3)表明,3株蕈状芽孢杆菌(17E1-2、15G2-7和15A1-3)的EPS对DPPH的清除率为66.50%~81.73%,2株巨大芽孢杆菌(17E3-2和15B2-2)的EPS对DPPH的清除率分别为94.54%和91.71%,海岸微小杆菌17E2-1和柠檬色游动球菌17E1-1的EPS对DPPH的清除率分别为90.15%和78.10%,3株普罗威登斯菌(17I2-11、17I1-6和15F2-9)的EPS对DPPH的清除率为11.37%~53.10%,需钠弧菌15D1-3的EPS对DPPH的清除率为96.85%,3株日本弧菌(15D3-1、15D1-4和15B2-1)的EPS对DPPH的清除率为52.73%~93.41%,溶藻弧菌15D3-2的EPS对DPPH的清除率为91.71%,海类香味菌15A1-1的EPS对DPPH的清除率为86.06%。其中对DPPH清除率最高的为需钠弧菌15D1-3,达96.85%,其次是巨大芽孢杆菌17E3-2(94.53%),再次是日本弧菌15D1-4(93.41%),不同属之间、同属不同种之间菌株EPS对DPPH的清除能力有明显差异。

表3 代表菌株EPS对DPPH的清除率
2.6 EPS抗IBDV活性测试
由于芽孢杆菌15G2-7所产EPS含量高,但抗氧化活性较低,因此对其抗IBDV活性进行进一步检测。从图4可看出,在接种后84 h,IBDV与EPS混合后直接接种或IBDV与EPS混合后37 ℃孵育2h接种的鸡胚绒毛尿囊膜上的病毒载量均显著低于IBDV直接接种组(P<0.05),而在接种后120 h,仅IBDV与EPS混合后直接接种组的鸡胚绒毛尿囊膜病毒载量显著低于IBDV直接接种组,而IBDV与EPS混合后37 ℃孵育2 h接种组的病毒复制未受到抑制,说明EPS对鸡胚绒毛尿囊膜上IBDV的早期复制具有抑制作用。
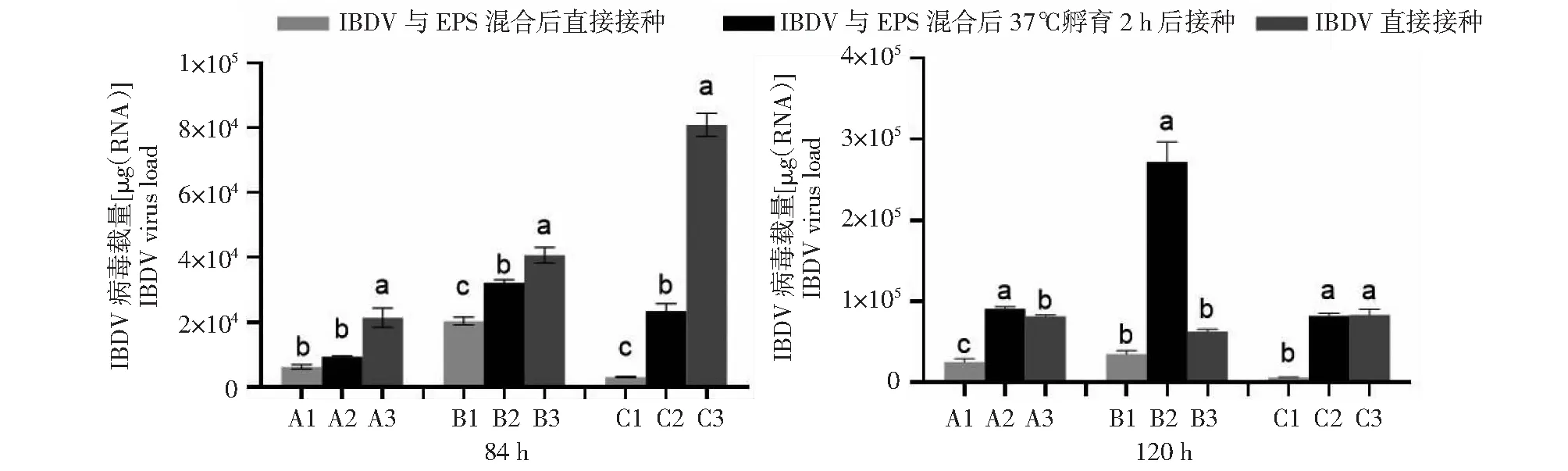
A: IBDV病毒载量为1×103 EID50; B: IBDV病毒载量为1×104 EID50; C: IBDV病毒载量为1×105 EID50。图注上不同小写字母表示不同组之间差异显著(P<0.05)。A: IBDV virus load was 1×103 EID50; B: IBDV virus load was 1×104 EID50; C: IBDV virus load was 1×105 EID50. Different lowercase letters indicated significant difference among treatments(P<0.05).图4 EPS抑制IBDV在鸡胚绒毛尿囊膜上的增殖结果Fig.4 The inhibition of IBDV replication on chorioallantoic membrane of chicken embryo by EPS
3 讨 论
目前,已有学者分别从北部湾海域的光裸方格星虫[25]、海参[26]、海绵[27]等海洋动物中分离鉴定出不同种属共附生细菌,并对分离菌株的生物学活性进行了研究,然而,这些研究涉及的海洋动物种类仍然有限。北部湾海域具有丰富的海洋动物资源,海洋环境复杂,其共附生菌多样性及其活性有待进一步挖掘。本研究从北部湾钦州和防城港附近海域采集到的鱼虾蟹样品中分离出37株产EPS共附生海洋细菌,16S rDNA序列分析结果表明,这37株菌株隶属于3个纲4个目6个科6个属10个种,其中以芽孢杆菌属为优势分离菌株,其次为普罗威登斯菌属、弧菌属、微小杆菌属、动性球菌属和类香味菌属,表明北部湾近岸海域中产EPS的海洋细菌广泛分布于海洋动物共附生微生物群落中,具有丰富的多样性,其中以芽孢杆菌属为优势菌属。同时发现,不同种类菌株产EPS的能力存在明显差异,其中15G2-7菌株(蕈状芽孢杆菌属)产EPS能力较高,为2.5013 mg/mL,高于已报道的一些菌株[20],具有进一步利用潜力。在生物学活性研究中,这些菌株的EPS均具有一定抗氧化活性,但不同属之间、同属不同种之间菌株产EPS对DPPH的清除能力具有明显差异,产糖量较高的菌株15G2-7所产EPS还具有抑制IBDV在鸡胚绒毛尿囊膜上复制的能力。本研究结果进一步丰富了北部湾海域海洋动物共附生菌及其产EPS能力多样性和生物学活性资源,并为其进一步开发应用提供了参考依据。
抗氧化活性是多糖的重要特性之一,很多研究已证实细菌产EPS具有较高抗氧化活性[28-29]。本研究从北部湾近海海洋动物共附生微生物中分离的EPS体外抗氧化活性结果与陈博文等[24]在北部湾近海海水、海沙和红树林泥土中分离到的菌株抗氧化活性检测结果一致,即不同来源的海洋细菌,其EPS均表现出不同高抗氧化活力,进一步证实北部湾近海海洋动物共附生微生物产EPS在抗氧化活性上的优势,其中需钠弧菌15D1-3抗氧化活性最高,但其在体内的抗氧化活性有待进一步验证。
多糖的抗病毒活性及其免疫增强活性早就被学者关注。本研究发现了1株EPS产量较高的芽孢杆菌菌株15G2-7,其EPS的抗氧化活性仅为66.50%,但具有抑制IBDV在鸡胚上复制的能力。IBDV是传染性法氏囊病(IBD)的病原,IBD是一种危害3~6周龄鸡的急性、高传染性和免疫抑制性家禽疾病,病毒主要攻击鸡的免疫器官,引起免疫抑制,一旦感染,会给养禽业带来巨大经济损失[30]。一些学者已发现植物多糖具有降低IBDV的免疫抑制、在鸡胚成纤维细胞(CEF)上抑制IBDV感染和阻断IBDV吸附靶细胞等作用[31-33],但细菌产EPS对IBDV复制的抑制能力鲜有报道。基于细菌产EPS相较于植物多糖更易于生产和纯化的优势,在动物饲料被禁用抗生素作为添加剂的背景下,其在畜牧生产中具有广阔应用前景。本研究结果为开发海洋细菌多糖用于病毒病防控研究提供了参考依据,但15G2-7菌株EPS抑制IBDV复制的机制及其对其他病毒的抑制能力有待进一步探究。
4 结 论
从北部湾近海海洋动物共附生细菌中共分离鉴定出3纲4目6科6属10种产EPS的海洋细菌,芽孢杆菌属为优势菌株;不同种属菌株的EPS均具有一定的抗氧化活性,EPS产量较高的芽孢杆菌其EPS具有抑制IBDV复制能力。研究结果为开发利用北部湾海洋动物中产EPS的共附生细菌资源提供了借鉴,丰富了北部湾产EPS的共附生微生物资源库,从菌株中提取具有高抗氧化活性的EPS及EPS产量较高的芽孢杆菌可能在制药、医疗、健康和环境保护等领域具有开发价值。

