不同术式治疗T1a期声门型喉癌的嗓音功能评估
王燕 屈季宁 周涛 华清泉 雷薇薇 舒婧
早期声门型喉癌可分为Tis、T1aN0M0及T1bN0M0,其治疗方式包括支撑喉镜下CO2激光治疗、放疗、喉裂开肿瘤切除[1,2]。对于T1期声门型喉癌,不同的国家和地区,治疗方式的选择差异较大,有众多因素需要考虑,包括治愈率、复发率、治疗后的嗓音质量、当地的医疗水平及患者的社会经济状况等[3]。近年来,在支撑喉镜、显微镜及内镜的辅助下,应用CO2激光、低温等离子刀切除肿瘤已逐渐成为临床治疗早期声门型喉癌的常用术式,可将病灶完整切除,有效保留患者喉部正常解剖结构及生理功能,且具有创伤小、易恢复等特点。文献报道CO2激光、开放性手术、放疗治疗早期喉癌的患者之间生存率和复发率无差异[4]。随着生活水平不断提高,在不同治疗方式的生存率及复发率基本相同的情况下,患者的嗓音质量成为选择治疗方式时的重要考虑因素[4,5]。本文比较采用CO2激光和低温等离子刀治疗T1aN0M0期声门型喉癌患者术后嗓音恢复情况,以期更好地为临床手术方案的选择提供参考。
1 资料与方法
1.1研究对象及分组 回顾性分析2017年1月~2019年12月期间武汉大学人民医院耳鼻咽喉头颈外科收治的42例T1aN0M0期声门型喉癌患者,均为男性,年龄44~72岁,中位年龄53.3岁。纳入标准:术前检查确诊为喉鳞状上皮细胞癌;术前均有声嘶症状,经电子喉镜检查、喉部CT、颈部淋巴结检查、活检明确诊断为声门型喉癌T1aN0M0期(临床分期);术前无其他肿瘤及放化疗史,无重大系统性疾病。患者均行电子喉镜、动态喉镜及窄带光检查,以观察肿瘤的范围、声带活动情况,确认前连合是否受累。根据病变范围,按内镜下声带切除术分类标准指南(欧洲喉科学会工作委员会推荐),40例患者采用Ⅲ型手术,2例采用Ⅳ型手术。分为2组,A组20例采用低温等离子射频消融术治疗,B组22例采用CO2激光切除术治疗。
1.2治疗方法 A组:经口插管全身麻醉后,置入支撑喉镜,在高分辨手术显微镜 (德国Leica,MS3)下,应用等离子射频仪及喉等离子刀(美创403型)进行手术。根据肿物所在位置,自肿物基底部外约3 mm处开始切除肿物及部分声带;整块切除肿物后,取切缘组织送检冰冻病理检查,如发现肿瘤细胞则进一步进行切除,直至切缘阴性为止。彻底止血,患者清醒后即拔管,术后给予雾化吸入及抗生素治疗3~5 d,禁声1周。
B组:经口插入气管套管,置入支撑喉镜,高分辨手术显微镜(德国Leica,MS3)与CO2激光机(科医人40C)耦连,取湿纱布覆盖气管插管气囊表面,设置CO2激光器功率为2.5 W,工作模式为连续脉冲,沿肿瘤区域外沿切除肿瘤及其周边组织,将距肿瘤周边3 mm区域视为安全边缘,于切取边缘前、后、外侧、深部各部位分别钳取活体组织制作冰冻切片,直至切缘病理检查结果呈阴性。
1.3术后嗓音功能评估 手术前及术后3、6、9、12个月应用嗓音障碍指数VHI-10、听感知评估GRABS及多维嗓音分析对患者嗓音功能进行评估,动态喉镜检查观察声带形态及黏膜波。
1.3.1主观自我评估问卷调查 问卷调查采用嗓音障碍指数VHI-10(voice handicap index-10)量表。VHI-10量表由功能(function,F)、生理(physically,P)和情感(emotion,E)3个范畴的10个条目组成,每一条目的内容是患者对自己嗓音的主观感受描述。每一条目分0~4的五个分值:0代表从未出现,1代表几乎没有,2代表有时出现,3代表几乎经常出现,4代表经常出现,由患者根据自己的感受选择。每一范畴的分数就是10个条目分数的总和,从0(无影响)到40(严重影响),总分(TVH)是三个范畴分数的总和,分数越高嗓音障碍越严重。
1.3.2主观听感知评估 三位从事嗓音医学专业的专家担任听评委。采用国际通用、由日本言语语音学会制定的嗓音嘶哑GRBAS分级法中的总嘶哑度(G)作为嗓音质量的主观评估指标。
1.3.3客观嗓音声学分析 多维嗓音分析软件(MDVP 5105,Kay Elemetric公司,美国)采集患者声样,患者以自己最习惯的音调及响度发长元音/a/3次,每次持续约3~5 s。应用MDVP软件分析声样,分别读取中部声样的基频(F0)、基频微扰(jitter)、振幅微扰(shimmer)和噪谐比(NHR)。
1.3.4动态喉镜检查 动态喉镜检查观察患者的声带形态、声门闭合情况、声带运动的对称性、声带黏膜波、振动的规律性,由2位资深医师分别对每例患者治疗前后的动态喉镜检查指标评分(Hirano等,1993),声带闭合情况分为1~5分:1分为完全闭合,5分为完全不能闭合。声带黏膜波分为1~5分:1分为正常,5分为完全没有黏膜波。对称性1~4分,1分为正常,4分为振动总不对称。振动周期规律性分为1~4分:1分为正常,4分为总是不规律。取两位检查者各项评分的平均值作为患者最终得分。创面黏膜恢复评分:创面伪膜于1周内脱落,黏膜呈光滑状态为1分,2周内脱落为2分,3周内脱落为3分,4周内脱落为4分,4周内未脱落为5分。
1.4并发症发生率 通过体征观察、喉镜检查等记录患者咳血、感染、呼吸困难等发生情况。
2 结果
42例患者术后病理均为鳞状细胞癌,其中高分化30例,中分化10例,低分化2例。术后均无活动性出血,无呼吸困难,住院7~10天。随访12~42个月,中位随访时间15个月,随访期间复发2例,A、B组各1例,分别为术后14个月和25个月,再次行开放性手术后至今未见复发。
2.1嗓音评估结果 多维嗓音分析结果显示,术后3个月时,两组患者的jitter、shimmer及NHR数值明显增高,随着时间推移,jitter、shimmer及NHR数值逐渐降低,到9个月以后,所有观察指标趋于稳定。两组术后9个月时的嗓音声学结果见表1,可见,与术前相比,两组患者的各项声学指标均有明显改善,F0、jitter、shimmer、NHR数值降低;两组间F0无明显差异,但A组的jitter、shimmer值更高,说明B组患者嗓音功能恢复优于A组。
表1 两组术前、术后9个月时嗓音声学分析结果
两组手术前及术后9个月时的GRBAS及VHI-10评分结果见表2,可见,与手术前相比,手术后两组患者的嗓音总嘶哑度(G)、粗糙声听感知(R)得分均下降(P<0.05),而气息声(B)、无力声(A)、紧张声(S)无明显改变(P>0.05),B组患者术后嗓音障碍程度主要为轻、中度,而A组患者术后嗓音障碍程度却主要集中在中、重度。两组患者的VHI-10值均较术前明显下降,但B组术后的VHI值优于A组。
表2 两组术前、术后9个月时GRBAS各项评分及VHI评分(分,
2.2喉镜检查结果 术后一周时电子喉镜检查见两组患者声带肿胀,创面表面有白色伪膜形成。术后1个月时声带仍有水肿,部分患者声带表面仍有少许伪膜附着。术后3个月时,两组患者喉部创面均有不同程度的肉芽形成,但B患者术后创面肉芽形成几率较大,A组术后10例(50%)患者有肉芽形成,B组术后4例(18.2%)患者有肉芽形成。两组患者术后9个月时的动态喉镜观察结果见表3,可见,与术前相比,两组患者的声门闭合情况、声带运动的对称性、声带黏膜波振动的规律性均较术前有明显改善。两组间比较,B组患者的声带运动对称性、声带黏膜波及声带振动规律性优于A组。图1显示的是其中一例患者手术前及激光手术后的喉镜表现。
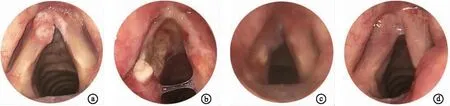
图1 B组一例患者CO2激光手术前后喉镜表现 a. 术前,肿瘤位于左侧声带前三分之一,累及前联合及右侧声带前端; b. CO2激光手术后1周,术区伪膜覆盖; c. CO2激光手术后1个月,左侧声带前三分之一见淡红色肉芽,左侧声带后端仍有部分伪膜尚未完全脱落,双侧声带仍有充血、肿胀; d. CO2激光手术后6个月,左侧声带肉芽消退,双侧声带表面光滑,前联合粘连带形成
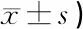
表3 两组术前、术后9个月时动态喉镜下各项观察指标评分(分,
2.3并发症发生率 所有患者无一例发生出血、感染、呼吸困难等不良反应。
3 讨论
CO2激光切除术是临床治疗早期声门型喉癌的经典微创术式,激光耦合显微镜利用高清术野清晰分辨病变组织及正常组织,高能量激光束使肿瘤组织快速气化,切割的同时具有止血功能,具有操作简便、创伤小、术后恢复快等优点[6-8]。低温等离子刀切除术是近年来治疗早期声门型喉癌的新型微创术式,其操作温度较低,能避免组织灼伤、水肿,且等离子刀头可进行大范围角度转换,利于隐蔽部位病灶切除,可有效避免病变组织残留,降低复发风险[9]。CO2激光及等离子刀治疗早期声门型喉癌疗效确切,已成为早期声门型喉癌的主要治疗方式。在治疗后生存率、局部控制率相近的情况下,术后嗓音功能成为评价早期声门型喉癌治疗效果及患者生存质量的重要指标[10,11]。马菲等[12]对比研究了低温等离子射频消融、CO2激光切除两种术式治疗早期声门型喉癌的临床效果,得出结论,低温等离子射频消融手术耗时较短,创面黏膜恢复较快,但研究未涉及二者术后嗓音功能情况。刘海鹰等[13]应用CO2激光联合低温等离子射频消融对暴露困难的早期声门型喉癌患者进行治疗,认为这种手术方式具有创伤小、恢复快、并发症少等优点。徐夏等[14]对早期声门型喉癌患者进行等离子消融术治疗后的嗓音功能进行了观察,得出结论,等离子消融术后患者嗓音质量随时间的推移逐渐好转,等离子消融术对患者正常组织的损伤介于激光手术与开放性手术之间。目前对于哪种方式治疗后患者有更好的嗓音功能,尚无定论。
本研究发现,CO2激光和低温等离子刀手术后患者喉部创面均有不同程度的肉芽形成,但低温等离子刀术后患者肉芽形成几率较大。等离子刀切割面积较CO2激光手术大,对周围正常组织的损伤大,术后肉芽形成的可能性较大。有研究表明,CO2激光治疗早期声门型喉癌的患者术后3月内嗓音质量下降,术后6个月以后患者嗓音质量较术前好转,趋于稳定[15]。本研究也观察到类似的变化,两组患者术后3个月时,jitter、shimmer及NHR数值明显增高,分析原因可能是术后3个月时,局部有肉芽形成。随着时间推移,创面逐渐修复,jitter、shimmer及NHR数值逐渐降低,到9个月以后,以上指标趋于稳定。术后9个月时,CO2激光术后患者嗓音功能恢复情况优于低温等离子刀手术后患者。本研究结果显示,CO2激光治疗组和低温等离子刀治疗组的F0均升高,可能是术后声带创面纤维化形成,声带变得僵硬,因此治疗后两组患者的F0增加,这与Luo等的研究结果一致[16]。jitter和shimmer反映嗓音信号的频率和振幅微扰,是衡量嗓音质量的重要指标;NHR是一个反映嗓音功能障碍的敏感性较高的指数。本研究观察到,低温等离子刀治疗组的jitter、shimmer和NHR值更高,主要是因为等离子刀切割面积较CO2激光大,对周围正常组织的损伤较大。
VHI是患者对自我嗓音交流能力的评估,而声学分析则揭示了声带振动的物理学特性。值得注意的是,文献报道的声学测试结果不稳定,有时甚至是矛盾的[17]。本研究中,患者手术后2周之内,因声带肿胀、伪膜附着,患者声嘶均较明显,术后1个月时随着部分伪膜脱落,声带局部消肿,声嘶症状有所缓解,嘶哑程度与手术范围及切除深度有关。术后3个月时,部分患者声带表面有肉芽形成,嗓音质量受影响。术后9个月时,两组患者的声门闭合情况、声带运动的对称性、声带黏膜波、声带振动的规律性均较术前明显改善。两组之间比较,CO2激光手术组患者的声带运动对称性、声带黏膜波振动规律性优于等离子刀手术组。与手术前相比,手术后两组患者的嗓音总嘶哑度(G)、粗糙声听感知(R)得分均下降,而气息声(B)、无力声(A)、紧张声(S)无明显改变,CO2激光手术组术后嗓音障碍程度主要为轻、中度,而等离子刀手术组术后嗓音障碍程度却主要为中、重度。两组患者的VHI-10值较术前明显下降,但CO2激光手术患者术后的VHI值优于等离子刀手术后的患者,说明CO2激光手术组术后嗓音功能优于等离子刀手术组。
本研究对患者术后不同时期的嗓音质量进行了主观评估和客观评估,较准确地反映了手术后嗓音功能的恢复情况。但本研究也有一定的局限性:在治疗方式的选择上,并没有进行随机分组,而是根据患者自己的选择来分组;本文研究对象是T1aN0M0期的声门型喉癌,然而,随着肿瘤的病变范围、浸润深度的增加,切割范围增加,术后嗓音质量越差。由于两组病例数较少,部分评估嗓音障碍程度指标的差异性难以检验,需要进一步研究。综上所述,T1aN0M0期声门型喉癌的治疗方式的选择上,从患者术后嗓音功能的角度考虑,CO2激光应作为治疗早期声门型喉癌的首选。在实际临床中,还需综合考虑肿瘤病变范围和部位,选取适当的手术方式,在彻底切除肿瘤的基础上,最大程度保留患者的嗓音功能。

