蔬菜发酵过程中亚硝酸盐对细菌群落积累量的影响
魏振勇,王严,迟雪梅,孙全敏,迟乃玉,张庆芳*
(1.大连大学 生命健康学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
亚硝酸盐是蔬菜发酵过程中产生的潜在强致癌物,存在潜在的食品安全问题,也被用作着色剂广泛应用于肉类工业,同时可防止肉毒杆菌等食源性致病菌的生长[1]。摄入大量亚硝酸盐会引起高铁血红蛋白症和急性中毒,并导致人体出现心跳过速、血脂下降等症状,还可与体内的仲胺生成致癌性极强的亚硝基化合物,出现致癌风险[2]。随着种植方法的改变与农业氮肥使用量的增加,硝酸盐在蔬菜中积累,并在发酵过程中被硝酸盐还原细菌(例如肠杆菌)还原为亚硝酸盐[3],因此,发酵蔬菜中亚硝酸盐的含量及其安全性受到广泛关注。根据研究,亚硝酸盐在食品发酵过程中能抑制各种食源性致病菌的生长[4]。
在一个发酵过程中,微生物数量庞大,菌群结构复杂多变。传统的平板计数法是获得生物群落信息最简单的方法,但有着很大的局限性,特别是因不可培养特性的微生物的存在,低估了微生物的丰度和多样性,因此采用Sanger测序和PCR-RFLP等方法对其鉴定和分类已经成为主要的研究热点[5]。其中高通量测序(HTS)技术因不仅具有高通量、高覆盖、高准确率等特点,而且可全面地揭示样本微生物群落的组成及多样性等信息,已被广泛应用于微生物群落的研究[6]。根据目前在蔬菜发酵中利用高通量测序技术对微生物群落的相关性研究大多围绕细菌群落结构差异性分析[7]、发酵蔬菜中微生物多样性和微生物群落结构分析[8-10],并利用相对丰度值对发酵中的优势菌属进行阐述。了解某些细菌类群的丰度变化对发酵食品的生物学研究具有重要意义,然而目前常用的高通量测序技术只能得到微生物群落结构的物种种类和相对丰度[11],而对相对丰度的分析忽略了不同样本之间总体微生物量存在的现实差异,也不能反映微生物群落数量和类群间样品的差异[12],造成了分析结果的偏差。有研究表明[13]微生物某一类群相对丰度比例的增加不一定真正与相应微生物类群的生长有关,可能是其他微生物类群的衰退导致其在群落结构中相对丰度比例增长。说明对微生物群落结构的分析不能仅仅考虑微生物的相对丰度,应该同时考虑微生物的总量。
基于以上因素,本研究以自然发酵与添加亚硝酸盐发酵为研究对象,监测发酵过程中的理化指标、OD600 nm值及相关细菌总数的变化,选取理化指标变化明显的4个发酵时间点和最终发酵时间15 d进行16S rRNA高通量测序,将相对丰度与发酵过程中测定的OD600 nm值的结合量化成为发酵过程中细菌群落的积累量,深入分析在蔬菜发酵过程中亚硝酸盐对细菌群落结构变化的影响,为蔬菜发酵菌剂的选择提供一定的基础,并提供一种可在一定程度上减少只参考高通量测序菌属相对丰度带来的偏差的方法,对未来蔬菜发酵菌群结构研究中采用高通量相对丰度开展相关菌群结构变化的分析具有重要的借鉴意义。
1 材料与方法
1.1 材料
1.1.1 样品来源
大白菜、食盐:辽宁省大连市大连大学服务中心超市;亚硝酸钠:上海麦克林生化科技有限公司。
1.1.2 实验试剂
硼砂、亚铁氰化钾、乙酸锌、亚硝酸钠、对氨基苯磺酸、盐酸萘乙二胺、氢氧化钠、酚酞(均为分析纯):上海麦克林生化科技有限公司;DP812 土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.2 实验仪器与设备
PHS-3E型pH计 上海仪电科学仪器股份有限公司;CRY-2112型恒温摇床 上海茸研仪器有限公司;DK-S26型电热恒温水浴锅 上海精宏实验设备有限公司;Thermo Multiskan 1510型酶标仪 芬兰Labsystems公司;AL204型电子天平 上海梅特勒-托利多仪器有限公司;UV-1200型紫外可见分光光度计 上海美谱达仪器有限公司。
1.3 实验方法
1.3.1 自然发酵
选取优质实心大白菜,去除坏叶后用自来水清洗干净并沥干表面水分;将白菜切成0.5~1 cm的均匀细丝,将切好的白菜细丝混匀;选用统一规格的555 mL小型发酵瓶若干瓶,每瓶装入160 g白菜丝(经前期实验所得160 g/555 mL白菜丝实验效果最佳);注入1.5%的盐水至满瓶,拧紧瓶盖,将全部酸菜置于25 ℃恒温培养箱中发酵。
1.3.2 添加亚硝酸盐发酵
选取优质实心大白菜,去除坏叶后用自来水清洗干净并沥干表面水分;将白菜切成0.5~1 cm的均匀细丝,注意将切好的白菜细丝混匀;选用统一规格的555 mL小型发酵瓶若干瓶,每瓶装入160 g白菜丝并添加亚硝酸钠(100 mg/L);注入1.5%的盐水至满瓶,拧紧瓶盖,将全部酸菜放置于25 ℃恒温培养箱中发酵。
1.3.3 取样
将自然发酵体系记为S体系,添加亚硝酸钠为Y体系。每瓶酸菜代表不同发酵时间点的独立发酵体系,酸菜发酵液作为研究对象,每隔12 h取出1瓶发酵菜进行理化指标(pH、NIT、TAN)及OD600 nm值的测定,至发酵结束。
1.3.4 指标测定
OD600 nm值测定:采用紫外分光光度计测定样品的吸光度,吸取适量酸菜发酵液于2 cm无菌比色杯中,用零管调节零点,以蒸馏水作为空白对照,在600 nm的紫外波长下测量吸光度。
pH测定:使用pH计对酸菜发酵液进行测定。
总酸测定:参照 GB/T 12456—2008《食品中总酸的测定》[14]。
亚硝酸盐测定:参照 GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》[15]中的盐酸萘乙二胺法测定。
细菌总数测定:参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[16]的方法,以上每个样品均3次重复。
1.3.5 16S rRNA高通量测序
根据对两个发酵体系的理化指标及OD600 nm值的分析,选取具有明显变化的5个时间点的酸菜样本,S体系分别标记为S1、S2、S3、S4、S5;Y体系分别标记为YS1、YS2、YS3、YS4、YS5;每个酸菜样本3个重复。最后将选出的样本进行16S rRNA高通量测序。按照土壤基因组DNA提取试剂盒说明书提取样本的DNA,以其为模板,采用引物对338F(5′-ACTCCTACGGGAG-GCAGCA-3)和806R(5′-GGACTACHVGGGTWTCTA-AT-3′)进行PCR扩增,PCR扩增产物委托北京百迈客生物科技有限公司完成建库测序。
1.3.6 数据分析
采用Origin 2021和Excel 2016对监测的指标进行分析和统计。
2 结果与讨论
2.1 发酵过程中OD600 nm值的变化
由图1可知,添加亚硝酸盐发酵与自然发酵相比,在发酵相同时间点其OD600 nm值低于自然发酵,说明亚硝酸盐可能抑制微生物的生长,进而影响菌群浓度。
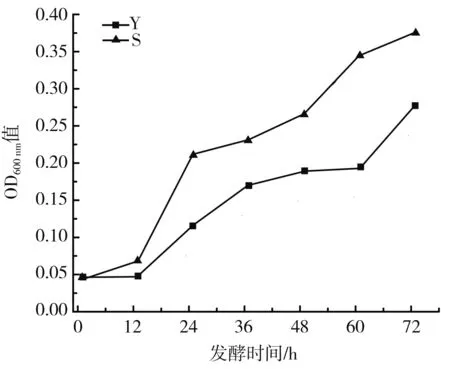
图1 发酵样品OD600 nm值Fig.1 OD600 nm values of fermented samples
2.2 理化指标
发酵过程中的pH值、总酸含量和亚硝酸盐含量变化情况见图2。
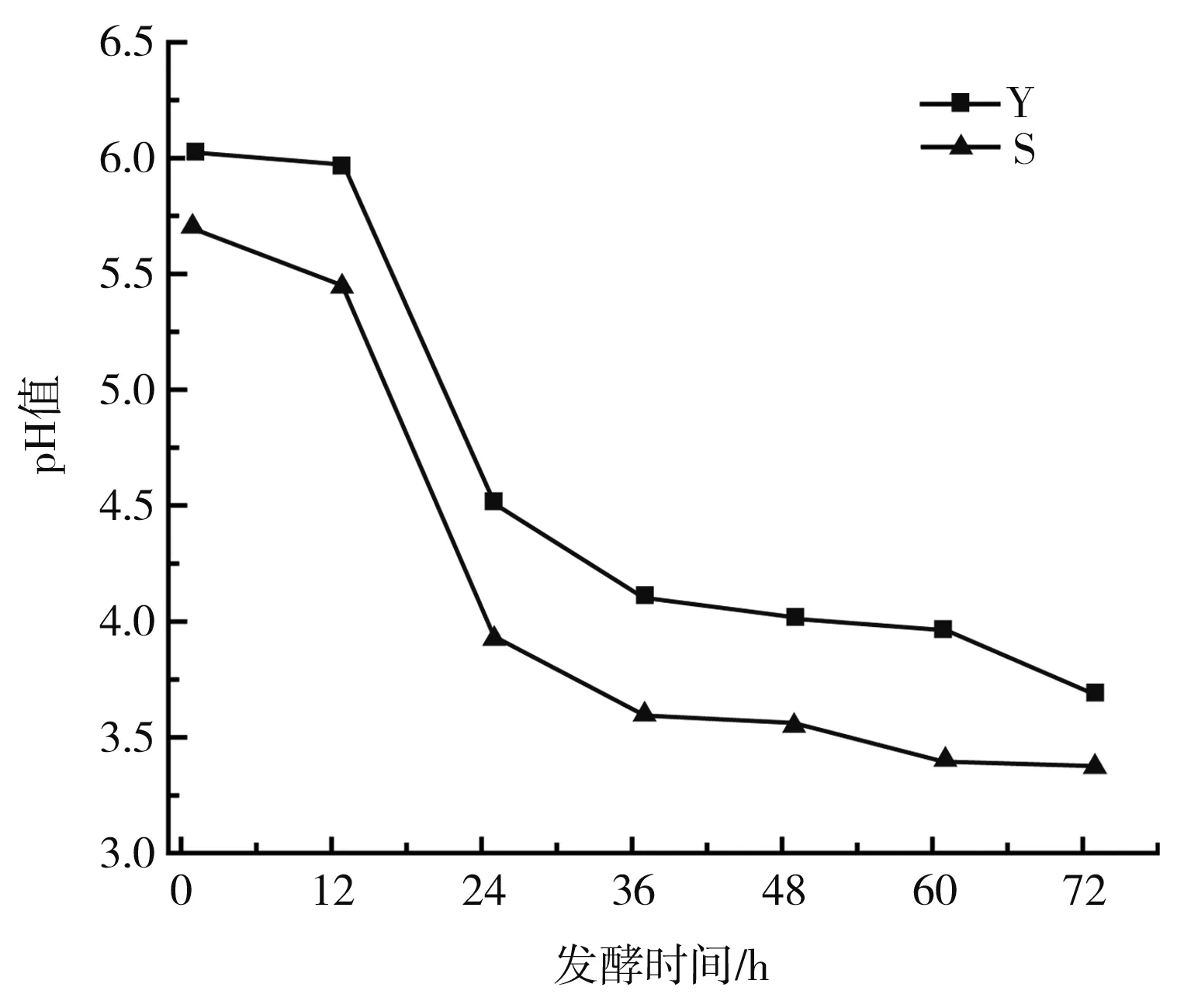
图2 发酵样品不同时间点的理化指标Fig.2 Physicochemical indexes of fermented samples at different time points
由图2可知,发酵25 h时,S体系的pH值由5.45降至3.92,Y体系的pH值由5.97降至4.51,下降趋势剧烈,此时S体系中亚硝酸盐含量达到“亚硝峰”(32.63 mg/L),Y体系中亚硝酸盐含量在25~37 h降解迅速,在37 h时降解率达到54.48%。在73 h时,S体系与Y体系的pH值均小于4.0。
2.3 发酵体系中细菌菌群结构分析
pH值是评价蔬菜发酵程度的重要指标,下降速度越快,表明蔬菜进入发酵时间越早,酸菜成熟速度也越快[17]。以pH值为主要变化指标,选取1,13,25,73 h和最终发酵时间15 d的样品进行高通量测序。
S体系与Y体系中各发酵时间点细菌菌群各分类水平见表1。

表1 样品物种数目Table 1 Number of sample species
由表1可知,两体系共含有13个门,142个属,体系间物种数目差异不大,发现添加亚硝酸盐对发酵前后期物种数目的影响不大。
2.3.1 门水平细菌菌群结构分析
门水平菌群结构见图3。体系间相对丰度排名前五的菌门中,共有菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝藻细菌门(Cyanobacteria)、拟杆菌门(Bacteroidetes)。在S体系中,相对丰度值大小为厚壁菌门>变形菌门>蓝藻细菌门>拟杆菌门;在Y体系中,相对丰度值大小为厚壁菌门>蓝藻细菌门>变形菌门>拟杆菌门。根据体系间对比,Y体系中厚壁菌门的相对丰度是S体系的1.27倍,蓝藻细菌门是S体系的1.58倍,拟杆菌门是S体系的1.04倍;S体系中变形菌门的相对丰度是Y体系的2.66倍。
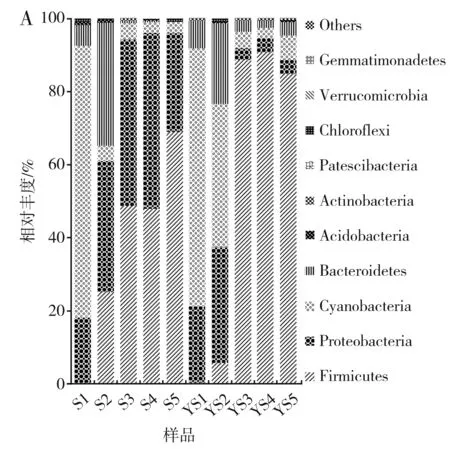
图3 门水平发酵样本(A)与体系(B)细菌菌群结构Fig.3 Structure of bacterial community of fermented sample (A) and system (B) at the phylum level
2.3.2 属水平细菌菌群结构分析
属水平菌群结构见图4。两体系间排名前十的菌属为uncultured_bacterium_f_Enterobacteriaceae、乳球菌属(Lactococcus)、uncultured_bacterium_o_Chloroplast、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、金黄杆菌属(Chryseobacterium)、Brassica_napus_rape、鞘氨醇单胞菌属(Sphingomonas)、异样根瘤菌属(Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium)、嗜甲基菌属(Methylophilus)。均有Lactococcus、Leuconostoc、Lactobacillus3种乳酸菌菌属。在S体系中,乳酸菌属的相对丰度值大小为Lactococcus>Lactobacillus>Leuconostoc;在Y体系中,乳酸菌属的相对丰度值大小为Lactococcus>Leuconostoc>Lactobacillus。体系间对比,Y体系中Lactococcus的相对丰度是S体系的1.96倍;S体系中Lactobacillus的相对丰度是Y体系的185.88倍;两体系间Leuconostoc的相对丰度值一致(7.21%)。对比排名前十的有害菌属,S体系中uncultured_bacterium_f_Enterobacteriaceae的相对丰度是Y体系的30.39倍,Chryseobacterium的相对丰度是Y体系的1.13倍。

图4 属水平发酵样本(A)与体系(B)菌群结构Fig.4 Structure of bacterial community of fermented sample (A) and system (B) at the genus level
2.4 发酵过程中细菌总数变化
由于Y体系OD600 nm值在发酵过程中始终低于S体系,因此进一步分析细菌总数与乳酸菌总数数量变化,结果见图5。Y体系在发酵过程中细菌总数与乳酸菌总数始终低于S体系,说明亚硝酸盐抑制了发酵过程中某些微生物的生长。
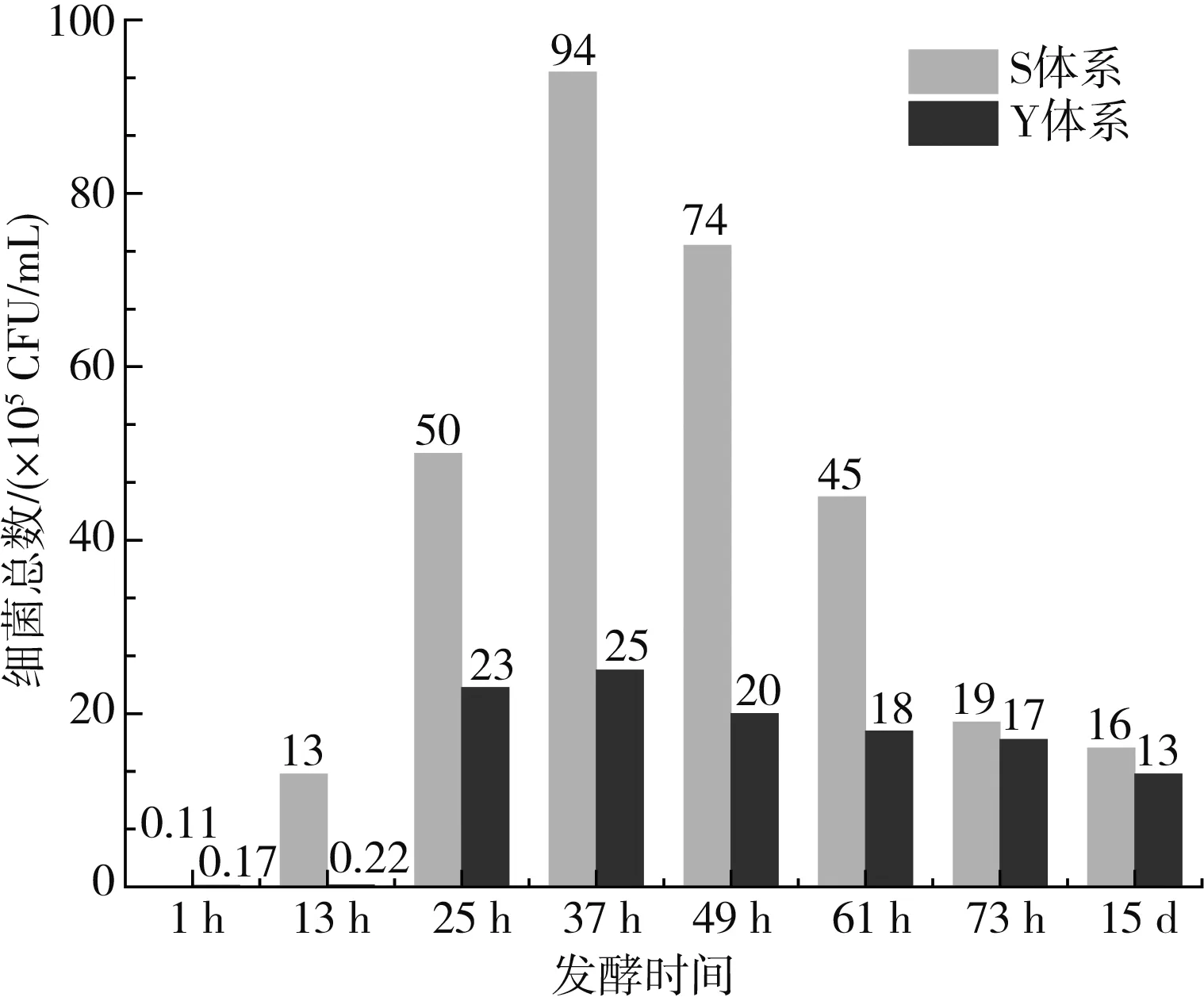
图5 发酵过程中微生物数量变化Fig.5 Change of microbial quantity in fermentation process
2.5 发酵体系中群落积累量变化与相对丰度的关系
只利用高通量测序结果中的相对丰度变化来分析微生物群落的相应变化,忽略了各样本之间的微生物总数,使得最后的结果存在一定的偏差。为了修正相对丰度带来的偏差,利用OD600 nm值来测定微生物在某个时间点的菌体浓度作为该点样本中微生物的相对总数,并与高通量测得的各个物种的相对丰度相乘得出更准确的各个物种的相对数量(见图6)。饼图面积表示各样本的OD600 nm值,面积逐渐增大,表示菌群数量逐渐增多;各物种的积累量为所代表物种的相对丰度与OD600 nm值的乘积,即所占饼图的面积,从而可看出各个发酵时间点上物种积累量的变化。

图6 发酵样本门水平菌群数量变化Fig.6 Change of bacterial community of fermented samples at the phylum level
2.5.1 门水平变化分析
门水平上,各菌门在发酵过程中的积累量变化见图6,根据饼图大小变化,Y体系中各个发酵时间点饼图面积始终小于S体系中各个发酵时间点,且两体系随着发酵时间延长饼图面积逐渐增大,即各样品中微生物总数也在逐渐增多。
由图7和图8可知,S体系中变形菌门的相对丰度在S5阶段下降,但其积累量在发酵过程中始终呈上升趋势,蓝藻细菌门在S3~S5阶段呈下降趋势,但其积累量在该阶段始终呈上升趋势;说明相对丰度的降低并不能表示其菌门的积累量也减少。Y体系中厚壁菌门在YS3与YS4阶段相对丰度相差不明显(2.05%),但YS4阶段的积累量是YS3阶段的2.44倍,说明相对丰度变化不大的阶段不能表示其菌门数量也没有较大变化。在S体系中,变形菌门的积累量始终呈上升趋势,最大积累量为27.61%,而Y体系中变形菌门的积累量始终没有较大波动,最大积累量为1.51%,说明亚硝酸盐对变形菌门的生长有明显抑制作用。厚壁菌门在S3阶段的相对丰度是S2的2.29倍,YS3是YS2的15.06倍,但积累量S3是S2的7.15倍,YS3是YS2的36.89倍;蓝藻细菌门在S1阶段的相对丰度是S2的18.19倍,YS1是YS2的1.81倍,但积累量S1是S2的11.61倍,YS1是YS2的1.77倍;综上,说明相对丰度的上升或下降比例不能完全说明该菌门数量也呈现相同比例的增加或减少。
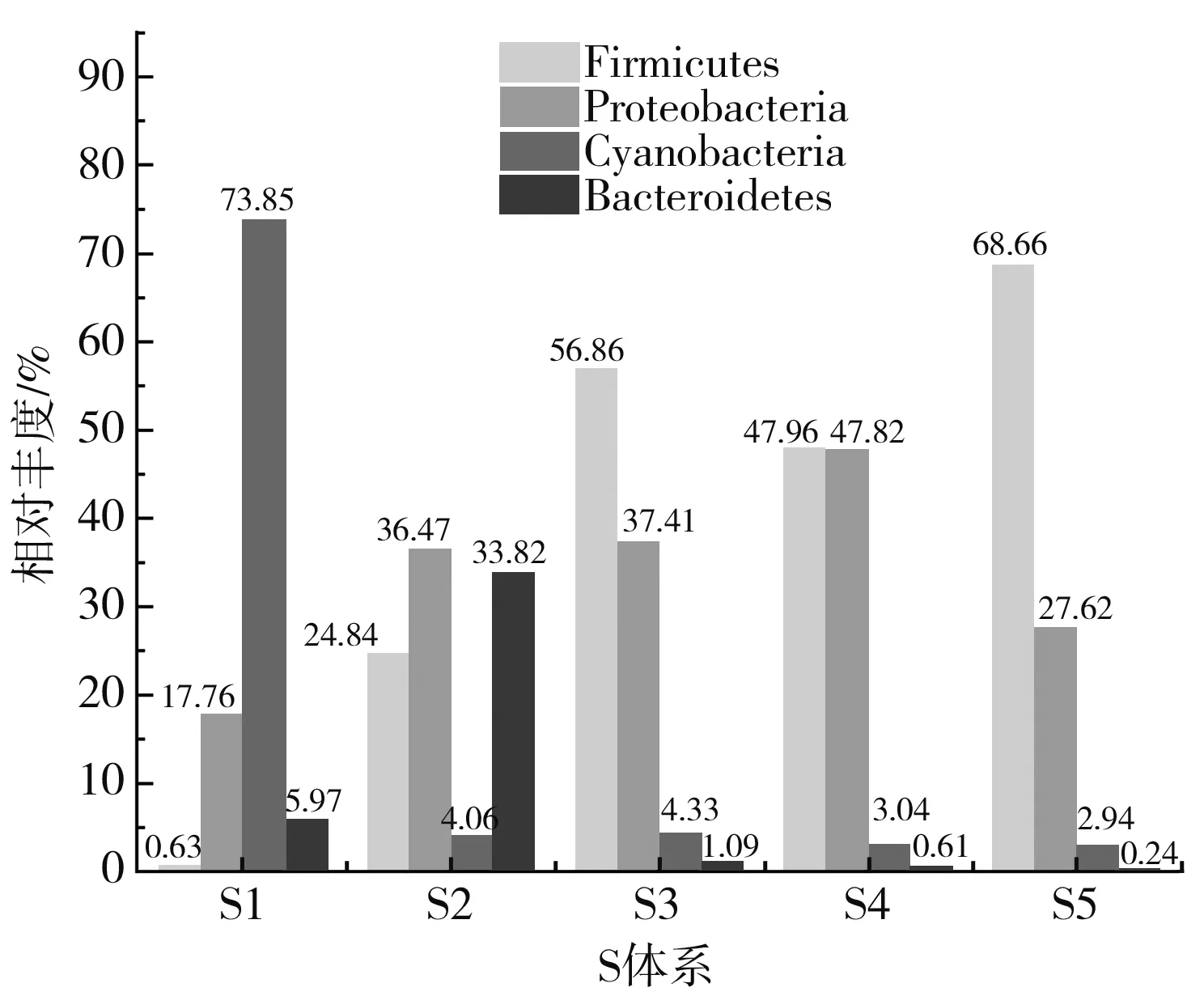
图7 发酵体系菌门相对丰度Fig.7 Relative abundance of bacterial phylum of fermented system

图8 发酵体系菌门积累量Fig.8 Accumulation amount of bacterial phylum of fermented system
2.5.2 属水平变化分析
属水平上,各菌属在发酵过程中的积累量变化见图9。
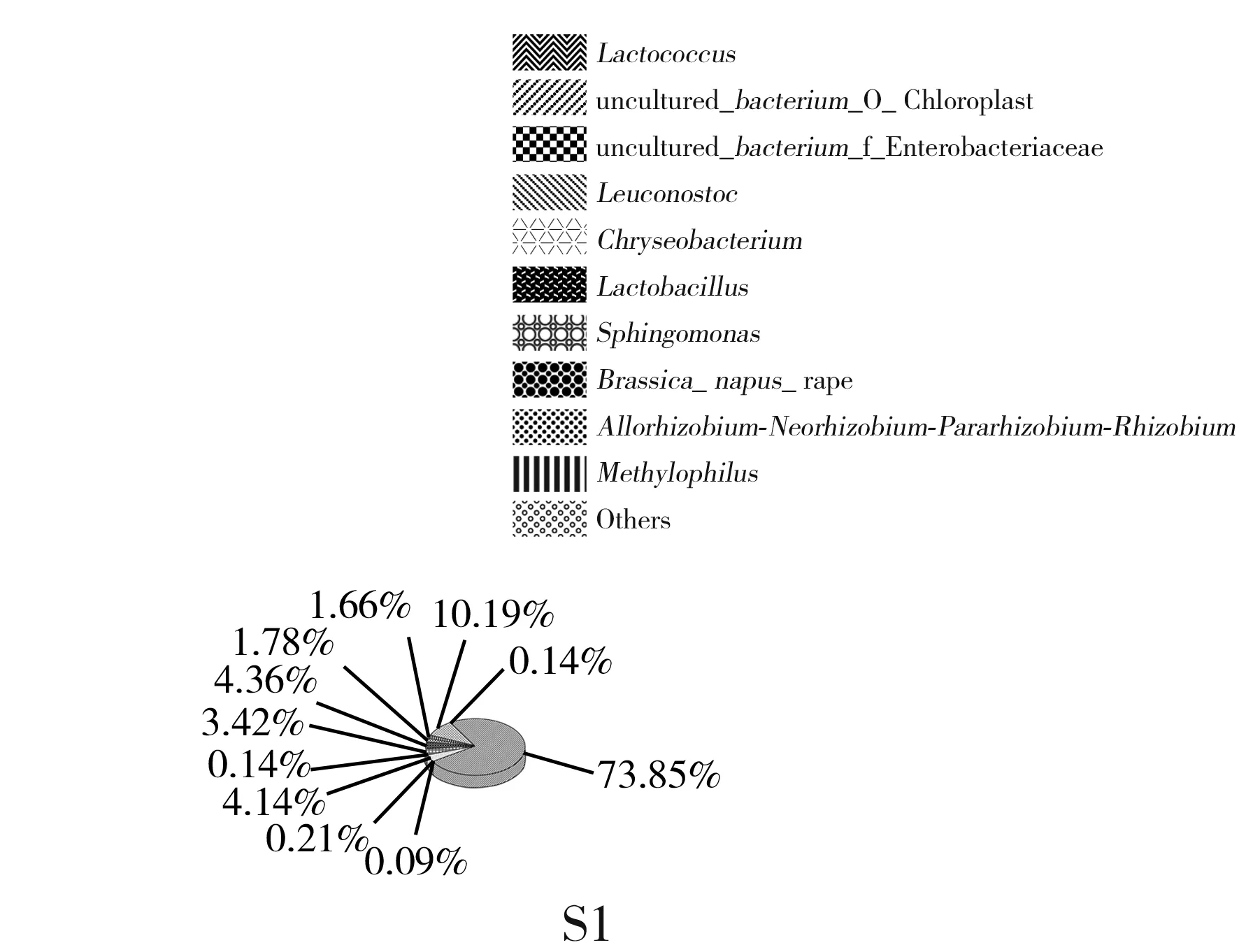
图9 发酵样本属水平菌群数量变化
在S体系中,Lactococcus、Leuconostoc在发酵过程中相对丰度均呈先上升后下降的趋势,但其积累量始终呈上升趋势;在S3~S5的发酵过程中其相对丰度值始终低于Y体系中的YS3~YS5阶段,其积累量也低于Y体系中的YS3~YS5阶段。
在发酵过程中出现的有害菌属,Y体系中的相对丰度低于S体系,根据积累量比较,uncultured_bacterium_f_Enterobacteriaceae、Enterococcus、Serratia在Y体系中各发酵阶段的积累量低于S体系,如uncultured_bacterium_f_Enterobacteriaceae在YS1(0%)阶段低于S1(0.01%),在YS2(0.02%)低于S2(1.93%),在YS3(0.15%)低于S3(7.63%),在YS4(0.53%)低于S4(17.14%),在YS5(0.33%)低于S5(20.09%),说明亚硝酸盐可抑制有害菌的生长。
3 结果与讨论
通过高通量测序技术检测到的相对丰度变化不能准确地反映实际分类单元密度的动态[13]。因不同样本之间总体微生物量存在现实差异,所以将相应的相对丰度与OD600 nm值结合,量化微生物的类群总量,是深入分析环境中微生物群落结构的重要前提。而微生物总量是微生物学的一项基本指标,对其进行测定往往很繁琐、费时[18]。考虑到这一因素,本研究采用分光光度计对微生物的OD600 nm值进行测定,其具有简便、迅速、可连续测定、适合自动控制等优点;且与微生物的总数变化呈正相关;又有与高通量测序中死菌、活菌一起测定的性质。通过将高通量测序方法得到的相对丰度与测定的OD600 nm值相结合,来计算相应菌属的微生物积累量,进一步对蔬菜发酵中微生物群落结构变化进行分析。研究结果发现在门水平上,S体系中变形菌门的相对丰度在S5阶段下降,但其积累量在发酵过程中始终呈上升趋势;蓝藻细菌门在S3~S5阶段呈下降趋势,但其积累量在该阶段始终呈上升趋势。Y体系中厚壁菌门在YS3与YS4阶段相对丰度相差不明显(2.05%),但YS4的积累量是YS3的2.44倍。厚壁菌门在S3阶段的相对丰度是S2的2.29倍,YS3是YS2的15.06倍,但积累量S3是S2的7.15倍,YS3是YS2的36.89倍;蓝藻细菌门在S1阶段的相对丰度是S2的18.19倍,YS1是YS2的1.81倍,但积累量S1是S2的11.61倍,YS1是YS2的1.77倍。表明只参考相对丰度带来的结果并不能准确地反映发酵系统中微生物群落结构的变化,同时菌属相对丰度的降低并不能代表其菌属总数的减少;当菌属相对丰度值没有明显波动时也不能表示其菌属微生物总数也没有波动;同时相对丰度的上升或下降比例不能完全说明该菌门数量也呈现相同比例的增加或减少。进而表明在利用高通量测序对微生物群落结构变化进行分析时,不能仅仅考虑微生物的相对丰度,应该同时考虑微生物的总量。
对蔬菜发酵的研究中,关于亚硝酸盐问题早已成为蔬菜发酵研究的热点之一。在发酵过程中,不仅微生物群落会受到各种因素的影响,亚硝酸盐含量也会产生相应的变化,研究亚硝酸盐与发酵过程中菌群结构变化的关系,以确定发酵过程中的核心微生物,对最佳发酵剂的选择具有重要意义。研究结果发现,门水平上,S体系中变形菌门的积累量始终呈上升趋势且最大积累量为27.61%,而Y体系中变形菌门的积累量始终没有较大波动,最大积累量为1.51%,说明亚硝酸盐对变形菌门的生长有明显抑制作用。属水平上,两体系发酵过程中有害菌属的相对丰度值与积累量表明亚硝酸盐可抑制有害菌的生长。相对丰度与积累量显示,在发酵过程中,S体系中Lactococcus、Leuconostoc为发酵前期主要优势乳酸菌属,Lactobacillus为发酵末期主要优势乳酸菌菌属;Y体系中Lactococcus、Leuconostoc参与整个发酵过程,并以Lactococcus为优势乳酸菌菌属。在Y体系中,亚硝酸盐一直处于降解状态,在发酵前期pH大于4.5时,乳酸菌产生大量的代谢产物(如亚硝酸还原酶),此时亚硝酸盐降解以酶降解为主[19-20];在发酵后期发酵环境中pH不断降低,H+与亚硝酸盐发生非酶歧化反应,亚硝酸盐的降解由酶降解转为酸降解[20];在发酵过程中会产生各种氨基酸,亚硝酸能与含游离α-氨基的氨基酸发生反应[21],进而降低其含量;同时发酵体系中的反硝化细菌含有亚硝酸盐还原酶,可通过好氧或厌氧反硝化过程将亚硝酸盐转化成一氧化二氮或氮气[22],从而降低亚硝酸盐含量。最后本研究中亚硝酸盐对发酵过程中的微生物量有一定的影响,对蔬菜发酵剂的进一步选择与发酵工艺的改进有一定的参考意义。

