燕麦干草不同饲喂水平对牦牛日增重、血液生理生化指标及瘤胃发酵参数的影响
吴刀知才让,裴成芳,马志远,刘红山,曹旭亮,刘虎,周建伟*
(1. 兰州大学草地农业科技学院,草种创新与草地农业生态系统全国重点实验室,甘肃 兰州 730000;2. 武威市天祝藏族自治县畜牧技术推广站,甘肃 武威 733200;3. 兰州大学生态学院,甘肃 兰州 730000)
作为青藏高原的当家畜种,牦牛在衣、食、住、行等方面为藏族同胞提供了最基本的生活物资、生产资料和经济来源。目前,全球牦牛存栏量约为1700 多万头,其中90%以上分布在我国青藏高原及其毗邻的高山草原地带[1]。从古至今,自然放牧是牦牛生产中最普遍采用的饲养模式,而在这种“靠天养畜”的经营形式下,该畜种营养物质摄入几乎完全依赖于天然草地的牧草供给。然而,受“高海拔、低温、强紫外线”等恶劣环境因素的影响,青藏高原植物生长期极短,每年仅有120 d 左右,这就造成了该地区牧草生物量与营养物质含量都会随季节变化而呈现出巨大波动[2]。资料显示,青藏高原天然草地夏季的生物量峰值达4.58 t·hm-2,而冬季的极值仅为0.25 t·hm-2[3];夏季的牧草粗蛋白含量为15.38%,而冬季却仅有6.81%[4]。此外,借助酸不溶灰分法估测得到2 岁放牧牦牛在返青期、青草期和枯黄期的牧草摄入量分别为185、111 和99 g·kg-1·BW-0.75[5],其采食量季节性差异非常大。上述的这些研究表明,放牧牦牛不但采食量随着牧草的枯荣交替而发生显著变化,而且也可猜测其在冷季将同时遭受能量和蛋白质营养的双重胁迫。正因如此,在自然放牧条件下,由于冷季饲料资源短缺,牦牛将通过动员机体储存的脂肪和蛋白质营养来维持正常的生理代谢功能,从而在整个冷季也会导致其自身遭受25%左右的掉膘减重[6]。这是传统养殖模式下牦牛产业普遍存在的生产瓶颈问题,也是造成该牲畜生长周期长、速度慢、效率低和收益差的根本原因之一。由此可见,采食量和牧草营养水平在放牧牦牛体重正负消长、生产效率发挥和产业健康发展中均起到举足轻重的作用。
研究表明,反刍动物瘤胃微生物群落、多样性和功能受其采食量的影响[7],而采食量又直接决定了家畜能量和蛋白质等营养物质的摄入量。再者,瘤胃微生物发酵生成的挥发性脂肪酸和同化合成的菌体蛋白分别又是宿主动物最重要的能量和氨基酸来源[8]。另外,血液生理生化参数是表征动物营养水平、健康状况以及生长性能的关键指标[9]。在生产实践中,放牧牦牛体重发生“夏壮、秋肥、冬瘦、春乏”之现象主要与草地生物量和牧草营养物质含量密切相关,而燕麦(Avena sativa)是青藏高原地区最常见的优质饲草,其养分含量与天然牧草相当[10-11]。基于此,本研究拟通过燕麦干草不同饲喂水平来模拟传统养殖模式下牦牛采食量季节性变化的生产现状,探究其生长性能、瘤胃发酵以及血液生理生化指标对营养物质摄入量的响应规律,以期为高寒牧区反刍家畜的营养调控、健康管理、高效生产和产业可持续发展提供理论依据与技术指导。
1 材料与方法
1.1 试验时间与地点
本试验于2020 年10 月至2021 年3 月在甘肃省武威市天祝藏族自治县安远镇乌鞘岭兰州大学牦牛试验站(102°49′38″ E,37°12′23″ N,海拔3154 m)开展。
1.2 试验设计与动物
参考Bailey 等[12]的4×4 拉丁方试验设计,选取3.5 岁、体重[(203.0±6.0) kg]和体况相近的健康去势牦牛6 头,额外的2 头试验动物作为其中一列拉丁方序列的生物学重复。试验饲粮为单一的燕麦干草颗粒,购自甘肃省肃南裕固族自治县百盛现代农牧业开发有限公司,其化学成分与营养水平见表1。在正式试验开始前,对所有试验牛进行14 d 的饲养试验以测定其自由采食量(voluntary intake, VI)。参考Wang 等[13]的研究方法,将单头牦牛的最低自由采食量作为标准,即VI=4.40 kg DM·d-1,以保证投喂的饲粮均能被采食完全。为了模拟传统放牧条件下牦牛各季节的采食量及其变化规律[11],本研究将燕麦干草饲喂水平设定为0.45、0.60、0.75 和0.90 VI,其分别相当于0.66、0.88、1.10 和1.32 倍生长期牦牛的代谢能维持需要量[14]。整个拉丁方饲养试验总共包括4 期,每期28 d,其中每期1~21 d 为饲粮适应期。
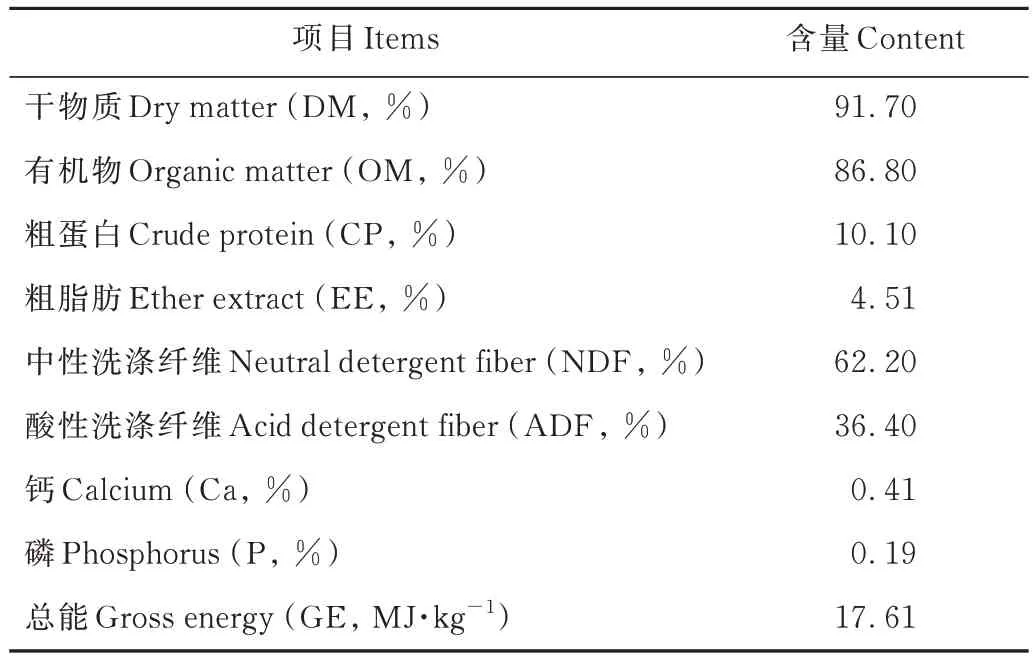
表1 燕麦干草化学成分与营养水平(风干基础)Table 1 The chemical composition and nutrients content of oat hay (air-dry basis)
1.3 饲养管理
在试验开始前,对所有牦牛注射伊维菌素以进行驱虫处理,同时对圈舍、代谢笼及饲喂用具进行清洁和消毒。试验期间及时清理试验牛的粪尿排泄物,每天对圈舍进行一次彻底打扫并进行定期消毒处理。试验牦牛单栏饲养,每头牛每天的饲粮平均分成2 份后,分别在8:00 和18:00 进行投喂,整个试验期自由饮水。
1.4 样品采集与处理
1.4.1 饲料样品 在饲养试验正试期,每天采集用于饲喂试验牦牛的燕麦干草颗粒100 g,并按试验期将样品混合后装于自封袋中。饲料样品在65 ℃烘箱中进行干燥,室内回潮12 h 至恒重,然后用粉碎机粉碎(FZ102, 天津市泰斯特仪器有限公司),过1 mm 筛子,装于自封袋中,室温保存,用于后续饲料营养成分分析。
1.4.2 血液样品 在每期试验第28 天晨饲前,利用穿刺法通过颈静脉采集血液10 mL,其中2 mL 置于管壁涂有肝素钠的真空采血管中,用于血液生理指标测定;剩余8 mL 血液装入普通真空采血管中,于4 ℃ 静置45 min,接着2420 r·min-1离心15 min,分离得到的上清液即是血清。利用移液枪将血清分装于1.5 mL 离心管中,置于-20 ℃冰箱中保存,用于后续血液生化指标与激素水平测定。
1.4.3 瘤胃液样品 在每期试验第28 天晨饲前,利用口腔式胃管(武汉科立博牧业科技有限公司)并辅以小型真空泵的方法进行瘤胃液样品采集。为确保采样迅速和样品的均一性,该过程由一名专业技术人员完成。在每次采样前,先用温水清洗胃管管路、过滤头与收集瓶等器具,以避免试验牦牛的瘤胃液样品交叉污染。在瘤胃液样品采集过程中,需将最先抽出的50 mL 瘤胃液舍弃,以减少唾液所造成的影响。每头试验牛采集瘤胃液约100 mL,4 层纱布过滤后,立即使用pH 计(PB-10,德国赛多利斯集团)测定pH 值。取一份10 mL 的瘤胃液,加入等量的去蛋白溶液(100 g 偏磷酸和0.6 g 丁烯酸溶于1 L 蒸馏水中),用于挥发性脂肪酸(volatile fatty acid, VFA)的测定;取一份5 mL 的瘤胃液,加入等量的0.5 mmol·L-1盐酸溶液以固定氨态氮,用于瘤胃液氨态氮的测定;处理完毕的瘤胃液样品立刻投入液氮速冻,带回实验室后转入-80 ℃超低温冰箱保存待用。
1.5 性能测定与样品分析方法
1.5.1 生长性能 在每期试验开始与结束当天上午7:00,利用电子地磅对试验牦牛逐一进行空腹称重,并记录体重数据,参考周建伟[15]的方法计算平均日增重(average daily gain, ADG)。
1.5.2 饲粮营养水平 参照《饲料分析及饲料质量检测技术》[16]的方法测定饲粮中干物质(dry matter, DM)、有机物(organic matter, OM)、粗蛋白(crude protein, CP)、粗脂肪(ether extract, EE)、钙(calcium, Ca)和磷(phosphorus, P)的含量。利用全自动氧弹量热仪(C3000, 德国IKA)对饲料总能(gross energy, GE)进行测定。分别参照Van Soest 等[17]和Robertson 等[18]的分析方法,利用全自动纤维分析仪(A200i, 美国ANKOM)对饲料中的中性洗涤纤维(neutral detergent fiber, NDF)和酸性洗涤纤维(acid detergent fiber, ADF)含量进行测定。
1.5.3 血液生理指标 试验牦牛的抗凝全血采集后,立即送至天祝藏族自治县华晟医院,采用全自动生化分析仪(BS-400, 深圳迈瑞生物医疗电子股份有限公司)测定血液生理指标,包括以下项目:白细胞数(white blood cell, WBC)、中性粒细胞数(neutrophil count, NEUT)、淋巴细胞数(lymphocyte number, LYM)、红细胞数(red blood cell, RBC)、血红蛋白(hemoglobin, HGB)、红细胞压积(hematocrit, HCT)、红细胞平均体积(mean red blood cell volume, MCV)、平均血红蛋白量(mean hemoglobin, MCH)、平均血红蛋白浓度(mean hemoglobin concentration, MCHC)、红细胞体积分布宽度(red blood corpuscular volume distribution width, R-CV)、红细胞分布宽度(red blood cell distribution width, R-SD)、血小板数(platelet, PLT)、平均血小板体积(mean platelet volume, MPV)、血小板分布宽度(platelet distribution width, PDW)、血小板压积(platelet hematocrit, PCT)。
1.5.4 血清生化指标与激素水平 采用改良氧化酶法测定牦牛血清中葡萄糖(glucose, GLU)浓度,采用Doumas 法测定血清总蛋白(total protein, TP)浓度,采用白蛋白检测试剂(BCG 法)测定白蛋白(albumin, ALB)浓度,采用免疫浊度法测定球蛋白(globulin, GLB)浓度,采用GPO-PAP 法测定甘油三酯(triacylglycerol, TG)浓度,采用UV-GLDH 法测定尿素氮(urea nitrogen, BUN)浓度。 采用酶联免疫吸附剂(enzyme linked immunosorbent assay, ELISA;产品号:BYE99020、BYE99015、BYE98150、BYE98314、BYE98165 和BYE98273)测定血清中游离脂肪酸(free fatty acid, FFA)、β-羟基丁酸(β-hydroxybutyric acid, BHBA)、胰岛素(insulin,INS)、胰高血糖素(glucagon, GC)、瘦素(leptin)和生长激素(growth hormone, GH)浓度。以上牦牛血清生化指标和激素水平均利用试剂盒在酶标仪(SpectraMax M5, 美国美谷)上进行检测,所用试剂盒均购自上海邦奕生物有限公司,测试程序严格按照说明书进行。
1.5.5 瘤胃发酵参数 参考周建伟[15]的方法采用气相色谱法(2010 plus 系统,日本京都岛津公司)测定瘤胃液挥发性脂肪酸(volatile fatty acid, VFA)。利用巴豆酸做内标,根据VFA 碳链长短差异而沸点不同的原理,实现VFA 各种酸的良好分离。该分析方法中所采用的毛细管柱为30.00 m×0.32 mm×0.50 μm(AT-FFAP, 美国安捷伦科技公司);气相色谱进样器温度为200 ℃;氢火焰离子化检测器(FID)温度为250 ℃;柱温箱升温程序如下:初始温度90 ℃,以10 ℃·min-1的速率升温至120 ℃并保持3 min;再以10 ℃·min-1的速率从120 ℃升温至180 ℃,同时在此温度下保持5 min。瘤胃液氨态氮浓度参照Hristov 等[19]的方法进行测定。
1.6 数据处理
试验数据通过Excel 2016 进行初步整理后,采用SAS 9.4 软件(SAS Inst. Inc., Cary, 美国)中MIXED 模块进行统计分析。统计模型为:Y=μ+FL+A+P+E,其中Y表示因变量,μ表示平均值,FL表示饲喂水平,A表示试验动物,P表示试验期,E代表标准误,饲喂水平为固定因子,试验动物与试验期为随机因子。利用多项式正交对比来检验燕麦干草饲喂水平对本研究中试验牦牛所测定指标的影响。当P<0.05 时,表示处理组间差异显著,0.05≤P<0.10 表示有趋势,P≥0.10 表示不受试验处理因素影响。
2 结果与分析
2.1 牦牛日增重与能量维持需要
由图1 可知,牦牛ADG 随着燕麦干草饲喂水平升高而线性增加(P<0.001);在采食0.45 和0.60 VI 饲粮时,牦牛体重呈负增长,这与试验饲粮设计需求相吻合。牦牛ME 摄入量与ADG 呈较强的正相关关系,通过线性回归,可得到ME 摄入量(X, MJ·kg-1·BW-0.75·d-1)与ADG(Y, g·d-1)的数学模型,即Y=973X-513 (R2=0.727; 图2)。利用该数学模型,设定ADG为0 g·d-1时,即可估测出生长牦牛的维持代谢能需要量为0.527 MJ·kg-1·BW-0.75·d-1,其也相当于燕麦干草采食量(DM)为50.7 g·kg-1·BW-0.75·d-1。

图1 燕麦干草饲喂水平对牦牛日增重的影响Fig.1 Effect of feed level of oat hay on average daily gain in yaks
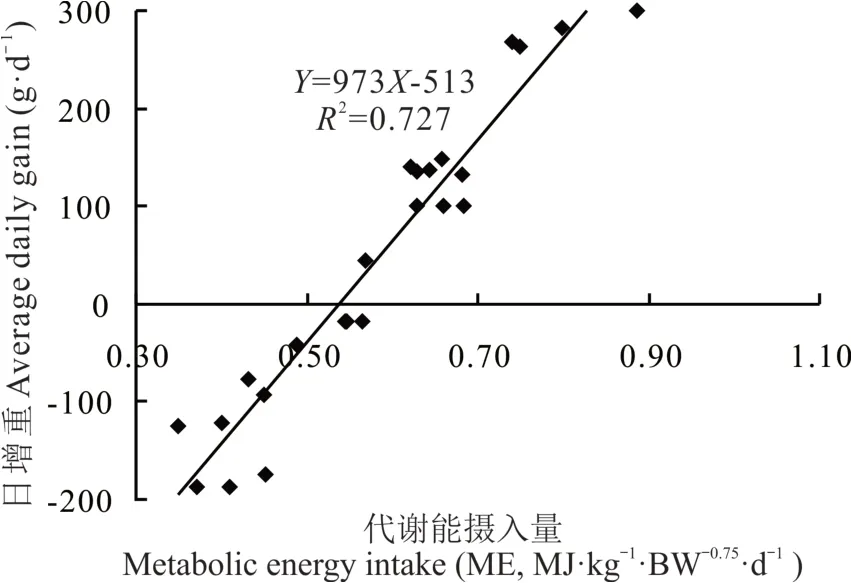
图2 牦牛代谢能摄入量与日增重的线性回归方程Fig. 2 The linear regression between metabolic energy intake and average daily gain in yaks
2.2 血液生理指标
如表2 所示,随着燕麦干草饲喂水平的升高,血液中RBC 线性减少(P<0.05),PLT 有增加趋势(P=0.05),而其余血液生理指标均不受影响(P≥0.10)。

表2 燕麦干草饲喂水平对牦牛血液生理指标的影响Table 2 Effect of feed level of oat hay on blood physiological parameters in yaks
2.3 血清生化参数
由表3 可知,随着燕麦干草饲喂水平的升高,牦牛血清BUN 浓度线性增加(P<0.05),而TP、ALB 和GLB 浓度均不受影响(P≥0.10)。牦牛血清GLU 浓度随着其采食量的升高而线性降低(P<0.05),BHBA 浓度呈线性降低的趋势(P=0.063),而FFA和TG 浓度在各处理组间无显著差异(P≥0.10)。在牦牛血清激素水平方面,GH 浓度随着饲喂水平升高而线性增加(P<0.05),INS 浓度也呈线性增加的趋势(P=0.091),但 GC 和瘦素浓度无变化(P≥0.10)。

表3 燕麦干草饲喂水平对牦牛血清生化与激素指标的影响Table 3 Effect of feed level of oat hay on serum biochemical and hormone parameters in yaks
2.4 瘤胃发酵参数
随着燕麦干草饲喂水平的升高,瘤胃液pH 线性降低(P<0.05;表4),TVFAs、乙酸和丁酸浓度线性增加(P<0.05),丙酸浓度具有线性增加的趋势(P=0.093),而NH3-N、Iso-VFAs 浓度和乙酸/丙酸不受影响(P≥0.10)。

表4 燕麦干草饲喂水平对牦牛瘤胃发酵参数的影响Table 4 Effect of feed level of oat hay on rumen fermentation parameters in yaks
3 讨论
3.1 燕麦干草不同饲喂水平对牦牛日增重的影响
基于适应性强、生物量大和营养丰富等特征,燕麦草在青藏高原受到农牧民的广泛青睐并得到了大面积种植,其约占该地区栽培牧草总量的70%以上[20]。资料显示,燕麦干草是高寒牧区牦牛幼畜、孕畜和病畜冷季最常用的补饲饲草,其能量与蛋白质等养分含量和初秋时期的天然牧草营养水平相当[10-11]。饲料中蛋白质与能量物质是影响反刍动物机体生长发育和瘤胃发酵功能的重要因素[21]。若家畜养分摄入不足,则会动员分解自身所储存的脂肪、蛋白质等机体组织,从而造成其掉膘减重[22]。在本研究中,试验牦牛的蛋白质与能量摄入量随着燕麦干草饲喂水平升高而线性增加,进而促进了其生长性能的发挥,这与前人在奶牛、水牛、绵羊和山羊上所得到的结果相似[23-27]。根据本试验设计的要求,利用燕麦干草饲喂水平模拟了放牧牦牛四季的牧草采食量,结果显示其体重所展现的变化规律与传统放牧模式下较为相似,这表明该研究已经达到了试验预期所要模拟的目标效果。本研究通过牦牛ADG 与ME 摄入量的拟合方程估测得出其代谢能维持需要量为0.527 MJ·kg-1·BW-0.75·d-1,这与Ding 等[11]在放牧牦牛上的研究结果相近(0.545 MJ·kg-1·BW-0.75·d-1),但显著高于胡令浩等[14]在生长期牦牛上获得的数据(0.458 MJ·kg-1·BW-0.75·d-1),造成这种差异的原因可能与试验牦牛的年龄、饲粮类型、养殖形式、研究方法等因素有关。
3.2 燕麦干草不同饲喂水平对牦牛血液生理指标的影响
哺乳动物血液主要由血细胞和血浆两大部分组成,前者按功能可分为白细胞、红细胞和血小板3 种类型。白细胞是血液中无色有核血细胞的总称,包括单核细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞和淋巴细胞,其在动物机体损伤治愈、病原入侵抵御和疾病免疫应答等方面发挥重要功能[28]。在本研究中,牦牛血液WBC 为(7.71~8.78)×109个·L-1,均在其正常数值范围内[29],且不受饲喂水平的影响,这说明各试验组牦牛的健康状况良好。血液中RBC、HGB 和HCT 可以直接反映动物机体运输氧气和二氧化碳的能力。资料显示,牛属动物血液中RBC、HGB、HCT 正常范围分别为(5~10)×1012个·L-1、80~150 g·L-1和20%~40%,而本研究中牦牛的上述指标也均在该正常范围内。然而,随着燕麦干草饲喂水平的升高,牦牛血液中RBC 线性降低,这与郭亚敏等[30]在绵羊上的研究结果相一致,其原因可能是在高采食量条件下,家畜体内的营养物质代谢活动增强,促进了机体血液循环速度,加快了对氧气的交换效率[31],进而使得在单位时间内运输一定量氧气时所需要调用的RBC 减少。血小板是存在于哺乳动物血液中的有形成分之一,也是最小的血细胞,其在凝血与止血功能上发挥重要作用,同时也参与炎症反应、免疫应答和机体抗寒等生理调控过程[32-33]。据报道,夏季放牧牦牛血液中PLT 显著高于冬季[34],但是证据显示动物PLT 会随着环境温度降低而增加[33]。据此推测,牦牛夏季较冬季具有更高的PLT 可能与夏季草原牧草丰茂从而导致其更高的养分摄入量有关,这与本研究中牦牛PLT 随着饲喂水平的升高而增加的试验结果相似。此外,当动物采食量增加时,其体内营养物质储备将更加充沛,机体在耐寒、抗炎和免疫等方面的能力会随之得到提升,因而这也间接说明了血液PLT 随采食量增加的可能原因。
3.3 燕麦干草不同饲喂水平对牦牛血液生化指标和激素水平的影响
血清代谢物和激素是常被用于评估家畜生理功能、营养水平和健康状况的关键生物标志物[26]。蛋白质是血清代谢物的重要组成部分,在临床上血清TP 一般被用于衡量肝细胞蛋白质合成功能和肾脏滤过作用[35],同时也能在一定程度上反映动物对饲粮蛋白质的消化、吸收和利用状况[36]。血清TP 主要由ALB 和GLB 两部分所构成。ALB 约占血清TP 的35%~50%,其在维持稳态与渗透压、营养物质转运和去除自由基等方面起到重要作用;而GLB 在调控机体炎症反应和抵御病理损伤中发挥关键功效[26]。在本研究中,牦牛血清TP、ALB 和GLB 浓度不受饲喂水平的影响,且均在正常数值范围内[37],说明试验动物肝脏功能和机体健康状况良好。哺乳动物体内血清BUN 主要由氨经肝脏鸟氨酸循环合成而来,是蛋白质等含氮化合物的代谢终产物,其浓度的高低可以间接反映机体蛋白质与氨基酸的平衡状况。一般而言,BUN 与动物蛋白质摄入量成正比,而其浓度越高,饲粮蛋白质利用效率越低[25,38]。在本试验中,牦牛蛋白质摄入量随着饲喂水平升高而增加,故BUN 浓度也随之升高。血清GLU 是生物体最重要的供能物质,因而GLU 浓度是衡量动物机体能量平衡状况的关键指标。研究表明,反刍动物血液中85%的GLU 来自肝脏糖异生[21],而其底物主要由瘤胃发酵所生成的丙酸来提供。然而,当动物处于饥饿或能量负平衡状态下时,其可通过动员脂肪和肌肉组织来实现氧化供能以维持机体能量需求[39]。虽然本研究中燕麦干草饲喂水平对TG 和FFA 无影响,但先前的研究表明,随着饲粮能量水平的升高,反刍动物瘤胃液中丙酸含量随之增加,进而会导致血糖浓度升高[40]。在本试验中,虽然牦牛瘤胃液丙酸浓度随着燕麦干草饲喂水平的升高有增加的趋势,但是GLU 浓度却线性降低,这与Liu 等[26]给牦牛饲喂能量梯度饲粮的研究结果相同,其原因可能是:1)在能量负平衡时,动员分解体组织所形成的非糖物质(例如乙酰乙酸、β-羟基丁酸及丙酮等)分担了GLU 的供能任务,从而使机体在能量应激时仍然能够维持正常的血糖浓度;2)INS 在维持机体血糖稳态方面起到关键的调控作用,而牦牛血液中INS 浓度随着燕麦干草饲喂水平升高而呈增加的趋势,因此这也会造成血糖浓度随之降低。BHBA 作为家畜血液中酮体的主要成分,其浓度的高低可以反映机体的能量平衡状态。据报道,当反刍动物血清BHBA 浓度大于1.0 mmol·L-1时,表明机体处于能量负平衡状态[41]。然而在奶牛上的研究发现,当血清BHBA 为0.56~0.71 mmol·L-1时,即使其浓度小于1.0 mmol·L-1,这些动物也发生了严重的掉膘减重现象[42],本试验结果与此相似,即牦牛因采食量不足而发生了体重负增长,但是其血清BHBA 浓度依然维持在较低水平。
动物的生长不仅会受到遗传背景、营养摄入、外界环境等诸多因素的影响,还会受到自身激素水平的调控[43]。INS 是衡量机体葡萄糖代谢和蛋白质合成的重要指标,其能够增强细胞对GLU 的吸收以及促进氨基酸合成体蛋白[44]。本试验中,随着燕麦干草饲喂水平的升高,INS 浓度有上升趋势,这表明高水平养分摄入对机体糖酵解途径有促进作用[43]。GC 和瘦素与机体的脂肪代谢密切相关,其中GC 浓度的升高有助于机体脂肪组织的降解,从而提高GLU 的浓度[45],而血清瘦素浓度的升高则是机体脂肪沉积较多的表现[44]。本研究中,燕麦干草饲喂水平并未对GC 和瘦素浓度产生影响,这可能与激素脉冲式、阶段性的释放规律有关[46]。此外,激素调节机制在应对不同水平养分摄入时,也会使机体内激素浓度保持在相对稳定的水平[47]。GH 是由哺乳动物脑垂体前叶分泌的一种肽类激素,其对动物生长发育起到重要调节作用。研究表明,牦牛血液GH 浓度与生长速率呈正相关关系[48],与此类似,本试验也发现牦牛血清GH 浓度和ADG 均随着饲喂水平的升高而线性增加。
3.4 燕麦干草不同饲喂水平对瘤胃发酵参数的影响
瘤胃pH 主要受饲粮类型、采食水平、唾液分泌、有机酸积累、食糜流速等因素的共同影响[49-50],其是直观反映瘤胃内环境以及用于评价瘤胃健康状况的重要指标之一。研究表明,反刍动物瘤胃微生物群落组成、结构及其功能均受pH 的调控[50],例如纤维分解菌对pH 变化较为敏感,其最佳范围为6.2~7.2[16]。当瘤胃pH 低于6.2 时,纤维分解菌生长将会受到抑制[51],而淀粉分解菌却在低pH 时仍然能展现出较高的生物活性[52]。在本研究中,牦牛瘤胃pH 为6.78~7.15,处在纤维分解菌最适的生长范围内,这可能与试验饲粮由富含纤维类碳水化合物的单一燕麦干草组成有关。NH3-N 是瘤胃微生物生长和增殖的重要氮源之一,约占其合成菌体蛋白所需氮素营养的40%~68%[53]。一般而言,反刍动物瘤胃液NH3-N 浓度随着饲粮蛋白质水平或采食量的升高而增加[54]。在本研究中,虽然试验牦牛的氮素摄入量也随着饲喂水平升高而增加,但是瘤胃液NH3-N 浓度却维持相对稳定,其原因可能是:在低饲喂水平下,瘤胃中可发酵碳水化合物供应不足,微生物合成代谢过程由于缺乏碳链骨架而导致活性受到抑制,进而造成NH3-N 消耗量减少。TVFAs 是瘤胃微生物降解饲粮中碳水化合物所产生的代谢终产物,也是反刍动物能量的主要来源,其能够为宿主机体提供约70%~80%的能量需求[8]。试验牦牛瘤胃pH 随着采食量的升高而线性降低,这主要是因为在瘤胃微生物的作用下发酵底物的增加促使生成更多的乙酸、丙酸、丁酸和TVFAs,而有机酸的积累又会进一步导致瘤胃pH 降低。然而,瘤胃液TVFAs 中各酸占比以及乙酸/丙酸均不受燕麦干草饲喂水平的影响,这表明牦牛在采食同一种饲粮时,即使采食量不一致,其瘤胃微生物区系及其发酵模式可能也都较为稳定或相似。
4 结论
通过本试验中牦牛ME 摄入量(X)和日增重(Y)可建立数学回归模型Y=973X-513 (R2=0.727),据此可估测得到其维持代谢能需要量为0.527 MJ·kg-1·BW-0.75·d-1。再者,牦牛血液生理生化参数与瘤胃发酵性能均在不同程度上受牧草饲喂水平的影响。因此,在青藏高原牦牛饲养过程中,应特别关注家畜采食量的季节性差异,尤其需在冷季实施合理的营养补饲策略,进而才能实现该产业的高效与可持续发展。

