硅和CO2加富对Ca(NO3)2胁迫下番茄幼苗生长及生理特性的影响
杨小慧,崔云浩,张玉静,赵艺鸿,张毅,石玉
(山西农业大学 园艺学院,山西 晋中 030801)
随着设施农业的迅速发展,我国设施栽培面积已达世界第一,但由于设施栽培过程中不合理施肥,以Ca(NO3)2过量积累为主要特征的设施土壤盐渍化现象日趋严重,阻碍了我国设施农业的可持续发展[1]。Ca2+与NO3-的过量累积造成土壤渗透势下降,进而导致植株根系生长受阻,抑制其对水分的吸收与转运,造成生理干旱引发植株萎蔫,严重时造成植株体内水分外渗甚至死亡[2]。李雅洁等[3]的研究发现,与对照相比,Ca(NO3)2胁迫显著降低了黄瓜幼苗叶片光合特性,特别是净光合速率(Pn),使得黄瓜幼苗的生长受到抑制;张妙娟等[4]的研究显示,Ca(NO3)2胁迫下番茄幼苗生物量积累及生理特性均发生了变化,造成细胞内外物质运输系统的瘫痪,致使番茄生长受损;韩志平等[5]的研究表明,随Ca(NO3)2胁迫浓度的升高,黄瓜幼苗植株的干鲜重有不同程度降低,光合色素含量呈先升高后降低的趋势,同时质膜透性和丙二醛(MDA)含量显著增加,严重抑制了黄瓜幼苗的生长。因此开展Ca(NO3)2胁迫研究是设施生产中亟待解决的问题之一。
作为光合作用的主要原料,CO2对植物生长发育具有重要影响,但在设施农业中,由于植物生长过于茂密及设施内极为特殊的环境条件,致使其内部的CO2较为匮乏,植物光合作用难以达到最大效率,对光合同化产物造成影响,最终导致产量下降,因此在设施内进行CO2加富是非常有必要的[6]。目前的研究普遍认为,适量增施CO2有利于提高叶绿素含量和净光合速率,促进植株根系对水分的吸收,进而缓解盐胁迫对植物的伤害[7]。此外,CO2加富还可明显增强番茄[8]、西瓜[9]、甜椒[10]及黄瓜[11]对盐胁迫的耐受能力,最终促进植株的生长。尽管前人就CO2加富对设施作物盐胁迫进行了大量研究,然而这些研究大部分集中在NaCl 胁迫上,对Ca(NO3)2胁迫的研究相对较少[9]。因此,研究CO2加富对Ca(NO3)2胁迫的缓解机理有重要意义。
目前,大量研究发现硅(Si)在作物抵抗胁迫方面有诸多益处,在农业生产中逐渐被重视[12]。前人研究表明,Si 在改善土壤的理化性质的同时还可以提高植株耐受性[13]。吴之涛等[14]的研究显示,在不同生育时期喷施不同浓度的Si 能增加黄芪的生物量和叶绿素含量,促进黄芪生长,以2000 mg·L-1Si 处理效果最佳;柳帆红等[15]的研究表明,Si降低了自毒胁迫下黄瓜的抗氧化酶活性和膜脂过氧化程度,增强其耐受能力;秦曼丽等[16]的研究表明,外源施Si降低了黄瓜叶片的电解质渗透率、MDA 含量以及过氧化氢(H2O2)含量,减轻盐胁迫造成的氧化损伤。还有研究发现,当植物遭受盐胁迫时水通道蛋白活性会降低,而Si 可以提高根系能量供应,增强作物根系活力,减轻盐胁迫对根系吸水速率的抑制,同时维持叶片含水量较高,降低叶片中盐浓度,从而稳定植物体内水分平衡[17]。土壤中植物能够吸收利用的Si含量较低,因此研究外源Si在缓解胁迫方面有广阔的前景[18]。
番茄(Solanum lycopersicumL.)是设施内栽培面积较大的蔬菜作物之一,但由于设施栽培环境日趋恶化及CO2严重亏缺等不良环境因素严重影响了番茄的生长发育[1]。目前,国内外学者在单一外源物质(Si或CO2)缓解盐胁迫的机理方面做了大量研究,但外源Si与CO2加富对Ca(NO3)2胁迫下番茄生长的交互效应还不明确,有待于进一步研究。基于此,本试验以番茄“中杂9 号”品种为试材,采用水培法精准控制根际生长环境,探讨外源Si 和CO2加富对Ca(NO3)2胁迫下番茄生物量、光合特性、相对含水量、叶片水势、根系水力学导度、活性氧及抗氧化系统的影响,为基于外源Si 和CO2加富提高设施番茄抗盐性奠定理论基础。
1 材料与方法
1.1 试验材料
以“中杂9 号”番茄品种为试材;种子购自中国农业科学院蔬菜花卉研究所,保护地及露地兼用番茄一代杂种;以分析纯硅酸钠(Na2SiO3·9H2O,1.5 mmol·L-1)为Si 源,购自天津市北辰方正试剂厂;以100 mmol·L-1Ca(NO3)2模拟盐胁迫环境,购自天津市大茂化学试剂厂,所有浓度为前期试验筛选所得。
1.2 试验设计
选择饱满的种子经55 ℃温汤浸种,28 ℃恒温催芽露白后播于72 孔穴盘中,人工气候室中培养,设置温度(28±1)℃/(18±1)℃(昼/夜),光暗周期16 h/8 h,光照度800 μmol·m-2·s-1。待幼苗2 叶1心时,挑选长势一致的幼苗,定植于装有1/2 剂量Hoagland 营养液的水培槽中进行缓苗,pH 保持在6.0±0.2,使用增氧泵为番茄提供氧气(通气1 h 间歇30 min)。缓苗7 d 后,分别在2 个生长室内进行CO2预处理,通过CO2控制系统控制时间和浓度,分别 保 持 在(400±20)μmol·mol-1、(800±20)μmol·mol-1,浓度为前期筛选所得。预处理3 d 后,在营养液中一次性加入100 mmol·L-1Ca(NO3)2和1.5 mmol·L-1Na2SiO3·9H2O。
试验共设8 个处理,每个处理3 组重复,每组重复6株幼苗。具体处理如下:
4-CK(400 μmol·mol-1CO2),
4-Si(400 μmol·mol-1CO2+1.5 mmol·L-1Na2SiO3·9H2O),
4-Ca(400 μmol·mol-1CO2+100 mmol·L-1Ca(NO3)2),
4-Ca-Si(400 μmol·mol-1CO2+100 mmol·L-1Ca(NO3)2+1.5 mmol·L-1Na2SiO3·9H2O),
8-CK(800 μmol·mol-1CO2),
8-Si(800 μmol·mol-1CO2+1.5 mmol·L-1Na2SiO3·9H2O),
8-Ca(800 μmol·mol-1CO2+100 mmol·L-1Ca(NO3)2),
8-Ca-Si(800 μmol·mol-1CO2+100 mmol·L-1Ca(NO3)2+1.5 mmol·L-1Na2SiO3·9H2O)。
于处理第6 天早上进行取样,将番茄幼苗生长点下2~3 片完全展开的功能叶与根系剪下,液氮速冻后存入-80 ℃冰箱用于生理生化指标的测定。
1.3 测定项目及方法
1.3.1 生物量
于处理6 d 早上8:00-9:00,各个处理分别选取3 株整株番茄幼苗,用自来水和蒸馏水先后冲洗,用滤纸擦干。再将幼苗植株分成地上、地下部分,称鲜质量。随后标记放入信封密封,将其放入105 ℃烘箱,杀青30 min,65 ℃烘干至恒重称干质量。
1.3.2 叶绿素
取植株新鲜叶片,称取0.1 g 样品放入试管中,加入96%乙醇10 mL,将试管置于暗处浸提24 h 至叶片完全变白,于470、649、665 nm 测吸光值,参照李旭芬等[8]的方法进行数据计算。
1.3.3 光合参数
上午9:00-11:00 每个处理选取3 株长势基本一致的幼苗,采用Li-6400XT 便携式光合测定仪(LI-COR 公司,美国)测定生长点往下第2 片功能叶的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)。每株测3次,取平均值。
1.3.4 叶片水势、含水量及根系水力学导度
于处理第6 天早上8:00-9:00,各个处理分别选取6 株番茄幼苗,并将其生长点下第2 片完全展开叶片与整株根系剪下分别用于叶片水势和根系水力学导度的测定,叶片水势与根系水力学导度采用植物水分压力室(PMS Model 3500,美国)进行测定。叶片含水量参考刘斌[19]的方法测定。
1.3.5 电解质渗漏率、MDA、O2-、H2O2、SOD、POD、CAT
电解质渗漏率参考Ahmad 等[20]的方法测定;丙二醛(MDA)、超氧阴离子(O2-)、过氧化氢(H2O2)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)均参照李旭芬等[8]的方法进行测定。
1.4 数据分析
试验数据均采用SPSS 20 统计软件进行方差分析,用Duncan’s 新复极差法进行多重比较(P<0.05)。采用Microsoft Excel 2016 对数据进行统计分析作图。
2 结果与分析
2.1 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗生长及质膜透性的影响
2.1.1 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗生物量的影响
由表1 可知,与4-CK 相比,4-Ca 处理后番茄幼苗的总鲜质量与总干质量分别显著下降了72.15%和74.23%。与4-Ca 处理相比,4-Ca-Si 处理后番茄幼苗的总鲜质量与总干质量分别提高了101.45%、109.31%;8-Ca 处理后番茄幼苗总鲜质量与总干质量分别提高了34.32% 和43.38%;8-Ca-Si处理后番茄幼苗总鲜质量与总干质量分别显著提高了1.11倍和1.54倍。
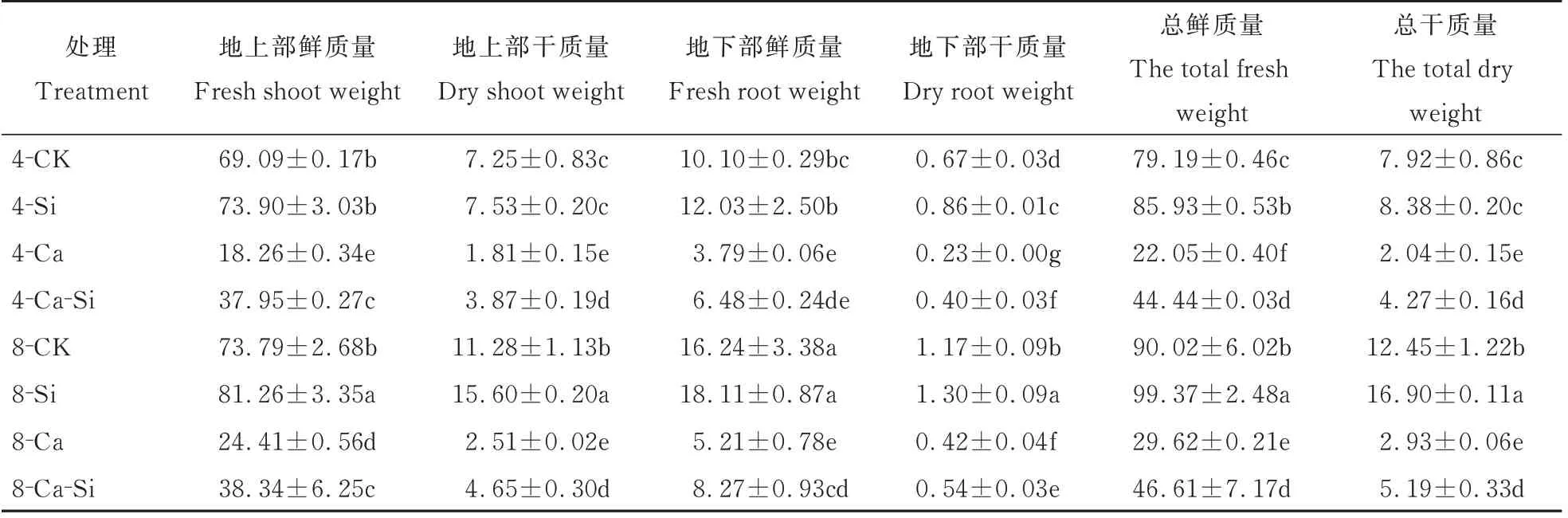
表1 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗生物量的影响Table 1 Effects of exogenous Si and CO2 enrichment on the biomass of tomato seedlings under Ca(NO3)2 stress 单位:g
2.1.2 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗电解质渗漏率的影响
图1 可知,与4-CK 相比,4-Ca 处理后番茄幼苗叶片和根系中电解质渗漏率分别提高了154.03%和260.67%。与4-Ca 相比,4-Ca-Si处理后番茄幼苗叶片和根系电解质渗漏率分别显著下降了9.31%和8.26%;8-Ca 处理后番茄幼苗叶片和根系电解质渗漏率分别下降了37.32%和17.79%;8-Ca-Si处理后番茄幼苗叶片和根系的电解质渗漏率显著降低,降幅分别为44.48%和31.03%。

图1 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗电解质渗漏率的影响Fig.1 Effects of exogenous Si and CO2 enrichment on the electrolyte permeability of tomato seedlings under Ca(NO3)2stress
2.1.3 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗MDA 含量的影响
由图2 可见,与4-CK 相比,4-Ca 处理后 番茄叶片和根系中MDA 含量分别显著提高了141.64%和69.09%。与4-Ca 处理相比,4-Ca-Si处理后番茄幼苗叶片和根系MDA 含量分别下降了35.87%和15.43%;8-Ca 处理后番茄幼苗叶片和根系MDA 含量分别下降了40.31% 和22.26%;8-Ca-Si 处理后番茄叶片与根系中MDA含量降幅最大,分别下降了51.12%和31.18%。
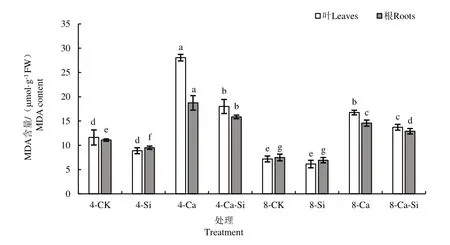
图2 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗MDA含量的影响Fig.2 Effects of exogenous Si and CO2 enrichment on MDA content in tomato seedlings under Ca(NO3)2 stress
2.2 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗叶片生理特性的影响
2.2.1 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗叶绿素含量的影响
与4-CK 相比,4-Ca 处理后番茄总叶绿素含量显著降低了46.84%,而类胡萝卜素含量则达到最高。与4-Ca 处理相比,4-Ca-Si 处理后番茄叶绿素a、叶绿素b 及总叶绿素含量分别显著增加了38.84%、37.88%和38.60%;8-Ca 处理后叶绿素a及叶绿素b 含量分别显著升高了42.36% 和39.34%;8-Ca-Si 处理后叶绿素a 及叶绿素b 含量的增幅分别为81.41%和82.00%(表2)。
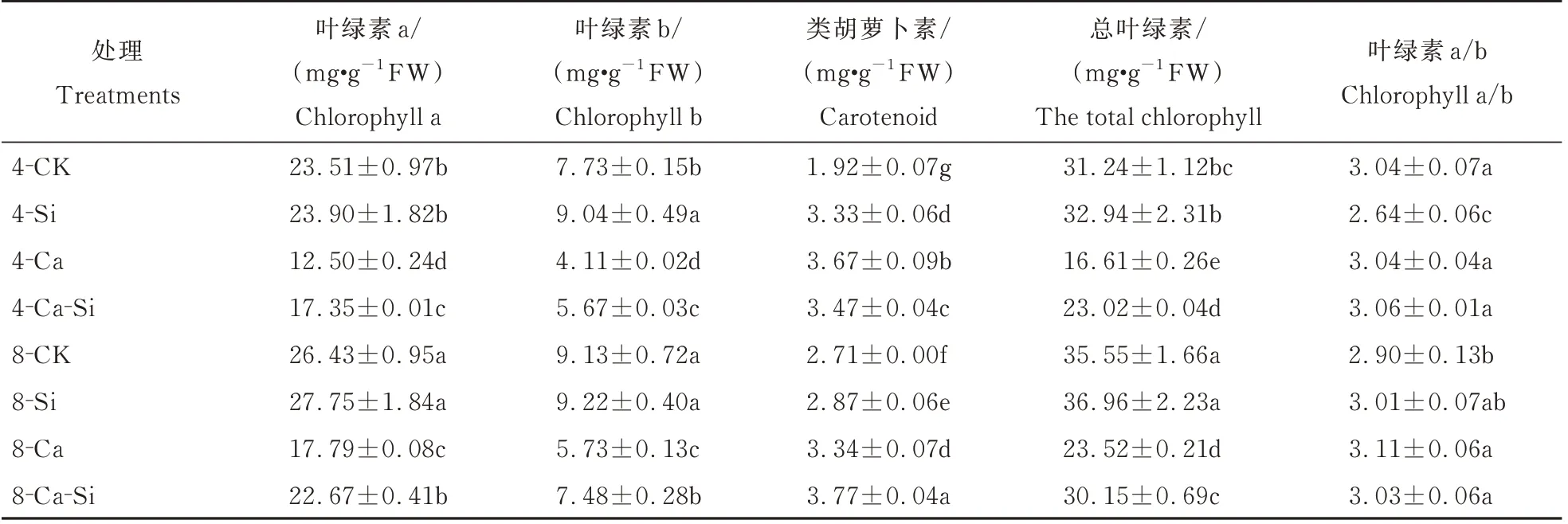
表2 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗叶绿素含量的影响Table 2 Effects of exogenous Si and CO2 enrichment on chlorophyll content of tomato seedlings under Ca(NO3)2 stress
2.2.2 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗光合特性的影响
由表3 可见,与4-CK 相比,4-Ca 处理后番茄叶片的净光合速率(Pn)、气孔导度(Gs)、胞间O2浓度(Ci)以及蒸腾速率(Tr)均显著下降,降幅分别为55.97%、71.43%、30.54%和63.47%。与4-Ca处理相比,4-Ca-Si 处理后番茄叶片Pn、Gs、Ci 及Tr分别显著提高了55.66%、72.40%、18.53% 和49.47%;8-Ca处理后番茄叶片的Pn和Ci分别显著提升了50.22%和14.68%,而Gs 变化不显著,Tr呈下降趋势;8-Ca-Si 处理后番茄叶片的Pn、Gs、Ci及Tr 均显著增加,且增幅分别达到82.52%、17.49%、25.14%和24.85%。

表3 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗光合特性的影响Table 3 Effects of exogenous Si and CO2 enrichment on photosynthetic characteristics of tomato seedlings underCa(NO3)2 stress
2.2.3 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗叶片相对含水量的影响
由图3 可知,与4-CK 相比,4-Ca 处理后番茄叶片的相对含水量显著下降,降幅为81.99%。与4-Ca 相比,4-Ca-Si 处理后番茄叶片的相对含水量显著提高了10.84%;8-Ca-Si处理后番茄叶片的相对含水量显著提高了14.94%。

图3 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗相对含水量的影响Fig.3 Effects of exogenous Si and CO2 enrichment on the relative water content of tomato seedlings under Ca(NO3)2 stress
2.2.4 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗叶片水势的影响
由图4 可知,与4-CK 相比,4-Ca 处理后番茄叶片水势显著降低了2.59 倍。与4-Ca 处理相比,4-Ca-Si 处理后的番茄叶片水势提高了39.45%;8-Ca 处理后番茄叶片水势提高了16.54%;而8-Ca-Si处理后水势显著提高了54.34%。

图4 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗叶片水势的影响Fig.4 Effects of exogenous Si and CO2 enrichment on leaves water potential of tomato seedlings under Ca(NO3)2 stress
2.3 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗根系水力学导度的影响
由图5 可知,与4-CK 相比,4-Ca 处理后番茄根系水力学导度显著降低了81.54%。与4-Ca 处理相比,4-Ca-Si 处理后番茄根系水力学导度显著提高了85.49%;8-Ca 及8-Ca-Si 处理后番茄根系水力学导度分别降低了33.66%和8.17%。
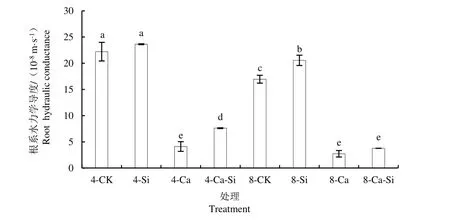
图5 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗根系水力学导度的影响Fig.5 Effects of exogenous Si and CO2 enrichment on the roots hydraulic conductance of tomato seedlings under Ca(NO3)2 stress
2.4 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗活性氧的影响
2.4.1 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗过氧化氢(H2O2)含量的影响
由图6 可知,与4-CK 相比,4-Ca 处理后番茄叶片与根系中H2O2含量均显著增加,叶片、根系的增幅分别为59.88%和268.50%。与4-Ca处理相比,4-Ca-Si 处理后番茄叶片与根系中H2O2含量分别显著降低了23.67%和12.07%;8-Ca 处理后番茄幼苗叶片和根系H2O2含量分别下降了34.48%和17.05%;8-Ca-Si 处理后番茄叶片与根系中H2O2含量分别显著降低了45.81%和30.74%。
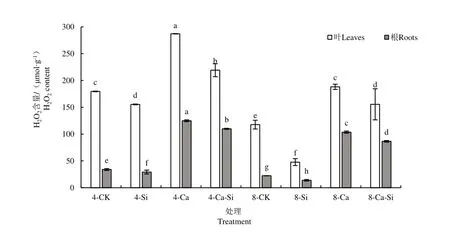
图6 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗过氧化氢(H2O2)含量的影响Fig.6 Effects of exogenous Si and CO2 enrichment on hydrogen peroxide (H2O2)content in tomato seedlings under Ca(NO3)2 stress
2.4.2 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗O2-产生速率的影响
与4-CK 相比,4-Ca 处理后番茄叶片和根系中O2-产生速率均显著提高,增幅达32.92% 和80.94%。与4-Ca 处理相比,4-Ca-Si 处理后番茄幼苗叶片和根系O2-产生速率降低了10.93% 和12.78%;8-Ca 处理后番茄幼苗根系中O2-产生速率降低了17.04%;8-Ca-Si处理后番茄叶片与根系中O2-产生速率显著下降16.13%和29.82%(图7)。
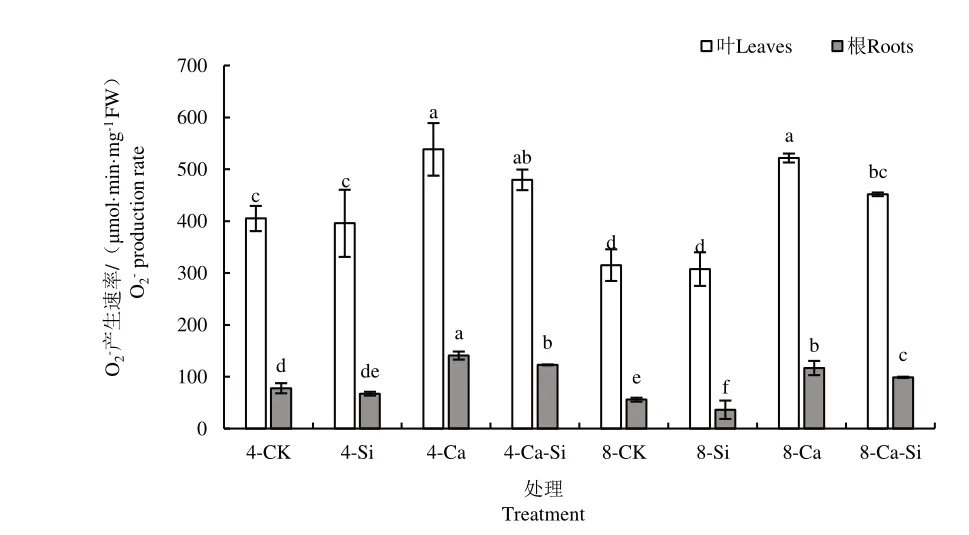
图7 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗O2-产生速率的影响Fig.7 Effect of exogenous Si and CO2 enrichment on O2- production rate of tomato seedlings under Ca(NO3)2 stress
2.5 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗抗氧化酶活性的影响
由表4 可知,与4-CK 相比,4-Ca 处理后番茄叶片与根系中SOD、POD、CAT 活性均显著降低,其中叶片降幅分别为19.69%、31.82%、27.60%,根系 降 幅 分 别 为38.76%、46.96%、26.02%。与4-Ca 处理相比,4-Ca-Si 处理后番茄叶片的SOD、CAT 活性分别显著提高了10.76%和15.77%,根系SOD、CAT 活性分别显著提高了32.66% 和8.50%;8-Ca 处理后番茄叶片的SOD、CAT 活性分别显著提高了11.46% 和20.37%,根系中的SOD、CAT 活性分别显著提高了39.06% 和17.22%;8-Ca-Si处理后番茄叶片的SOD、POD 及CAT 活性均显著升高,增幅分别为17.64%、33.75%和32.30%,根系的SOD、POD 及CAT 活性分别显著增加了54.88%、70.87%和29.27%。

表4 外源Si 与CO2加富对Ca(NO3)2胁迫下番茄幼苗抗氧化酶活性的影响Table 4 Effects of exogenous Si and CO2 enrichment on antioxidant enzyme activity of tomato seedlings under Ca(NO3)2stress
3 讨论
生物量可以直接反映植物的受胁迫程度和抗盐性强弱,Ca(NO3)2胁迫会抑制植物的生长,最直观的表现就是干鲜质量的下降[21]。有研究表明,外源Si、CO2加富均有助于提高植物的生物量,缓解胁迫 对 植 物 生 长 发 育 的 抑 制[8,14]。本 试 验 发 现,与4-Ca 处理相比,4-Ca-Si、8-Ca、8-Ca-Si 处理后番茄植株总鲜质量、总干质量均显著提高(表2),出现此现象的原因主要是CO2加富增加了植物的碳供应,将更多的碳同化产物运输到根系,促使植株根部氨基酸合成速度增强,致使植株的生物量显著增加[22],同时Si 可以在胁迫条件下调控植物根内的微生物群落结构,促进营养物质的正常吸收,使根系恢复生长,有效提高植株的生物量[23]。且在本试验中,8-Ca-Si处理下番茄幼苗的生长最佳[24]。
叶绿素是植物进行光合和同化物质的基础,其含量影响着植物的光合能力[7]。本研究结果发现,与4-CK 相比,4-Ca 处理后番茄光合色素含量显著降低;与4-Ca 相比,4-Ca-Si、8-Ca、8-Ca-Si处理后番茄的总叶绿素含量均有不同程度的提高(表3),其中8-Ca-Si 处理后效果最显著。说明Ca(NO3)2胁迫破坏了叶绿体结构,抑制了光合色素的生成[25];而外源施Si、CO2加富处理后维持了良好的叶绿体片层结构,缓解Ca(NO3)2胁迫下叶绿素的降解,增强了幼苗对胁迫的耐受能力[8,16]。Hao 等[26]认为,植物叶片Pn 下降的因素包括气孔限制和非气孔限制2 类,前者由Gs 和Ci减少所致,而后者是由于Gs 减少而Ci 保持恒定的增加。本试验显示,与4-CK 相比,4-Ca 处理下番茄叶片的Pn、Ci、Gs 和Tr 均显著下降,8-Ca 处理后番茄叶片的Pn 和Ci均显著升高,而Gs 变化不显著、Tr 下降(表4),表明Ca(NO3)2胁迫条件下气孔限制是降低净光合速率的主要因素,CO2加富后引起水分由叶片向外排放的阻力增大,从而限制植株蒸腾,促进植株叶片吸收CO2,从而提高胞间CO2浓度,最终提高净光合速率[26];4-Ca-Si处理后Pn、Ci、Gs 和Tr 均显著升高,这与郄亚微[27]在生菜上研究结果相似,因为加Si提高了其保水能力,避免因过度失水而使Gs 降低,进而提升了番茄的Tr 和Pn[17];8-Ca-Si 处理后升高效果更明显,此研究认为两者耦合处理更有助于植物捕获更多的光能,影响气孔导度提高净光合速率,从而缓解Ca(NO3)2胁迫对番茄光合作用的抑制[28]。
叶片水势与相对含水量是反应植物细胞水分状况的重要指标,根系水力学导度是植株根系对水分吸收及转运能力强弱的重要表现[29-30]。本试验中,与4-CK 相比,4-Ca 处理下相对含水量(图1)、叶片水势(图2)和根系水力学导度(图3)显著下降,这是因为盐胁迫打破了植株的正常水分代谢,造成了细胞失水[9,21]。CO2会增加植株根系总长和总表面积,从而促进根系吸水,进而改善植株水分情况[8];Si能降低盐胁迫对植株根系造成的损伤,提高根系吸水能力,从而维持植株体内水分平衡,提高植株耐盐性[27]。本研究发现,与4-Ca相比,8-Ca-Si处理后相对含水量和叶片水势显著提高,较单独施用效果更显著。说明Si 和CO2共同作用来促进植物根系吸水并减少水分向大气逸散,通过提高植物叶片水势和相对含水量对Ca(NO3)2胁迫做出响应[8,27];但8-Ca、8-Ca-Si 处理后植株根系水力学导度均下降(图3),这与李旭芬等[8]关于CO2加富处理显著影响Ca(NO3)2胁迫植株的根系构型,如根系总长和总表面积,但没有显著影响根系水力学导度的结论相吻合,可能是水分转运速度大于根系吸水速度,水分转运过快导致根系水力学导度下降。
MDA 和电解质渗漏率是衡量膜脂损伤程度的2 大指标[5],活性氧(ROS),如H2O2与O2-是植物生理代谢过程中产生的毒副产品,其大量积累会导致膜系统的损伤[31]。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)作为抗氧化系统的一部分,在清除植物体内的活性氧、减轻胁迫对膜脂的损伤、保护膜系统过程中发挥着重要作用[14]。本研究中,与4-CK 相比,番茄幼苗在4-Ca 处理后通过显著提高电解质渗漏率(图4)、MDA(图5)和H2O2(图6)含量及O2-(图7)产生速率来表现膜脂过氧化损伤和氧化应激,同时SOD、POD、CAT 活性的下降导致番茄的膜脂损伤程度进一步加剧,影响了植株的正常生长[32];而4-Ca-Si、8-Ca 和8-Ca-Si处理均显著提高了SOD 活性,进而降低了活性氧的生成,其中8-Ca-Si处理缓解效果更强,两者耦合处理后植株的抗氧化酶活性进一步提高,更快降低了膜脂过氧化损伤,促进植株养分的吸收和转运以缓解胁迫对植株的伤害[15,33]。由此可见,Si 和CO2耦合处理在缓解Ca(NO3)2胁迫时表现为协同效应。
4 结论
综上所述,外源施Si 或CO2加富可以通过提高净光合速率、水分代谢及抗氧化酶活性,降低活性氧的积累缓解Ca(NO3)2胁迫对植株生长发育的抑制,促进植株生长,且8-Ca-Si处理缓解效果最佳。

