心力衰竭临床预后预测模型研究进展
杨敏 殷跃辉, 陈芸霖 杨仙 易鑫 崔犇
(1.重庆医科大学研究生院,重庆 400010; 2.重庆医科大学附属第二医院心血管内科,重庆 400010)
心力衰竭(heart failure,HF)是由于心脏收缩或舒张功能障碍、心输出量不足而导致的以循环功能障碍为主要特征的临床综合征,是各种心血管疾病的严重阶段。据2021年中国心血管健康与疾病报告[1]推算,中国现有约890万HF患者。其发病率呈上升趋势,死亡率和再住院率居高不下,给卫生保健系统带来了巨大的经济负担。为实现HF患者的最佳监测和管理,需尽早识别高死亡风险的患者,决定开始盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonist,MRA)治疗、心脏再同步化治疗(cardiac resynchronization therapy,CRT)、左心室辅助装置或心脏移植等HF二线治疗的时机。因此,许多国家和地区的研究人员建立了各种风险预测模型用于评估、预测HF患者的病情危重程度和不良预后[2-11]。
2021年美国、欧洲和日本三大HF学会共同发布HF的分类共识[12],根据左室射血分数(left ventricular ejection fraction,LVEF),可将HF分为射血分数降低的HF(HF with reduced ejection fraction,HFrEF)、射血分数中间值的HF、射血分数保留的HF(HF with preserved ejection fraction,HFpEF)、射血分数改善的HF这4类。不同类型的HF发病机制、治疗方案、临床预后均有差异。不同HF模型纳入人群不同,其最佳适应患者人群也有所不同。现旨在针对不同HF类型患者人群,讨论各HF预后模型的应用,以期为临床医护人员提供指导。
1 HF预测模型
现有的HF预后预测模型众多,笔者根据不同HF类型分别对预测模型进行总结,并绘制成表,以期为评估HF患者临床预后提供参考(见表1)。
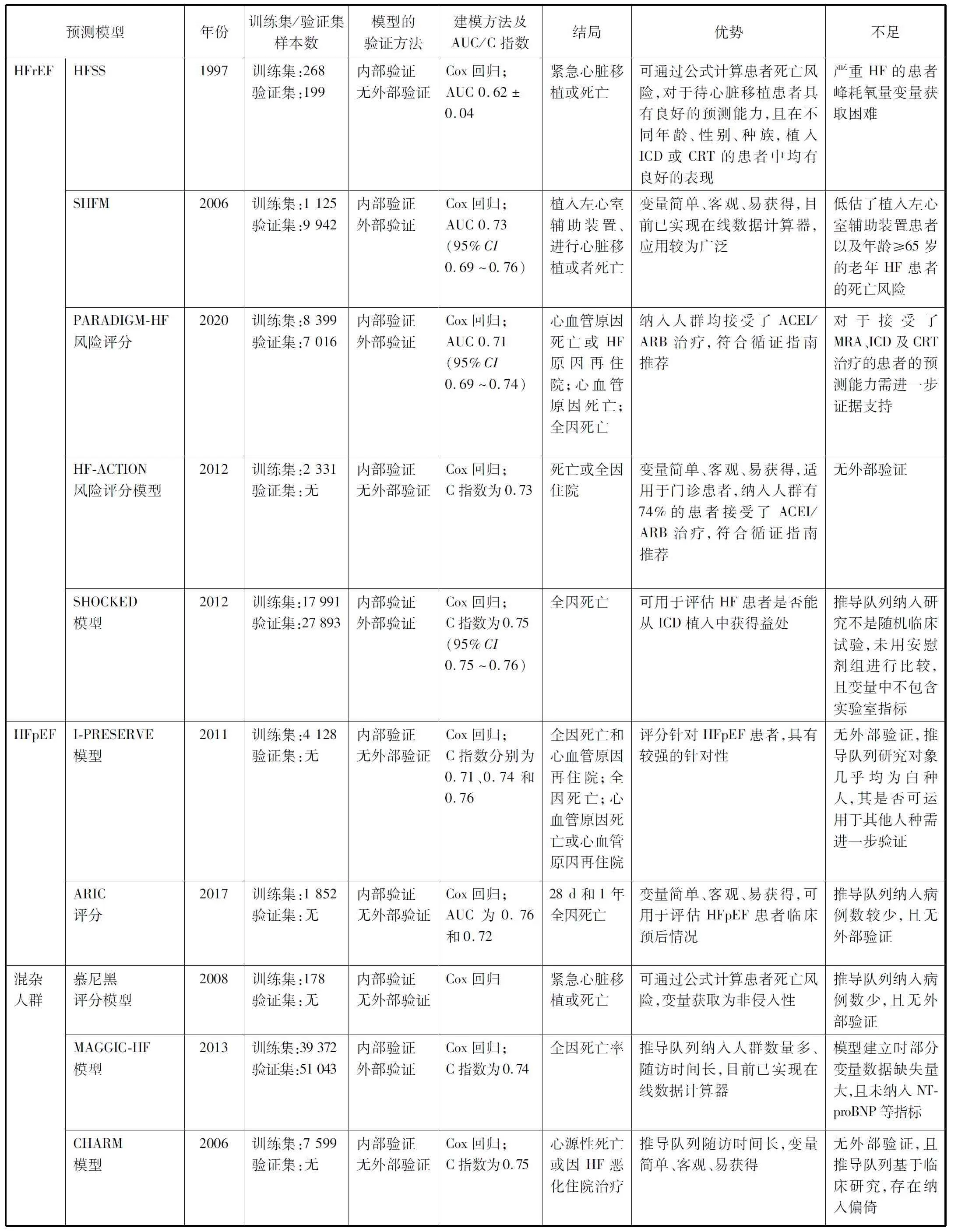
表1 HF临床预后预测模型内容及特点
1.1 HFrEF患者临床预后评估模型
1.1.1 HF存活评分
HF存活评分(HF survival score,HFSS)是由宾夕法尼亚大学医院的Aaronson等[2]在1997年设计开发的评分模型。该研究共纳入467例LVEF≤40%的晚期HF患者,包括268例患者的模型推导队列及199例患者的模型验证队列,结局事件定义为紧急心脏移植或死亡,通过Cox回归方法建立。包括侵入性和非侵入性模型,非侵入性模型包含QRS时限>120 ms、缺血性心肌病2个分类变量以及静息心率、平均动脉压、LVEF、血钠浓度、峰耗氧量5个连续变量,侵入性模型在此基础上增加了肺动脉楔压。根据模型最终得分可将HF患者分为高、中、低危3个风险等级,高危患者在1年发生紧急心脏移植或死亡的概率为中危患者的5倍、低危患者的12~21倍。
该模型的优点为推导队列和验证队列结果均提示其对于待心脏移植患者具有良好的预测能力,且该模型在不同年龄[13]、性别[14]、种族[15]的患者中,以及在接受了植入式心律转复除颤器(implantable cardioverter defibrillator,ICD)或CRT的患者中,均有良好的表现[16]。HFSS的缺点为需进行心肺运动测试以测量峰耗氧量,而严重HF患者往往因不能耐受而无法获得准确的数据。
1.1.2 西雅图HF模型
Levy等[3]从前瞻性随机氨氯地平生存评估试验中提取了1 125例LVEF<30%且纽约心功能分级(New York Heart function assessment,NYHA分级)为Ⅲ~Ⅳ级的HF患者数据,运用Cox回归方法建立了西雅图HF模型(the Seattle Heart Failure Model,SHFM),并同时在5个独立验证队列共9 942例患者中得到前瞻性验证。主要结局事件为植入左心室辅助装置、进行心脏移植或者死亡。该评分模型由10个分类变量[性别、缺血性心肌病、QRS>120 ms、β受体阻滞剂、血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)、血管紧张素Ⅱ受体阻滞剂(angiotensinⅡreceptor blocker,ARB)、保钾利尿剂、他汀类药物或别嘌呤醇、接受ICD或CRT]和10个连续变量(年龄、NYHA分级、LVEF、收缩压、血红蛋白、淋巴细胞计数、尿酸、总胆固醇、血清钠、利尿剂剂量)构成。该模型推导队列ROC曲线下面积(area under the curve,AUC)为0.73(95%CI0.69~0.76)。
后续研究[17-19]发现,SHFM在接受ICD或CRT等治疗的HF患者中也有良好的表现。Bilchick等[20]在SHFM基础上增加了心脏磁共振成像指标,结果显示其能有效预测CRT植入术后患者4年的长期生存风险,AUC为0.75。SHFM的缺点为低估了植入左心室辅助装置患者[21]以及年龄≥65岁的老年HF患者[22]的死亡风险。
1.1.3 PARADIGM-HF风险评分
PARADIGM-HF风险评分[4]建模队列由来自PARADIGM-HF研究中的8 399例符合NYHA分级Ⅱ~Ⅳ级,LVEF≤35%且N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)水平升高的HF患者组成,平均随访时间为27个月。结局事件分为3个:(1)心血管原因死亡或HF原因再住院;(2)心血管原因死亡;(3)全因死亡。运用Cox回归方法对3个不同终点建立了3个预测模型,NT-proBNP为最强的独立预测因子。模型验证队列数据来自ATMOSPHERE研究和瑞典国家心力衰竭登记处。该模型1年全因死亡的AUC指数为0.71(95%CI0.69~0.74)。
此模型的优点为全体患者均接受了ACEI/ARB治疗,符合循证指南推荐,缺点为仅有少量患者接受了MRA、ICD及CRT治疗,其是否可运用于当代HF患者仍需进一步验证。
1.1.4 HF-ACTION风险评分模型
O’Connor等[5]从HF-ACTION研究中提取了2 331例符合NYHA分级为Ⅱ~Ⅳ级,LVEF≤35%的HF患者,随机分为运动训练加常规治疗与单独常规治疗2个组,中位随访时间为2.5年,主要结局事件为死亡或全因住院。以死亡为终点的简化版预测模型包含心肺运动测试的持续时间、血尿素氮水平、体重指数、女性4个变量,C指数为0.73。
模型的优点:(1)该模型变量的获取相对简单,可在门诊操作;(2)该风险评分是在循证治疗的背景下进行的,其中有74%的患者使用了ACEI/ARB,40%的患者植入了ICD,使评分适用于广泛的HF患者。该模型缺点为纳入分析的变量不包括NT-proBNP水平、LVEF等与HF预后相关的变量,且未进行外部验证。
1.1.5 SHOCKED模型
为预测ICD植入后的患者4年内的死亡风险,Bilchick等[6]在2012年建立了SHOCKED模型。推导队列为从爱荷华州医疗保健基金会ICD登记处获得的17 991例植入ICD的HF患者,验证队列是从美国国家心血管数据库ICD登记处获得的27 893例于2005—2007年植入ICD的HF患者。结局事件定义为全因死亡,随访时间4年。SHOCKED模型分为简化版和完整版,C指数分别为0.75和0.73。简化版模型共纳入7个变量:年龄≥75岁、NYHA分级Ⅲ级、心房颤动、慢性阻塞性肺疾病、慢性肾脏疾病、LVEF≤20%以及糖尿病。
此模型的优点为其对卫生保健系统筛选可能从ICD植入中获得益处的患者具有重要意义。缺点为该研究不是随机临床试验,未用安慰剂进行比较,且变量中不包含实验室指标。
1.2 HFpEF患者临床预后评估模型
1.2.1 I-PRESERVE模型
I-PRESERVE模型[7]纳入了I-PRESERVE试验中4 128例LVEF≥45%的HFpEF患者的数据作为推导队列。主要结局分为3个:(1)全因死亡和心血管原因再住院;(2)全因死亡;(3)心血管原因死亡或心血管原因再住院,3个结局的C指数分别为0.71、0.74和0.76,显示出良好的区分度。最显著的相关因素是血浆NT-proBNP的对数水平、年龄、肾功能和入组前6个月内HF原因住院病史。
该模型的不足:其研究是基于有排除性标准的临床试验,与实际临床中的HF患者有差别;研究对象几乎均为白种人,对于其他人种并不一定适用;未在独立的HFpEF人群中进行验证。
1.2.2 社区动脉粥样硬化风险研究评分
社区动脉粥样硬化风险研究(Atherosclerosis Risk in Communities,ARIC)评分是由Thorvaldsen等[8]在2017年设计开发的风险评分。建模队列为1 852例来自ARIC研究中符合年龄≥55岁且LVEF≥50%的急性心脏失代偿性HF患者。主要结局为入组后28 d及1年内发生全因死亡。该评分包括年龄、收缩压、血尿素氮、血清钠、脑血管疾病、慢性阻塞性肺疾病和血红蛋白共7个变量。验证队列为ARIC研究中的821例急性心脏失代偿性HF患者。推导队列28 d和1年死亡率的AUC分别为0.76和0.72,显示出良好的区分度。
该模型的优点为严格纳入了HFpEF患者,后续可为这一人群的分诊、医疗资源使用决策提供实用、全面的信息,缺点为缺乏外部验证队列证实其泛化能力。
1.3 混杂人群临床预后评估模型
1.3.1 慕尼黑评分模型
Stempfle等[9]研究者于2008年通过前瞻性队列研究方法,共纳入178例LVEF<45%的慢性HF患者作为推导队列建立了慕尼黑评分模型。结局事件定义为紧急心脏移植或死亡。该模型共纳入55个基本变量及9个血流动力学参数变量,最终预测模型包含有5个重要的预测危险因素,分别为HF病因、左心室舒张末期内径、收缩压、最大负荷量和1年缩短分数的改变。根据模型分数,可将HF患者分为高、中、低危3个等级,1年内无主要不良心血管事件生存率分别为100%、91.9%和69.9%。
该模型的优点为非侵入性,但由于该模型推导队列中只有6%的人具有ICD,并不能反映当前的医疗水准。另该研究为单中心小样本研究,且缺乏验证队列。因此,未来仍需在外部队列中进一步验证其泛化能力。
1.3.2 全球慢性HF meta分析评分模型
全球慢性HF meta分析评分(the Meta-Analysis Global Group in Chronic HF score,MAGGIC-HF)[10]建模对象为来自30项研究共39 372例HFrEF或HFpEF患者,确定了13个独立变量来预测1年和3年的全因死亡率,包括年龄、LVEF、NYHA分级级别、血清肌酐、糖尿病、收缩压、体重指数、HF持续时间、吸烟、慢性阻塞性肺疾病、男性,以及使用了β受体阻滞剂、ACEI或ARB药物治疗。3年全因死亡的C指数为0.74。2014年,Sartipy等[23]使用瑞典国家心脏衰竭登记处的51 043例患者对该模型进行了验证,结果显示该模型将HF患者划分为不同风险等级的能力出色。
该模型的优点为推导队列纳入人群数量多、随访时间长。缺点为未纳入MRA、ACEI/ARB等治疗药物以及NT-proBNP、心肌肌钙蛋白等生物标志物。
1.3.3 CHARM模型
CHARM模型[11]建模队列由CHARM研究中提取的7 599例诊断为慢性HF的患者组成,所有患者均符合:年龄≥18岁,慢性HF症状持续至少4周。研究的主要终点为心源性死亡或因HF恶化住院治疗,平均随访时间为38个月,通过Cox回归方法建立。最强预测因素为年龄(≥60岁)、糖尿病和LVEF≥45%。该模型预测2年内发生心源性死亡或因HF恶化住院治疗的C指数为0.75,预测2年内发生全因死亡的C指数为0.75,显示出良好的区分度。
该模型的优点为随访时间长,且纳入各个层次射血分数的HF患者,因此允许更详细、精确地评估预测因子及其独立贡献。缺点为可能存在纳入偏倚,且该模型未包含如血红蛋白、肌钙蛋白、肌酐和NT-proBNP等已被证实与HF预后相关的血清学标志物[24-27]。
2 总结与展望
不同的HF预后模型,其建立目的不同,适合患者人群不同。对于HFrEF患者,仍推荐使用SHFM,该模型推导及验证队列样本量足,并通过多个外部队列的验证[28],故推荐。而对于HFpEF患者,I-PRESERVE模型和ARIC评分在建模队列中获得不错的C指数,但未来仍需开展外部验证进一步评估模型的预测性能。针对混合人群,MAGGIC-HF纳入患者数量多,随访时间长,外部验证提示该模型的预测能力强,故推荐。
综上所述,由于纳入的研究对象、HF类型、随访时间及模型构建方法的不同,HF临床预测模型呈现多样化的发展趋势,关于哪种预测模型应用效能更好尚无统一意见。临床医务人员在应用HF预测模型时,除了考虑模型的应用人群、预测效能等,还应结合临床实际问题具体分析。随着人工智能、大数据的发展,越来越多研究采用机器学习的方法构建HF临床预测模型,其能将复杂的临床数据简单化,具有省时、精准的特点,未来机器学习有望成为HF临床预后预测研究的新趋势。

