心房颤动患者左心耳流速与导管消融后复发的相关性:单中心研究
樊永强 吕华胜 刘佳琦 汤宝鹏 周贤惠 李耀东 邢强 张疆华 芦颜美
(1.新疆医科大学第一附属医院心脏中心起搏电生理科,新疆 乌鲁木齐 830054; 2.暨南大学附属第五医院(河源市深河人民医院),广东 河源 517000; 3.曹县人民医院心内科,山东 菏泽 274400)
心房颤动(atrial fibrillation,AF)是临床上最常见的快速性心律失常,可导致脑卒中、血栓栓塞事件、心力衰竭等不良结局。导管消融作为一线治疗方案,相比药物治疗,可以极大程度地改善症状及提高生活质量[1-2]。然而首次导管消融后的AF复发仍相对常见,识别消融后复发的预测因素对复发高危患者的管理至关重要。既往研究证实AF持续时间[3]、持续性AF、左心耳容积[4]、左心房低电压[5]等因素均可以在一定程度上预测AF的复发,但仍无有效预测参数。
左心耳作为左心房的附件,具有分泌利尿钠肽、减少左心房压力等作用,在AF的发生和维持方面起着至关重要的作用。左心耳电隔离可以减少非阵发性AF患者导管消融后心房心律失常事件的发生[6-7]。既往研究[8]提示左心耳可能是AF复发的一个起源点。当AF发生时,左心耳的收缩能力下降,血液瘀滞,血栓形成风险增加,经食管超声心动图检查可见左心耳收缩功能下降是由于左心耳流速(left atrial appendage velocity,LAAV)降低[9]。近年来的研究[10-11]显示LAAV的降低会增加持续性AF消融后复发的可能性,但也有研究[12-13]显示LAAV的降低预测AF复发并不可靠。现对首次接受导管消融的AF患者特征进行分析,探讨LAAV在首次导管消融后AF复发中的预测价值。
1 资料和方法
1.1 研究人群
回顾性分析2019年6月—2021年6月在新疆医科大学第一附属医院心脏中心首次进行导管消融的AF患者。根据《心房颤动:目前的认识和治疗建议(2021)》[2],将AF定义为经体表心电图或单导联心电记录装置记录到AF心电图且持续30 s以上。纳入标准:(1)年龄≥18岁的非瓣膜性AF患者;(2)术前完善经胸超声心动图及经食管超声心动图检查的患者;(3)接受定期随访的患者。排除标准:(1)心脏瓣膜病或曾行心脏瓣膜置换术或其他心脏手术的患者;(2)严重肝肾功能不全、合并恶性肿瘤的患者;(3)消融次数>1次的患者;(4)失访或资料不全的患者;(5)不接受随访的患者;(6)因其他因素造成患者死亡。
1.2 临床资料收集
收集所有纳入患者的临床基线资料,包括年龄、性别、AF类型、病程、CHA2DS2-VASc评分、吸烟史、高血压病史、糖尿病病史、冠心病病史,经胸超声心动图测得左室射血分数(left ventricular ejection fraction,LVEF),经食管超声心动图检查测得的左心耳功能及形态学指标,包括0°、45°、90°、135°的左心耳开口内径及深度,以及LAAV。
1.3 随访及终点事件
在患者术后第3个月、6个月、12个月进行门诊随访或电话随访,随访时间为1年。随访时患者需完善12导联心电图、超声心动图、24小时动态心电图等检查,如非随访期间患者出现心悸、疲劳、胸闷等症状需额外完善心电图检查。随访的主要终点为AF复发,根据随访过程中是否复发AF将患者分为复发组和未复发组。AF复发定义为射频消融术后出现的任何心电记录装置记录到的AF、心房扑动、房性心动过速,持续时间30 s以上。
1.4 统计学处理
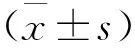
2 结果
2.1 基线资料
本研究共纳入268例患者,平均年龄(60.10±11.11)岁,男性176例,女性92例,阵发性AF 206例,持续性AF 62例。随访过程发现49例患者(18.28%)出现不同时间的AF复发。根据患者是否出现AF复发将患者分为复发组和非复发组,结果显示复发组患者AF类型多为持续性AF(P=0.001),且复发组患者的45°左心耳开口深度大于非复发组[(28.06±7.09) mm vs (26.01±6.11) mm,P=0.04],但LAAV较低[(0.51±0.22) m/s vs (0.59±0.22) m/s,P=0.033],两组患者在其他基线资料上无统计学差异(表1)。
表1 复发组和非复发组患者基线资料
2.2 LAAV的预测价值
根据ROC曲线分析预测AF复发的最佳LAAV临界值为0.495 m/s,其灵敏度为67.12%,特异度为55.10%,曲线下面积为0.60(95%CI0.516~0.698,P=0.018 9,图1)。根据最佳临界值0.495 m/s,将患者分为LAAV正常组(LAAV>0.495 m/s)和LAAV减低组(LAAV≤0.495 m/s),LAAV正常组的术后AF事件发生率显著低于LAAV减低组(long-rankP=0.004,图2A)。无论是阵发性AF还是持续性AF患者,LAAV正常组和LAAV减低组相比的术后AF事件发生率均无统计学差异(long-rankP=0.223,图2B,long-rankP=0.068,图2C)。
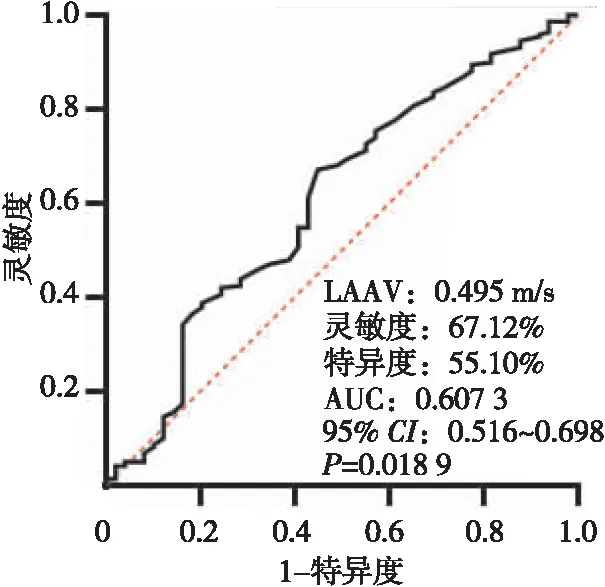
注:AUC为曲线下面积。图1 ROC曲线分析评估LAAV预测射频消融后AF复发
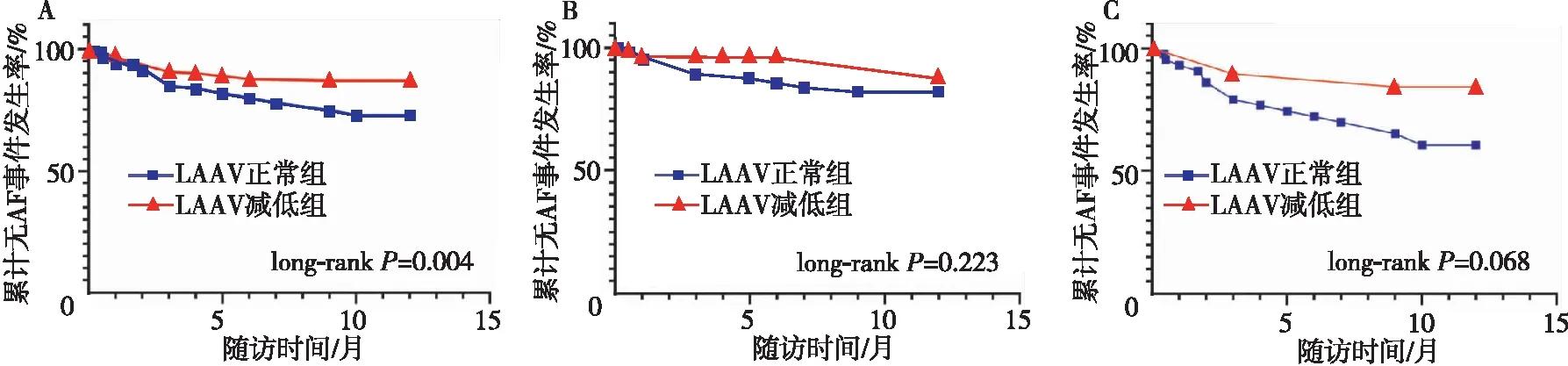
注:A,LAAV对导管消融后无AF事件发生率的Kaplan-Meier曲线;B,阵发性AF患者LAAV对导管消融后无AF事件发生率的Kaplan-Meier曲线;C,持续性AF患者LAAV对导管消融后无AF事件发生率的Kaplan-Meier曲线。图2 LAAV对导管消融后无AF事件发生率的Kaplan-Meier曲线
2.3 射频消融后AF复发的单因素和多因素分析
单因素分析显示射频消融后AF复发与AF类型、体重指数、LAAV≤0.495 m/s、左心房内径、左心耳45°开口深度相关。将上述指标纳入多因素Cox回归模型中发现,AF类型(HR=1.929,95%CI1.017~3.658,P=0.044)、体重指数(HR=1.094,95%CI1.005~1.192,P=0.038)、LAAV≤0.495 m/s(HR=1.947,95%CI1.034~3.664,P=0.039)是影响AF复发的独立危险因素(表2)。在不同AF类型患者中,无论是阵发性AF还是持续性AF,上述基线变量的单因素分析均未见统计学差异(表3)。

表2 AF复发患者的单因素和多因素分析

表3 阵发性AF及持续性AF患者导管消融后复发的Cox分析
3 讨论
据早期报道[14-16],8.7%~37.0%的患者在导管消融后1年内发生AF复发。笔者纳入研究的268例患者中,49例(18.28%)出现不同时间的AF复发。此外,研究发现复发组患者的左心耳开口深度更深,左心耳峰值流速更低,持续性AF患者比例更大,这与Istratoaie等[17]的研究结果相似。
左心房的重构是AF发展和维持中的重要因素,包括左心房扩大、纤维化程度增加等。既往研究[18]显示左心房扩大是AF复发的因素之一,然而本研究中复发组患者与非复发组患者的左心房内径不存在差异,且基于多因素Cox回归分析发现左心房内径的大小并不是AF复发的独立预测因素,这可能是由于本研究纳入了部分持续性AF患者。
左心耳的顺应性大于左心房,因此在左心房发生重构、扩大、低电压区增多等变化时会反映为左心耳的扩大,左心耳的改变要早于左心房。随着左心耳的扩大,左心耳内血液瘀滞,血流减少,造成LAAV减慢[19],故LAAV在AF复发中的预测价值可能大于左心房内径、左心耳形态学等指标。本研究发现较低的LAAV(≤0.495 m/s)是AF复发的危险因素,这与之前报道的研究结果相似[20]。Kanda等[21]将LAAV作为左心耳功能的指标,首次在持续性AF患者中证明了较低的LAAV与AF复发有关,其预测AF复发的LAAV最佳值为0.28 m/s。Kiebasa等[22]在包含471例接受冷冻球囊消融的阵发性AF患者中也证明了LAAV的预测价值,LAAV的最佳预测值为0.45 m/s,这是目前已知的样本量最大的研究。然而,Wei等[13]的研究表明LAAV不是导管消融后复发的独立预测因素,可能是由于研究纳入的患者基线资料不同所致。此外,本研究发现肥胖也是消融后复发的独立危险因素,可能是由于肥胖会导致左心房压力、容积增加,引起结构重构[23]。
持续性AF患者AF持续时间较长,心率较快,左心耳的顺应性及排空能力减低,血流呈现持续性的低流速。本研究中持续性AF患者中各指标的单因素Cox分析无明显统计学差异,这可能是由于本研究纳入的患者相对较少,持续性AF患者的LAAV降低可能是AF复发的潜在危险因素(HR=2.919,P=0.087),对临床诊疗具有一定的提示作用。
本研究结果可能有助于患者的个性化治疗,既往或术前经食管超声心动图检查提示LAAV较低的患者可考虑延长抗心律失常药治疗时间,增加除肺静脉隔离以外的消融策略等措施或许有助于降低术后复发的可能性。本研究为单中心回顾性研究,随访时间较短,为术后1年内的结论,尚不能说明LAAV对术后1年以上AF复发的预测价值。此外,随访期间并未对患者进行持续性心电监测,可能遗漏复发的AF患者,研究结果还需多中心、前瞻性、随机对照研究进一步验证。

