急性心肌梗死交感应激相关生物标志物研究进展
范勇兵 李静林 赵威
(北京大学第三医院心内科,北京 100191)
急性心肌梗死(acute myocardial infarction,AMI)是常见的心血管疾病,尽管近年来对其的治疗已经取得较大进步,但中国AMI的死亡率仍呈快速上升趋势,严重威胁人们的生命健康[1]。目前,以心肌肌钙蛋白为代表的经典心血管生物标志物对AMI的临床诊疗发挥了巨大价值。因此,寻找新型生物标志物以提高对AMI的认识仍是未来的重点研究方向。交感应激是AMI发生、发展过程中的重要一环。近期研究表明,交感应激相关生物标志物水平变化对AMI具有重要意义。现阐述这一领域的研究进展,为AMI的早期诊断、风险分层及预后提供新思路。
1 交感应激与AMI
通常认为,交感应激是机体受到各种内外环境因素刺激时出现的以蓝斑-交感-肾上腺髓质系统功能亢进为特征的非特异性全身反应,是一种交感神经系统(sympathetic nervous system,SNS)持续过度兴奋的状态。
AMI以复杂的交感神经激活为特征。在AMI早期,交感神经激活是一种代偿性反应,可加快心率并增强心肌收缩力,从而起到维持心输出量以对抗血流动力学紊乱的作用。但交感神经持续、过度激活则会加速心肌细胞损伤并诱导心律失常,使心功能进一步恶化,对机体产生不利影响。交感应激对AMI后的心脏损伤主要涉及以下几个机制:炎症反应、凝血及抗凝系统失衡、心脏电活动异常、神经内分泌激活等[2]。上述机制共同作用,最终引发各种不良心脑血管事件,见图1。
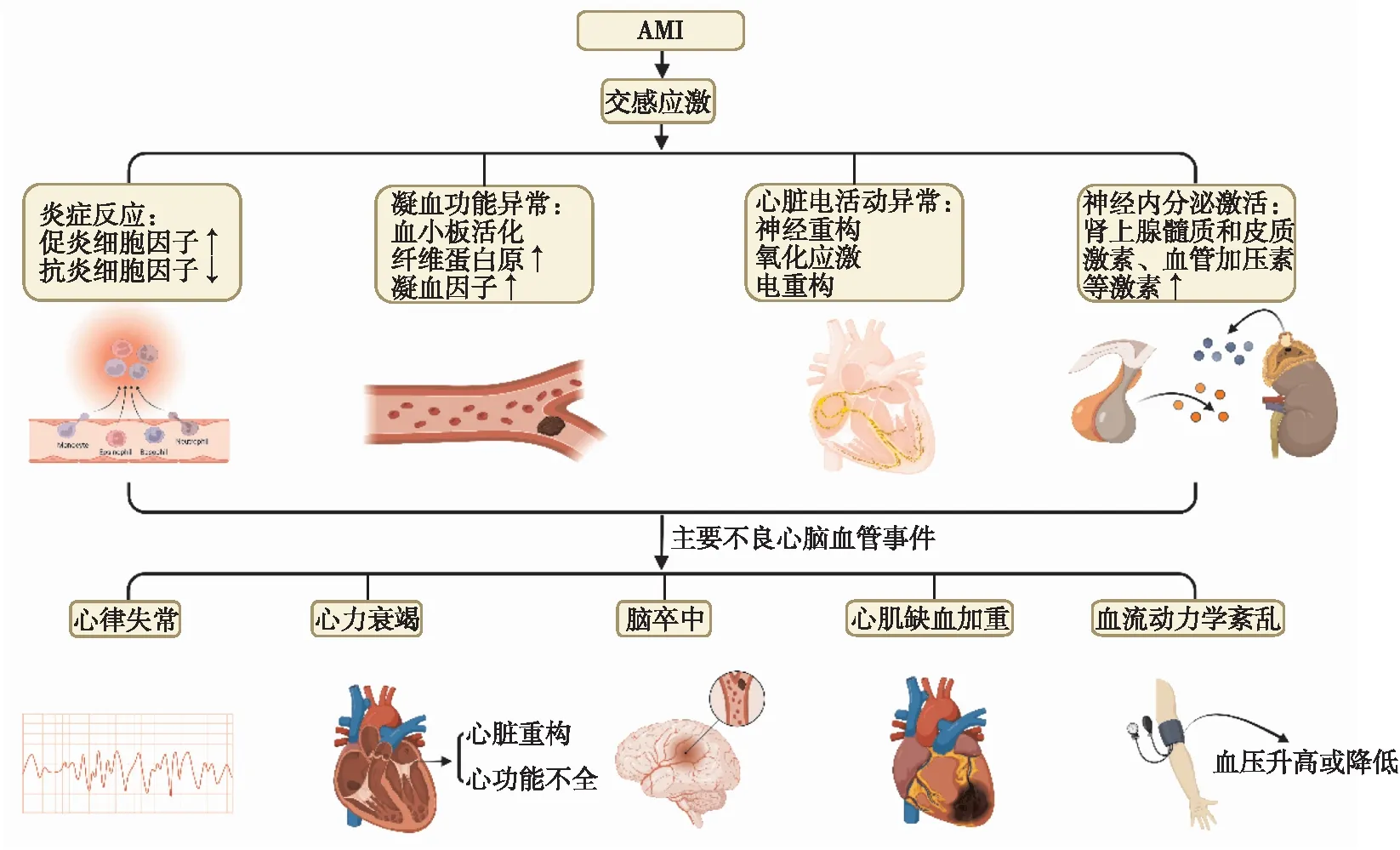
图1 交感应激对心脏的损伤机制
2 交感应激的评估与治疗方法
鉴于交感应激在AMI中的有害作用,评估并减弱交感神经活性成为AMI管理的重点。
交感神经活性的评估方法主要包括心率变异性、神经递质检测、心脏交感神经显像以及交感神经活动记录等。心率变异性及儿茶酚胺检测操作简便、价格低廉,是临床上常用的交感神经活性评估方法。123I-间碘苄胍显像、11C-羟基麻黄碱正电子发射体层成像等技术可无创评价心脏交感神经功能,在心力衰竭预后的评估、心肌缺血的诊断以及致命性心律失常的预测等方面均显示出较大价值,但因放射性核素显像剂制备工艺困难及成本昂贵,目前尚未在临床上普及[3]。皮肤交感神经活动记录通过心电图电极连续24 h记录心脏交感神经放电活动,可用于实时监测交感神经兴奋性变化[4],有望成为心血管疾病患者病情监控的有力工具。
针对交感应激的治疗措施包括应用交感神经阻滞剂、运动和交感神经消融治疗等。β受体阻滞剂在临床上广泛应用于心肌梗死患者的长期治疗,有助于减弱交感神经活性,降低心肌耗氧量,改善心血管预后。规律有氧运动也被证实能够降低交感神经张力,减少心肌梗死后室性心律失常的发生[5]。肾交感神经去支配是一种新型治疗方法,通过导管消融的方式毁损肾动脉外膜上的交感神经传入和传出纤维,使全身交感神经兴奋水平下降,从而阻断交感应激的不利影响[6],为心肌梗死后心力衰竭的患者带来新的希望。
3 AMI与交感应激相关标志物
AMI期间交感神经激活可引发一系列病理生理变化,使得交感神经递质或其直接下游产物水平发生变化,最终加剧心脑血管损伤。最近的研究表明,交感神经递质或其直接下游产物水平变化对AMI 患者的诊断、风险分层及预后显示出一定价值,现就这一领域的研究展开综述。
3.1 应激性高血糖
应激性高血糖(stress hyperglycemia,SHG)通常是指非糖尿病患者在急性疾病或损伤时出现的暂时性高血糖。SHG在AMI患者中很常见,其发生率为25%~50%,可通过入院血糖(admission blood glucose,ABG)、应激性血糖升高比值(stress hyperglycemia ratio,SHR)或血糖间隙等指标来反映[7-8]。在AMI急性期,交感肾上腺系统过度激活使肾上腺素(epinephrine,E)和去甲肾上腺素(norepinephrine,NE)分泌增多,刺激肝脏糖异生和糖原分解,促使机体血糖快速上升,这是机体的一种自我保护反应,有助于机体在严重应激状态下存活。然而,血糖急性升高同时也会引发炎症和氧化应激反应,导致AMI患者凝血状态异常、内皮功能及微循环功能障碍等,进而使得冠状动脉血流受损、心肌梗死面积增加和心功能恶化。
3.1.1 ABG与AMI预后
ABG可表示为入院即刻血糖、入院空腹血糖和入院随机血糖。研究[9]发现,入院即刻高血糖是AMI患者院内死亡的独立危险因素,入院即刻血糖升高的患者严重心力衰竭(P=0.001)、心律失常(P=0.004)、心源性休克(P=0.044)和死亡(P=0.008)等临床不良结局的发生率显著增加,这种相关性与患者糖尿病史和血糖控制水平无关,提示临床医生在治疗AMI时应格外注意患者的ABG情况。ABG与AMI的长期预后也有关联。Cui等[10]研究发现,入院空腹血糖水平与糖尿病、糖尿病前期、血糖调节正常的AMI患者的2年全因死亡率均存在强烈正相关,其预测AMI合并糖尿病、糖尿病前期或血糖调节正常的患者2年全因死亡率的最佳临界值分别为9.0、7.2和6.2 mmol/L。此外,将ABG添加到包含传统危险因素的模型中,可提高对糖尿病和血糖调节正常的AMI患者2年全因死亡风险预测的识别能力。然而,一项针对1 288例AMI患者的研究[11]发现,入院空腹血糖水平是非糖尿病患者15个月全因死亡率和主要不良心脑血管事件的独立预测因子,其临界值为6.77 mmol/L。相比之下,入院空腹血糖不是AMI合并糖尿病患者预后的独立预测指标。这些研究结果之间的差异可能与他们使用不同的ABG阈值定义SHG有关,也可能与ABG受到急性应激状态和基础血糖水平的双重影响有关,这表明ABG在临床应用中具有一定局限性,可能难以准确反映急性疾病时SHG的程度。
3.1.2 SHR与AMI预后
SHR为ABG除以根据糖化血红蛋白(glycosylated hemoglobin,HbA1c)估计的平均血糖(estimated average glucose,eAG)。其中eAG=1.59 × HbA1c-2.59。Gao等[12]研究表明,在AMI合并糖尿病的患者中,相比于ABG,SHR能更好地预测急性肾损伤、住院死亡率和发病率。此外,SHR与AMI患者的院内死亡率和长期死亡率之间均显示出强烈的正相关,这种相关性与患者是否合并糖尿病无关。对于区别院内和长期死亡率风险高的患者,SHR的最佳临界值略有不同,SHR预测糖尿病和非糖尿病人群院内高死亡风险的最佳临界值分别为1.06和1.26,而对2年高死亡风险预测的最佳临界值则分别为1.20和1.08[13-14]。这些结果提示SHR可作为AMI患者危险分层的有效标志物。
3.1.3 血糖间隙与AMI预后
血糖间隙是ABG与eAG的差值。研究[15]发现,ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)患者的血糖间隙增大,其可作为STEMI后发生心肌缺血再灌注损伤的独立危险因素,且对心肌缺血再灌注损伤的发生有一定的预测价值。不仅如此,血糖间隙还与左室射血分数下降和梗死后左室舒张功能障碍的风险增加密切相关。对于伴有糖尿病的STEMI患者,血糖间隙确定梗死后左室舒张功能障碍高危患者的能力优于ABG[16]。
3.2 交感神经共递质
3.2.1 儿茶酚胺
AMI激活SNS,导致E和NE的循环水平升高。在早期,E和NE对维持心功能具有一定代偿作用,但同时也会对心肌产生毒性作用。儿茶酚胺作为AMI的预后生物标志物已被广泛研究,AMI后循环儿茶酚胺水平升高常提示患者预后不佳。最近的研究[17]表明血浆儿茶酚胺水平与AMI后心力衰竭和死亡率独立相关,这与先前的研究结果保持一致。然而,儿茶酚胺稳定性较差,需要快速复杂的分析技术才能准确测定。除此之外,儿茶酚胺循环水平容易波动,疾病期间出现的疼痛、焦虑也会导致机体儿茶酚胺释放增加,这些因素限制了儿茶酚胺的临床应用。
3.2.2 神经肽Y
神经肽Y(neuropeptide Y,NPY)是一种高度保守的多肽,其广泛分布于中枢和外周神经系统。在外周神经系统,NPY主要存在于神经节后的交感神经元。交感神经兴奋时,NPY与NE共同释放,从而发挥“共递质”的作用。NPY在心脏中含量丰富,具有血管收缩、血管生成、心脏重构等重要生理作用。Cuculi等[18]研究发现,在STEMI患者中,外周静脉(peripheral vein,PV)中NPY水平显著升高,并且在至少48 h内保持高水平。对于直接经皮冠状动脉介入治疗后发生血管无再复流、ST段回落不良和冠状动脉血流储备受损的患者,其血浆NPY水平则更高。在此基础上,随后的研究[19]进一步证实,AMI后PV和冠状静脉窦的NPY水平升高与冠状动脉微血管功能障碍、心肌梗死面积增大、STEMI术后6个月的左室射血分数和心室扩张明显降低有关,表明NPY可能在STEMI早期心肌再灌注中起到有害作用。此外,在行再灌注手术后的STEMI患者中,PV中NPY水平升高与随后的室性心律失常、心力衰竭和死亡率增加相关,提示PV中NPY水平可作为一种预后标志,用于这类患者的风险分层[20-21]。
3.2.3 嗜铬粒蛋白A
嗜铬粒蛋白A(chromogranin A,CgA)属于颗粒蛋白家族,是一种可溶性多肽,在肾上腺髓质和交感神经囊泡中与儿茶酚胺共同储存和释放,以响应交感肾上腺系统激活。CgA也存在于人心室肌细胞中,与脑利尿钠肽共定位。CgA在心血管疾病中具有重要作用,可以降低血管通透性,或者通过裂解成某些生物活性肽,发挥舒张血管和抑制儿茶酚胺释放的作用。Estensen等[22]的临床研究表明,AMI后早期血浆CgA水平升高,血浆CgA是AMI合并心力衰竭或心功能不全患者死亡和住院的强独立预测因子。此外,对于心肌梗死合并心力衰竭或心功能不全的患者,CgA与N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)提供的预后信息可相互补充。CgA和NT-proBNP水平均高于中位数的患者预后最差,而其水平均低于中位数的患者预后最好。高CgA和低NT-proBNP水平的患者比低CgA和高NT-proBNP水平的患者预后更差。
3.3 脂肪酸结合蛋白4
脂肪酸结合蛋白4(fatty acid-binding protein 4,FABP4)也称为aP2,在脂肪组织中大量表达,作为细胞内脂质伴侣发挥作用,介导脂质代谢和炎症。在AMI时,心脏交感神经末梢释放大量的NE,诱导心脏周围脂肪组织的脂解,从而导致FABP4循环水平升高。在交感神经显著激活期间,FABP4与NE的水平具有明显的相关性[23],这表明FABP4可能是一种交感肾上腺系统激活的潜在标志物。此外,FABP4还与AMI患者冠状动脉病变程度及预后相关。王钻锦等[24]研究表明,血清中的FABP4与NT-proBNP水平和SYNTAX(Synergy between PCI with TAXUSTMand Cardiac Surger)评分呈正相关。多因素logistic回归分析发现,血清FABP4水平是AMI患者经皮冠状动脉介入治疗术后发生主要不良心血管事件的危险因素,其预测准确性高于血清NT-proBNP水平及SYNTAX评分。
3.4 唾液α淀粉酶
唾液α淀粉酶(salivary alpha-amylase,sAA)是一种由唾液腺分泌的蛋白酶。唾液腺中含有丰富的β肾上腺素受体,交感神经末梢释放的NE可增加唾液腺的活性,从而导致sAA分泌增加,因此sAA活性反映了儿茶酚胺能的变化,可作为SNS激活的非侵入性替代标志物。Shen等[25]在对91例STEMI患者的研究中发现,sAA活性增高与恶性心律失常风险增加相关。简单logistic回归分析显示,sAA是STEMI患者短期预后的独立预测因子。在此研究基础上,他们通过检测急诊室胸痛患者在胸痛发作4 h内的sAA活性,发现sAA活性可以作为急性胸痛患者AMI的早期诊断指标,其诊断AMI的敏感性和特异性分别为78.8%和74.5%,当与肌钙蛋白I相结合时,其敏感性和特异性均进一步提高,分别为88.3%和78.4%[26]。这表明sAA活性对AMI的诊断和预后均有一定价值。
4 总结及展望
如前所述,交感应激相关生物标志物已被证实对AMI的诊断、风险分层以及预后等方面均显示出一定价值。但事实上,目前确定的许多生物标志物只能反映AMI某种特定的病理生理过程,具有一定局限性,主要表现为难以兼备较高的敏感性和特异性,或者敏感性和特异性均不高,因此很少应用于临床实践。将多种生物标志物联合应用有助于弥补单一生物标志物的缺陷,从而提高对AMI的诊断、风险分层以及预后的效能。因此,未来可着眼于交感应激相关标志物与其他心血管生物标志物的联合应用,并探讨其作为AMI潜在治疗靶点的可能性,为AMI患者带来福音。

