去甲肾上腺素与多巴胺对急性心肌梗死后低血压状态应用比较
杨萌萌 王引利
(西南交通大学附属医院 成都市第三人民医院心内科 成都市心血管病研究所,四川 成都 610031)
急性心肌梗死(acute myocardial infarction,AMI)是心内科常见的急危重症,随着对AMI患者救治能力的提高,尤其是急诊经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的广泛开展,该类患者存活率大幅提升。但AMI后低血压状态的患者,仍有较高的死亡风险,低血压不仅是早期院内死亡的独立危险因素[1],也是AMI术后一年出现主要不良心血管事件的独立预测因素[2]。目前国内外相关指南均推荐首选去甲肾上腺素(norepinephrine,NE)为AMI合并心源性休克(cardiogenic shock,CS)的一线用药[3-5],但对AMI后低血压状态的患者,并无明确的血管活性药推荐建议;国内外也只有零星报道。因此,本研究采用回顾性队列研究方法,选取2013年1月—2021年12月成都市第三人民医院心内科收治的全部AMI后低血压状态患者共120例作为研究对象,以NE及多巴胺(dopamine,DA)为不同暴露因素,以院内死亡为主要结局,院内发生心律失常为次要结局,对两种药物进行对比研究,对其进行有效性及安全性比较,现报道如下。
1 资料与方法
1.1 研究对象
本研究为回顾性队列研究,通过电子病案查询系统,选择成都市第三人民医院心内科2013年1月—2021年12月收治的全部AMI后低血压状态的患者为研究对象。纳入标准:(1)符合2018年美国心脏病学会发布的第四版心肌梗死通用定义:有缺血性胸痛症状、新发缺血性心电图改变、新发病理性Q波形成、新发存活心肌丢失或室壁节段运动异常影像学证据、冠状动脉造影或腔内影像学证实冠状动脉血栓;(2)血压≤90/60 mm Hg(1 mm Hg=0.133 3 kPa)或平均动脉压下降超过30 mm Hg,且持续超过30 min,无周围循环衰竭(意识障碍、四肢厥冷、少尿或无尿等)症状出现。排除标准:(1)合并其他严重疾病,如主动脉夹层、肺栓塞、消化道出血、严重肝肾功能不全、心脏破裂、心脏压塞等;(2)合并其他原因引起的低血压状态,如严重感染、疼痛、失血、过敏、血管扩张药使用过量等;(3)使用单联血管活性药不足以维持血压,需联合用药或使用主动脉内球囊反搏等机械辅助装置者;(4)入院后短期死亡者(时间<24 h),或因放弃治疗选择自动离院者;(5)基础血压偏低;(6)CS。最终120例患者纳入研究,其中NE组72例,DA组48例。研究通过本院医学伦理会批准(成都三院伦[2022]S-90)。
1.2 治疗方式及数据采集
1.2.1 药物治疗
确诊患者均给予标准药物治疗,包括阿司匹林肠溶片100 mg+氯吡格雷75 mg口服,每日一次(或替格瑞洛90 mg口服,每日两次);双联抗血小板、阿托伐他汀20 mg 口服,每晚一次(或瑞舒伐他汀10 mg口服,每晚一次)。对接受直接PCI的急性ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)患者,术前静脉推注普通肝素(70~100 U/kg),维持活化凝血时间250~300 s;或使用依诺肝素0.5 mg/kg静脉推注。对已经使用适当剂量依诺肝素而需PCI的患者,最后一次皮下注射在8 h以内,术前不增加剂量;若在8~12 h之间,评估出血风险后,使用依诺肝素0.3 mg/kg静脉推注[6]。对于急性非ST段抬高型心肌梗死(non-ST segment elevation myocardial infarction,NSTEMI)患者,低分子肝素(主要是依诺肝素)1 mg/kg,12 h一次,最多连续使用8 d,或用至血运重建前[7]。对收缩压持续<90 mm Hg,或平均动脉压<60 mm Hg的患者,使用血管活性药。给药剂量范围:静脉滴注NE初始剂量为8~12 μg/min,维持剂量为2~4 μg/min,必要时可增加剂量,但不宜超过25 μg/min。静脉滴注DA初始剂量为5~15 μg/(kg·min),根据血压调整剂量,必要时可增加至≥15 μg/(kg·min)。目标为将血压维持在90/60 mm Hg以上,或将平均动脉压维持在70 mm Hg以上。
1.2.2 再血管化治疗
具有手术机会及手术意愿的患者,行冠状动脉造影及血运重建。对STEMI患者,满足以下任意一条,选择直接PCI术:(1)胸痛发病12 h以内的患者;(2)院外心搏骤停复苏成功的STEMI患者;(3)STEMI患者发病超过12 h,但仍有胸痛症状且心电图有缺血改变,临床表明和心电图变化支持进行性缺血的证据。对NSTEMI患者,根据年龄、心率、收缩压、肌酐、Killip分级、入院前是否发生心搏骤停、心电图ST段抬高、心肌坏死标志物升高进行GRACE评分,并进一步进行危险分层。极高危患者2 h内行再血管化治疗,高危患者24 h内行再血管化治疗,低危患者72 h内行再血管化治疗。对NSTEMI患者,满足以下任意一条,选择直接PCI术[6]:(1)血流动力学不稳定;(2)进行性胸痛,药物治疗无效;(3)出现机械并发症;(4)急性心力衰竭;(5)ST段或T波反复动态变化。
1.2.3 血指标及心功能测定
入院次日清晨,采集空腹静脉血标本6 mL,使用美国Beckman Coulter公司的DXC-800全自动生化分析仪对心肌肌钙蛋白T(cardiac troponin T,cTNT)、凝血功能、脑利尿钠肽(brain natriuretic peptide,BNP)、尿酸、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、总胆红素、谷丙转氨酶、谷草转氨酶、白蛋白、肌酐、血钾等指标进行检验。使用飞利浦IE Elite彩色多普勒诊断仪进行图像及数据采集,探头频率为2.0~4.0 MHz,相关工作由超声心动图专科医生负责完成。取左心室长轴切面,测左心室舒张末期内径及左心室收缩末期内径,并自动计算左室射血分数(left ventricular eject fraction,LVEF)。
1.2.4 观察项目及监测方法
通过电子病案查询系统查阅病历首页、病程记录,搜集患者年龄、性别、合并症[原发性高血压、2型糖尿病(type 2 diabetes mellitus,T2DM)]等基本信息。通过查阅化验单,获取BNP、cTNT、尿酸、肌酐、LDL-C、血钾、总胆红素、白蛋白、谷丙转氨酶、谷草转氨酶等检验数据。通过查阅入院时心电图、术前心脏彩超等检查确定LVEF、STEMI、前壁心肌梗死、右心室及下壁心肌梗死比例。通过查阅手术记录确定再血管化比例及再血管化时间。使用Mindray N10床旁心电监护仪,监测心率、无创血压,观察患者使用血管活性药后心率、血压变化情况。并通过电子病案查询系统查阅用药期间心电图、病程记录及护理记录,统计用药过程中引起不适症状或血流动力学紊乱的心律失常(快心室率心房颤动、室性心动过速、心室颤动)。
1.3 数据分析
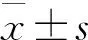
设置距离出入口3~5m处,根据无明显出口建筑物(无盖出入口)可简单分为两类,其中有明显的出口建筑物使用1型标识柱,无飞顶建筑物使用2型标识柱。
2 结果
2.1 一般情况
两组患者年龄、性别、合并症(原发性高血压、T2DM)、BNP、cTNT、尿酸、肌酐、LDL-C、血钾、总胆红素、白蛋白、谷丙转氨酶、谷草转氨酶、LVEF、STEMI比例、前壁心肌梗死比例、再血管化比例,再血管化时间比较均无明显统计学差异(P≥0.05),见表1。
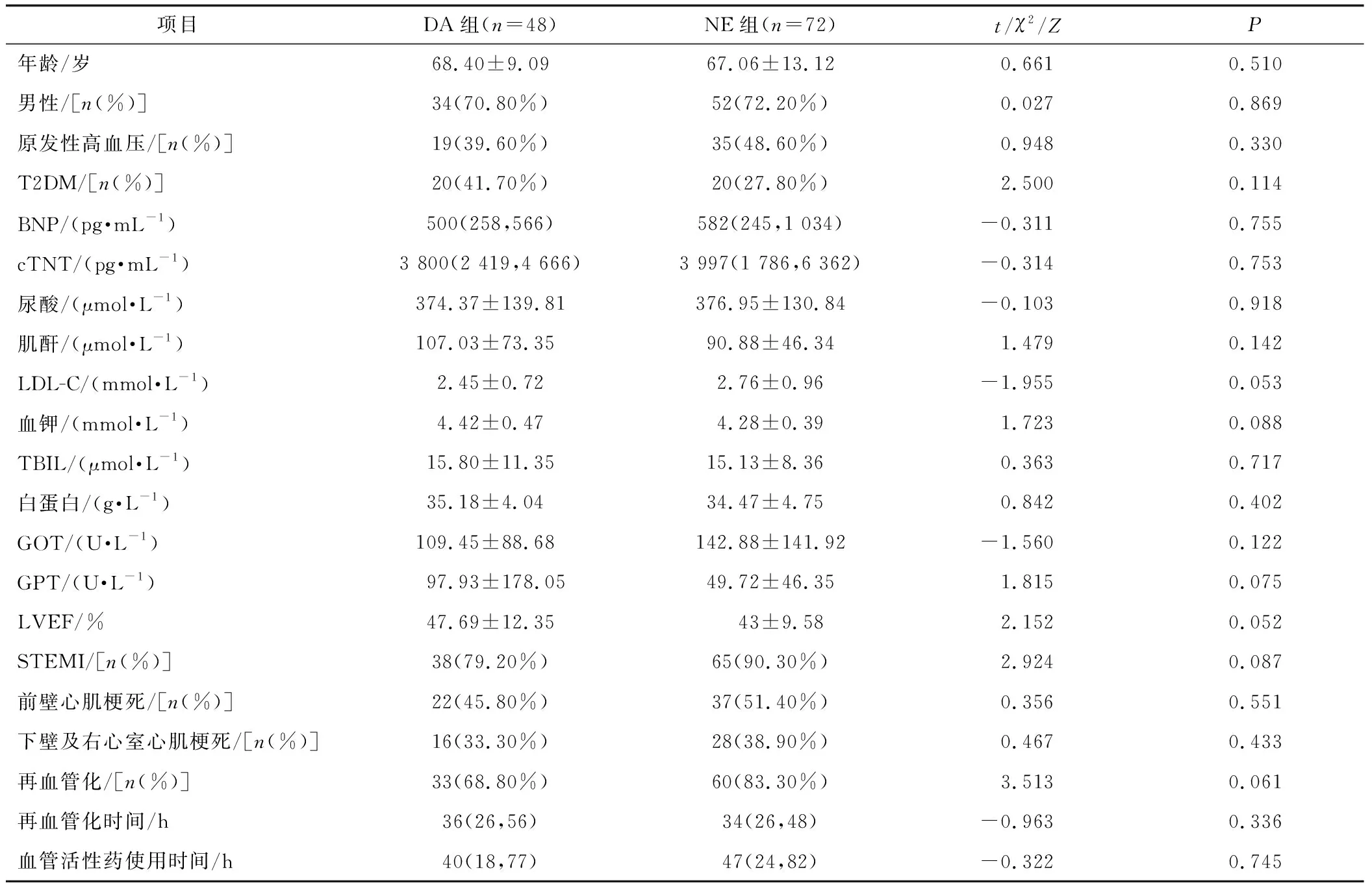
表1 临床基线资料
2.2 血流动力学变化情况
两组患者用药前及用药后12 h心率、血压比较无统计学差异(P≥0.05);用药后6 h两组患者心率差异无统计学意义(P≥0.05),收缩压及舒张压差异均具有统计学意义(P=0.038,P=0.045),见表2。
2.3 不良事件
两组患者住院期间,心律失常发生率无统计学差异(P≥0.05),NE组院内死亡率(5.60%)明显低于DA组(22.90%),二者差别具有统计学意义(χ2=6.429,P=0.011),见表3。

表3 住院期间不良事件
2.4 院内死亡的单因素logistic回归分析
在单因素logistic回归分析中,以患者是否发生院内死亡为因变量,对可能影响预后的因素进行单因素logistic回归分析。两组患者cTNT、再血管化时间、男性比例、原发性高血压发生率、T2DM发生率、STEMI发生率比较,差异均无统计学意义(P≥0.05);两组患者年龄、LVEF、BNP、肌酐、LDL-C、血钾、白蛋白、前壁心肌梗死比例、再血管化比例、DA使用率比较,差异有统计学意义(P<0.05),见表4。
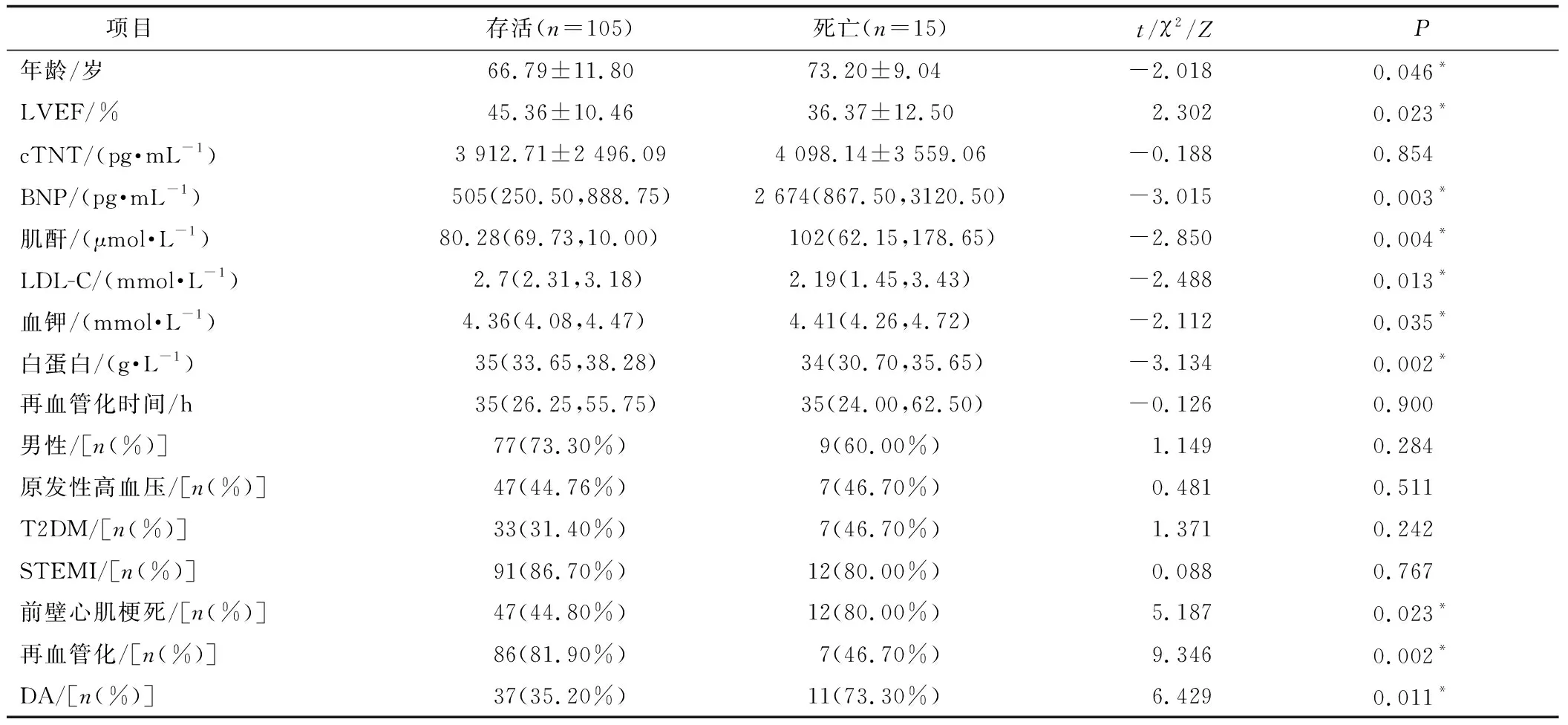
表4 AMI后低血压状态的患者院内死亡的单因素logistic回归分析
2.5 院内死亡的多因素logistic回归分析
在构建多因素logistic回归模型时,以患者是否发生院内死亡为因变量,对纳入指标进行单因素筛查,将单因素筛查中有统计学意义的指标与临床指南中对预后有明确意义的指标纳入最终多因素logistic回归模型。结果显示,使用NE较使用DA降低院内死亡风险,差异具有统计学意义(OR=0.177,P=0.013);前壁心肌梗死增加院内死亡风险,差异具有统计学意义(OR=9.268,P=0.005);再血管化治疗降低院内死亡风险,差异具有统计学意义(OR=0.139,P=0.007)。STEMI增加院内死亡风险,但差异不具有统计学意义(OR=1.188,P=0.852),见表5。
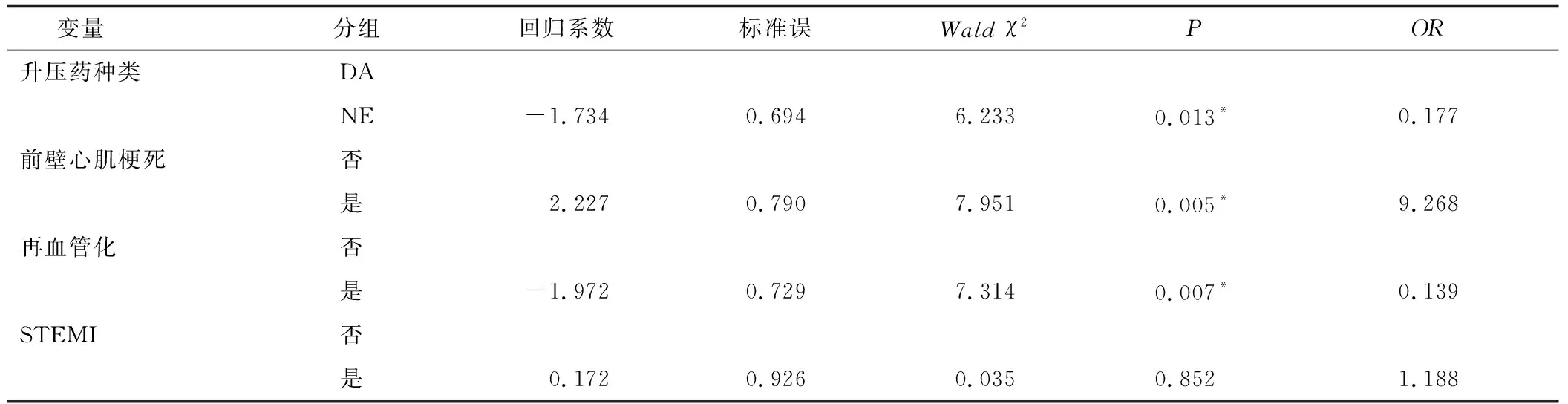
表5 院内死亡多因素logistic回归分析
3 讨论
NE与DA同属儿茶酚胺类药物,均为治疗休克的一线用药。过去认为,DA由于复杂的药理作用,可同时激动α受体、β受体,达到增强心肌收缩、外周血管收缩、保护肾功能及维持内脏供血等多种目的,因此一直是治疗休克的首选药物[12]。但后续研究[13]发现,使用DA与AMI合并CS患者28 d死亡率升高相关,且在使用DA过程中,消化道症状及心律失常发生风险也在增加。随着越来越多循证证据的积累,在治疗上,对各种原因引起的CS,各项指南在血管活性药的选择上均推荐首选NE[3-5]。但针对AMI后低血压状态又尚未出现外周循环衰竭的患者,应该首选何种血管活性药,并无明确建议。目前也鲜有针对该人群进行的NE及DA两种一线血管活性药头对头研究,本研究对成都市第三人民医院近9年AMI后低血压状态的患者进行回顾性分析,针对该类患者将NE和DA进行对比,总结分析其临床特征,为如何选择升压药提供更多数据支持。
本研究认为NE及DA均可有效提高并维持血压,二者间无明显差异。但在用药6 h后,NE组收缩压及舒张压均高于DA组。而舒张期是冠状动脉充盈的主要时相,舒张压升高有利于维持冠状动脉灌注,改善心肌缺血及降低支架内血栓风险。因此,NE在早期维持冠状动脉灌注较DA更有优势。本研究中两组患者心律失常发生率相当,与以往报道DA可增加心律失常发生率不符。分析可能与DA剂量依赖性相关,以往报道多使用大剂量DA[>10 μg/(kg·min)]维持血压,该浓度DA以激动α1受体效应占主要地位,血压升高的同时,心率加快,易引起心律失常;而本研究中DA均为中等剂量[5~10 μg/(kg·min)],因此并未诱发更多的心律失常。本研究DA组住院死亡率明显高于NE组。多因素logistic回归分析显示,前壁心肌梗死是该人群院内死亡的危险因素,而再血管化治疗、NE是保护因素。综上,在AMI后低血压状态时,应用NE及DA均可起到维持血压的作用,但在NE组患者中,住院期间死亡率较DA组低,可能是AMI后低血压状态患者更优的选择。
本研究的不足:该研究是回顾性研究,会存在一定的偏倚;且样本量相对较小,一定程度上影响统计效能。但是本研究纳入了成都市第三人民医院心内科近9年来全部AMI后低血压状态的患者,并以使用NE和DA为暴露因素分组进行队列研究,得出的结论具有一定的代表性,对该类患者临床用药选择有一定的参考价值。未来需要更大规模的前瞻性研究,并进行长期随访对研究结果加以验证。

