甘草甜素对病毒性脑炎小鼠神经元活性及血清NSE 水平的影响
黄国玲,陈宗文,田秀英,陈红兵
重庆大学附属三峡医院,重庆 404000
病毒性脑炎是一种较为常见的脑部感染疾病,多因急性病毒感染引起,多发于儿童时期。其症状多表现为体温升高、呕吐、头部剧烈疼痛等,严重者伴有一定意识障碍,发病时易引起癫痫发作,并伴有一定的神经元凋亡[1-2],需尽早发现并给予治疗,否则会造成死亡或不可逆后遗症。病毒性脑炎患者脑脊液中S-100B 蛋白和神经元特异性烯醇化酶(neuronspecific enolase,NSE)含量较正常人偏高,因此该值变化对病毒性脑炎的诊断有重要价值,两者常被用来作为评定脑损伤程度的指标[3-4]。甘草甜素是一种纯天然甜味剂,从甘草中提取,具有抗炎、抗氧化等作用,具有良好的临床应用潜力[5],其抗炎、抗病毒作用能有效改善脑部水肿及炎症反应,降低血液中的S-100B蛋白和NSE 含量,甘草甜素还具备抑制神经元凋亡的特性,从而改善神经元活性[6]。因此,本研究通过建立病毒性脑炎小鼠模型,探究甘草甜素对病毒性小鼠神经元活性及血清NSE水平的影响。
1 材料与方法
1.1 实验动物30只SD小鼠购自同济大学实验动物中心,实验动物合格证号:SCXK(沪)2019-0007。健康雄性小鼠,鼠龄8 周左右,体质量20 g 左右,室温24 ℃左右,自由采食摄水,在无压环境下30只小鼠适应1周新环境。
1.2 试验仪器甲酚紫(上海源叶公司,批号:S19196);S100B(上海酶联公司,批号:mlE1584);Bax、Caspase-3 抗体(上海恪敏科技公司,批号:ab5714、bs-0087R),ELISA试剂盒(上海羽哚公司,批号:YLY1150);E100 型光学显微镜(武汉爱斯佩科学仪器有限公司);TUNEL 试剂盒(北京裕恒丰公司,批号:8088)。
1.3 动物模型建立及分组实验动物随机分为生理盐水组、病毒性脑炎组和甘草甜素组。小鼠通过注射一定量的乙醚进行麻醉(进针点:右侧眼角和耳根连线中点),生理盐水组小鼠颅内注射生理盐水20 μL,病毒性脑炎组及甘草甜素组小鼠颅内注射4.5×108pfu的柯萨奇病毒B3悬液20 μL,建立病毒性脑炎小鼠模型。甘草甜素组每天灌胃50 mg/kg 甘草甜素,生理盐水组及病毒性脑炎组灌胃等剂量生理盐水。
1.4 观察指标
1.4.1 小鼠行为能力 灌胃第1、7、14、21 天后,进行Morris 水迷宫试验,让小鼠在平台中连续训练4 天,每组小鼠每天进行2 次训练,记录每组小鼠找到平台的时间。
1.4.2 神经元病理变化 甲酚紫(cresyl violet,CV)染色按常规焦油紫染色操作步骤进行CV 染色,光学显微镜下观察海马神经元病理学变化。
1.4.3 NSE 和S100B 检测 经枕骨大孔穿刺缓慢抽取各组小鼠脑脊液150 μL,加入少量生理盐水,制作各组脑脊液标本,按照试剂盒要求检测星形胶质源性蛋白(S100B)及NSE。
1.4.4 小鼠神经元凋亡情况 取小鼠海马组织石蜡切片,按照TUNEL 试剂盒说明书进行操作,显微镜下观察,凋亡细胞阳性着色为棕黄色,计算神经元凋亡比例。
1.4.5 神经元内Bax、Caspase-3蛋白表达检测 采用Western blotting 法,用裂解液裂解各组神经元,蛋白定量后行SDS-PAGE 凝胶电泳并转移蛋白至PVDF膜。Bax、Caspase-3一抗4 ℃过夜孵育后加入HPR标记的二抗,37 ℃孵育1 h,采用凝胶成像系统ECL发光成像,分析各组条带灰度值。
1.5 统计学方法采用SPSS 23.0 软件分析数据,计量资料以xˉ±s表示,采用方差分析,组间比较采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠行为能力3 组小鼠逃避潜伏期均随灌胃天数的增加而减少,病毒性脑炎组逃避潜伏期长于生理盐水组(P<0.05),甘草甜素组逃避潜伏期短于病毒性脑炎组(P<0.05),见表1。
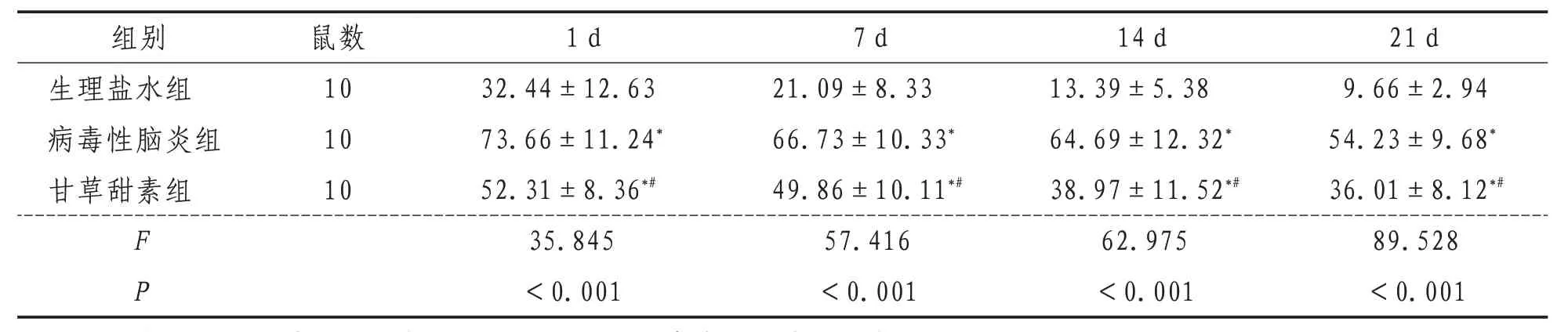
表1 小鼠逃避潜伏期 s
2.2 神经元病理变化生理盐水组小鼠海马组织呈均匀一致的紫蓝色,细胞密度大且排列规则,神经元形态结构完整,细胞质染色清晰,胞核淡染,未见明显神经元丢失;病毒性脑炎组小鼠海马组织神经元皱缩,体积缩小,胞体溶解,胞核固缩、深染,核溶解,细胞密度变小,排列散乱、无层次,神经元丢失,具有凋亡特征;甘草甜素组小鼠海马组织神经元损伤较病毒性脑炎组轻,细胞密度较大,排列较规则,形态较正常,核居中,核仁较清楚,可见斑点状神经元变性和坏死,见图1。
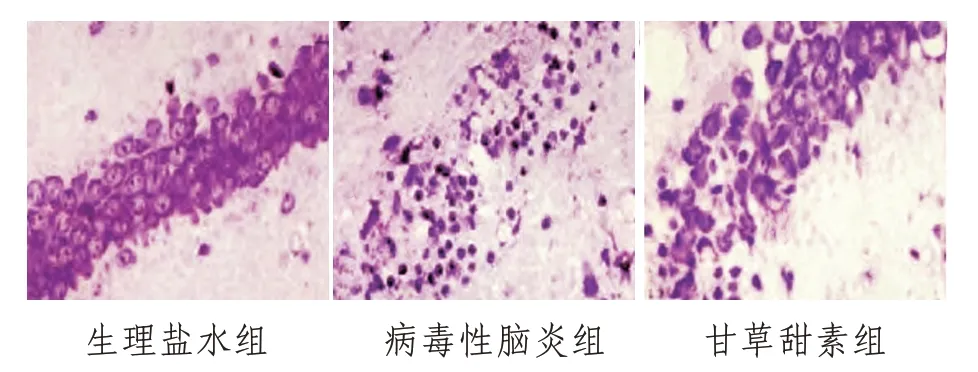
图1 各组小鼠神经元病理变化(CV,×200)
2.3 NSE 与S100B各组小鼠NSE 与S100B 均随灌胃天数的增加而降低,病毒性脑炎组NSE 高于生理盐水组(P<0.05);甘草甜素组低于病毒性脑炎组(P<0.05)。见表2—3。

表2 各组小鼠NSE变化

表3 各组小鼠S100B变化
2.4 大鼠神经元凋亡情况大脑皮层为细胞凋亡易发区,故本研究选取皮质进行细胞凋亡检测,与生理盐水组小鼠神经元凋亡率[(1.89±0.78)%]比较,病毒性脑炎组小鼠细胞凋亡率[(25.01±1.29)%]升高,甘草甜素组细胞凋亡率[(13.27±1.64)%]较病毒性脑炎组下降(P<0.05),见图2—3。
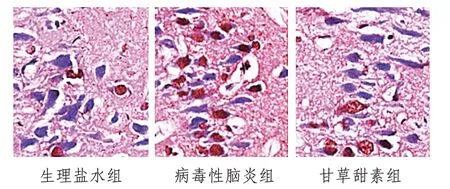
图2 各组小鼠神经元凋亡情况(TUNEL,×2400)
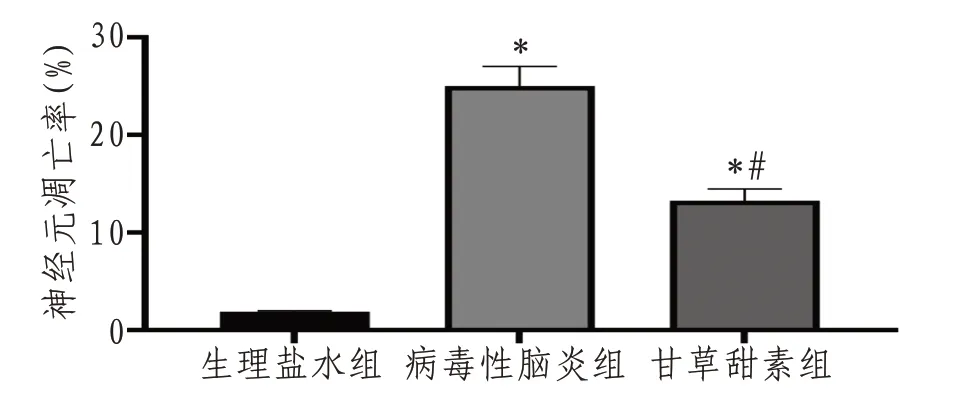
图3 各组小鼠神经元凋亡情况
2.5 神经元内Bax、Caspase-3蛋白表达生理盐水组神经元细胞内几乎无Bax、Caspase-3 蛋白表达,甘草甜素组Bax、Caspase-3 蛋白相对表达量低于病毒性脑炎组(P<0.05),见图4—5。

图4 各组小鼠BAX、caspase-3蛋白表达情况
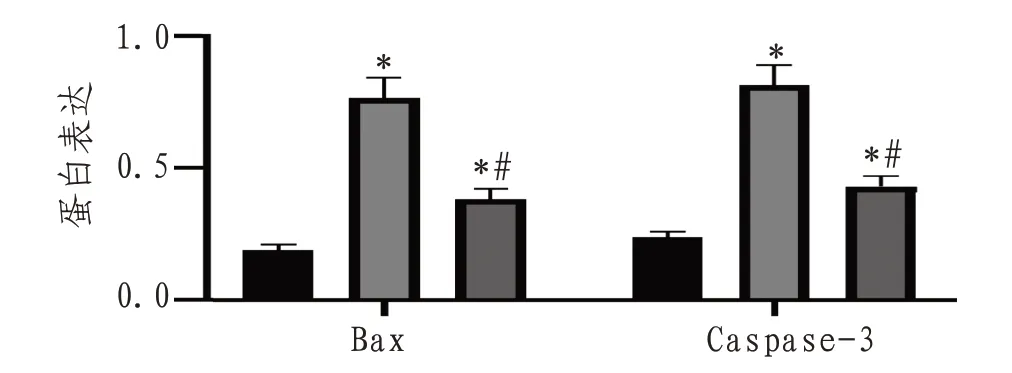
图5 各组小鼠Bax、Caspase蛋白比较
3 讨论
病毒性脑炎是一种常见的脑部疾病,一般由柯萨奇病毒所致,引起大脑血脑屏障异常,发生脑部水肿[7],儿童为主要发病人群,起病急性或亚急性,临床表现为恶心、全身无力等,病情较为严重者可能出现神经系统损伤[8-9]。控制脑水肿及颅内高压是相对有效的措施。NSE 是一种可溶性胞浆蛋白,主要分布于神经细胞及神经内分泌细胞的胞浆中[10]。脑损伤后,神经细胞胞膜受到破坏,NSE 从细胞内进入细胞间隙,最后进入血液循环,使患者血液中NSE 水平升高[11],升高幅度可作为脑损伤程度和范围的评判。本研究通过注射柯萨奇病毒建立病毒性脑炎小鼠模型,探讨甘草甜素对病毒性脑炎小鼠神经元活性及血清NSE 的影响[12-14]。
NSE 是糖酵解过程中的催化水解酶,是一种可溶性胞浆蛋白质,主要存在于神经元、神经纤维和神经内分泌细胞中,与神经元的分化、成熟有关。脑损伤时神经细胞受伤,其胞膜受到破坏,引发变性和崩解,对脑部产生伤害,神经元受到损伤,随后NSE 被释放入脑脊液和血液中进入血液循环,病毒性脑炎时患者血液中NSE 升高[15],导致神经元细胞发生炎症、水肿、坏死。患者血液中NSE 水平越高,则疾病严重程度越高,因此NSE 值通常作为评定病毒性脑炎引起脑部损伤的重要依据。本研究表明,甘草甜素能够降低小鼠血液中NSE 值,其作用机制可能是因为甘草甜素水解产生的甘草次酸,可通过血脑屏障改善脑部水肿状况,减轻炎症反应,进而降低血液中NSE 值。甘草甜素对于因脑损伤导致的学习记忆能力衰退也有一定疗效,本研究表明病毒性脑炎组小鼠逃避潜伏期长于生理盐水组,甘草甜素组短于病毒性脑炎组。说明甘草甜素可改善病毒性脑炎大鼠NSE值及小鼠学习能力。甘草甜素,别名甘草酸,可分解出葡萄糖醛酸和甘草次酸,甘草酸须通过甘草次酸及葡萄糖醛酸发挥作用,分为GL、GA 两种吸收形式,甘草甜素具有一定抗病毒作用[14]。本研究表明,病毒性脑炎组小鼠神经元细胞凋亡率高于生理盐水组,而甘草甜素组低于病毒性脑炎组,说明甘草甜素对神经元细胞凋亡有一定抑制作用;有研究[16]表明,甘草甜素还具有一定免疫调节作用,其核心成分为苷元,能消除巨噬细胞活性,诱导淋巴细胞分泌淋巴因子,导致疾病进展。甘草甜素极性大,很难进入脑组织发挥作用,而其水解产生的甘草次酸可通过血脑屏障(星型细胞等组织)进入其中发挥药效。甘草甜素对脑损伤有作用,能改善脑损伤小鼠学习记忆能力,对脑组织的保护作用机制主要表现为抗炎、抗氧化、抑制细胞凋亡等方面。
本研究表明,病毒性脑炎组S100B 高于生理盐水组,甘草甜素组低于病毒性脑炎组,其作用机制多为炎症损害中枢神经系统,神经胶质反应性增生,重建这种自身稳定,在大、小胶质细胞增生的同时伴有S100B蛋白浓度改变;S100B蛋白分子量为21KD,是S100 蛋白家族中的一员,主要由胶质细胞合成和分泌,广泛分布于哺乳动物神经细胞内,影响神经系统的生长发育,正常条件下不能通过血脑屏障,半衰期2 h,经肾脏清除,由神经胶质细胞合成和分泌,在脑损伤时通过急性胶质细胞反应增加其合成和分泌,参与损伤修复[17-18]。脑脊液S100B 蛋白浓度改变与病情相关,低浓度S100B 具有神经营养作用,高浓度伴随一定的神经毒性作用,并可参与神经细胞凋亡作用。神经胶质细胞坏死后S100B 蛋白释放和血脑屏障受破坏后通透性增高。有研究[19]表明,S100B 蛋白不仅反映神经细胞损伤,还是脑组织损害后一种追踪生化标记物,对于疾病的诊断、病情变化监测及疗效的判定都具有重要意义。
本研究发现生理盐水组几乎无Bax、Caspase-3蛋白表达,甘草甜素组Bax、Caspase-3 蛋白表达低于病毒性脑炎组。细胞凋亡又称细胞程序化死亡,多种疾病均有可能导致细胞凋亡,由多种基因调控,常表现为生理性死亡。细胞发生凋亡有多种凋亡途径,多数由Caspase 的活化启动。Caspase-3 效应蛋白酶在凋亡过程中起关键作用,同时也是凋亡发生的标志[20]。Bax 为凋亡诱导蛋白,对凋亡有一定积极作用。当Bax以二聚体形式存在时,细胞色素C释放,激活Caspase-9,进而激活Caspase-3,促进细胞凋亡。甘草甜素能下调Caspase-3 表达,其原因是甘草甜素能降低GSK3β活性,活化的GSK3β作用于Caspase-3 分子,调控凋亡过程。这与本研究结果一致,因此甘草甜素可有效抑制细胞凋亡[20]。
综上所述,甘草甜素对病毒性脑炎小鼠行为能力及神经元活性改善有一定积极作用,其作用机制可能与调控NSE、S100B、Bax及Caspase-3水平有关。

