钕铁硼二次废料溶析结晶法制备硫酸亚铁
张灿文, 刘艳红, 熊道陵, 欧阳少波, 文明福, 卢雄雄, 阳金娟, 李檬
(江西理工大学材料冶金化学学部,江西 赣州 341000)
钕铁硼磁性材料是第三代磁性材料[1],也是目前世界上磁性最强的磁体,由于其具有高剩磁、高磁能积、高矫顽力,以及成本较低的优点,使其在多个领域得到了广泛应用[2],尤其是“十四五”规划以来,国家对新能源产业的扶持力度不断增加[3-4],使得钕铁硼磁性材料在该领域发展尤为迅速。伴随而来,会产生大量的钕铁硼废料,在生产过程中约产生有30%的废料(一次废料);一次废料中含有大量的稀土元素,在进行回收处理后,形成二次废料;二次废料中稀土含量较低,主要成分是铁元素。
目前,我国对于钕铁硼废料中铁元素的回收方法主要有全萃取法、盐酸优溶法、尿素共沉淀法和直接还原-渣金熔分法等[5-11],以上回收方法虽获得了纯度较高的铁元素产品以及具有高价值的稀土氧化物,但涉及到萃取、共沉淀和高温熔融等操作,操作过程复杂且能耗较高。为高效回收二次废料中的铁元素,设想以硫酸亚铁形式进行回收,通过对比各种结晶方式,最终选用溶析结晶法回收硫酸亚铁。
溶析结晶法是物质分离和提纯的一种常用方法[12],在医药、化工等行业广泛应用[13-15]。王和庆等[16]选用乙醇(EtOH)为溶析剂脱除钛白废酸中的硫酸亚铁,在适宜条件下,七水硫酸亚铁的脱除率可达87%~91%。吕正敏等[17]针对卡前列甲酯纯度较低、回收率不高的问题,采用异丙醚-正己烷为溶剂,对卡前列甲酯进行溶析结晶提纯,获得的产品纯度较高,且收率高。付海阔等[18]采用溶析结晶制备硫酸钴,在适宜条件下,一次结晶率达98.27%,且该法比蒸发结晶法制备的硫酸钴在含水不溶物、油分等方面优势明显。郑雯佳等[19]以溶析结晶制备磷酸二氢钾,在温度303.15 K、V(C2H6O)/V(H2O)为1.4时,结晶物回收率最高可达97%。综上可知,溶析结晶具有操作温度低、能耗低、工艺简单、高回收率、对产品提纯效果明显等优点。目前,利用溶析结晶法回收二次废渣铁元素的相关文献报道较少。因此,本研究在回收二次废渣铁元素的过程中,将Fe3+还原为Fe2+后,采用溶析结晶的方法,将废渣中的铁元素以硫酸亚铁的形式进行回收。
利用溶析结晶法,解决目前废料中铁元素回收过程的操作复杂和高能耗等问题,本文以硫酸亚铁溶液模拟二次废渣浸出液后的还原液,选用乙醇为溶析剂,考察了乙醇用量、硫酸亚铁初始浓度、溶析温度、搅拌速度、乙醇加入方式、晶种投放方式和熟化时间等因素对硫酸亚铁的结晶率的影响,并利用ICP-AES、XRD、TGA等分析技术对二次废料还原液回收的硫酸亚铁进行检测。
1 实验部分
1.1 实验材料与试剂
实验所用的原料为赣州某稀土回收公司的钕铁硼二次废料。主要试剂为硫酸亚铁、硫酸、盐酸、磷酸、乙醇等,均为分析纯,购于西陇科学股份有限公司。
1.2 实验仪器及设备
实验仪器和器材主要有AUY 220型电子天平、HWS-28型恒温水浴锅、IRISIntrepid Ⅱ型电感耦合原子发射光谱仪(ICP-AES)、TG 60型X射线衍射仪(XRD)、TG 60型热重分析仪(TGA)、MLA型扫描电镜(SEM)等。
1.3 实验原理及溶析剂的选择
溶析结晶的核心点是通过加入某种物质改变溶质在溶液体系中的溶解度,使其低于溶质在原溶剂中的溶解度,尽可能多地从溶液中析出溶质[20-21]。这种物质的存在状态可以是固体、液体或气体,但必须满足:①加入的物质与原溶剂能互溶;②溶质在这种物质中的溶解能力很弱;③加入的这种物质易与原溶剂分离,生产上利于套用或回收,从而降低能耗和成本。
溶析剂的选择应该遵循以下规则:①溶析剂与原溶剂之间是否能以任意比例互溶;②溶质在溶析剂中的溶解能力应该尽可能低;③溶析剂与原溶剂互溶后对溶质产生的溶解度有较大变化,远低于溶质在原溶剂中的溶解度,能很好提高溶质的回收率;④溶析剂与原溶剂能很好地分离,且易操作;⑤从环保安全及操作环境考虑,应该选择低毒物质作溶析剂。综合上述因素,分析了甲醇、乙醇、丙酮、异丙醇等常用溶剂的物化特性,确定选择乙醇为溶析剂。
1.4 溶解度测定
溶解度的测定一般有两种方法:平衡法和动态法[22-26]。平衡法对于溶质溶解速度快慢无要求,设备简单,操作方便,但使用溶质质量大,测定时间长;动态法测定时间短,但溶解平衡不易确定。根据实验室现有条件,本实验采用平衡法进行溶解度的测定。
平衡法测定时间较长,加上硫酸亚铁热稳定性差,导致结果误差较大。故本实验采用滴定分析法,即在设定温度下,通过测定饱和溶液中硫酸亚铁的含量来计算某温度下硫酸亚铁的溶解度,该方法具有准确性高,精密度好,操作简单及快速等优点。具体测定步骤如下:①量取一定体积的已知体积比例的乙醇-水溶液于结晶器中,在恒温槽中保温30 min;②称取一定质量的硫酸亚铁置于盛有乙醇-水溶液的结晶器中,开启搅拌装置,观察结晶器中硫酸亚铁的溶解状况,直到溶液不再溶解硫酸亚铁且有微量晶体析出,此时溶液已达到固液平衡,溶液为饱和溶液,此过程约需120 min;③将达到固液平衡的硫酸亚铁溶液停止搅拌,恒温静置15 min,过滤;④准确记录过滤溶液体积,测定滤液中硫酸亚铁的含量,计算该温度下硫酸亚铁的溶解度。
1.5 溶析结晶实验
溶析结晶实验装置如图1所示。装置由搅拌控制台、搅拌器、温度计、滴定漏斗、结晶器、恒温槽组成。实验温度由恒温槽实现控温。

图1 溶析结晶装置Fig.1 Diagram of dissolution crystallization device
实验操作步骤为:用量筒量取一定体积的酸浸还原液于结晶器中,保温15 min,用温度计测量溶液温度,达到设定值后,开启搅拌装置。乙醇以连续滴定的方式加入,滴加完毕后继续搅拌到规定时间,然后陈化60 min,过滤。准确计量滤液体积,测定滤液中Fe2+浓度,从而计算出硫酸亚铁的溶解度。
硫酸亚铁的结晶率(R)按式(1)计算:
式(1)中:C1为硫酸亚铁结晶母液中Fe2+的质量浓度数值,单位g/L;V1为硫酸亚铁母液的体积数值,单位mL;C0为初始硫酸亚铁溶液中Fe2+的质量浓度数值,单位g/L;V0为初始硫酸亚铁溶液体积数值,单位mL。
2 结果与讨论
2.1 分离可行性研究
2.1.1 溶解固液平衡时间的确定
通过考察不同时间下硫酸亚铁分别在纯水和1∶1乙醇-水溶液(V(乙醇)/V(水),下同)体系中的溶解过程,溶液中硫酸亚铁含量的变化规律,即可确定固液平衡所需时间,结果如图2所示。

图2 硫酸亚铁在纯水、1∶1乙醇水溶液中的溶解度随时间变化Fig.2 Solubility of ferrous sulfate in pure water and 1∶1 ethanol solution changing with time
由图2可知硫酸亚铁在纯水、乙醇-水溶液中的溶解度随时间增加而增大。在纯水中,硫酸亚铁溶解度在120 min后基本不变,达到最大值620.0 g/L;在乙醇水溶液中,硫酸亚铁溶解度在60 min后趋于平稳,基本达到固液平衡,60 min时溶解度为12.3 g/L。从两者数据可以看出,硫酸亚铁在纯水和乙醇-水溶液中溶解度相差巨大,这与文献[27]描述的相符合,在添加溶析剂后,溶质溶解度会大幅降低。
2.1.2 温度对硫酸亚铁在不同体系中溶解度的影响
由于七水硫酸亚铁在330.15 K以上会逐渐失去结晶水而生成一水硫酸亚铁[28],使溶液提前饱和,导致结果不准,同时根据需求,溶析结晶需在低温或常温下进行,故设置上限温度为320.15 K;通过文献[29-31]研究的不同比例乙醇-水溶液条件下硫酸亚铁的回收率可知,乙醇与水的体积比为1∶1时的结晶速率最快,故本实验选取乙醇与水体积比为1∶1进行测定,测定结果如图3所示。

图3 硫酸亚铁在纯水、1∶1乙醇-水溶液中溶解度随温度的变化Fig.3 Solubility of ferrous sulfate in pure water and 1∶1 ethanol solution as a function of temperature
由图3可知,硫酸亚铁溶解度随温度增加而上升,且受温度影响比较大,这也是硫酸亚铁常采用冷却结晶的重要原因[32]。通过数据对比,各个温度下硫酸亚铁在乙醇-水溶液中的溶解度远低于在纯水中的溶解度,在283.15 K,硫酸亚铁在1:1乙醇-水溶液中的溶解度接近于0。这也符合溶析结晶操作温度低、添加溶析剂会大幅降低溶质溶解度的结果[33]。
2.1.3 溶解度测定数据拟合
为进一步验证方法的可行性,本文对测定数据进行了拟合关联。由固液平衡热力学原理可知,溶解度(x)与温度(T)之间的函数关系式如下所示:
假设在一定的温度范围内,γ和ΔmH是定值,则式(2)可改写为:
此方程为溶解度经验方程,又称Apelblat方程[34-37],式(2)、式(3)中:γ为物质的活度系数;ΔmH为物质的熔化热,kJ/mol;T为热力学温度,K;Tm物质的熔化点温度,K;x为物质的溶解度,g/L;A、B为常数;R为摩尔气体常数,8.314 J/(mol·K)。
由硫酸亚铁在纯水和乙醇-水溶液(乙醇与水体积比1∶1)中的溶解度数据(见图3)即可计算出lnx、1/T值,结果见表1。

表1 硫酸亚铁在纯水和1∶1乙醇-水溶液中溶解度的对数值与热力学温度的倒数值Table 1 Logarithmic value of solubility of ferrous sulfate in pure water and 1∶1 ethanol-water solution and the reciprocal value of thermodynamic temperature
将所得数据以lnx为纵坐标,1/T为横坐标作图,如图4所示。

图4 溶解度对数lnx与热力学温度T的函数关系Fig.4 Relationship between solubility logarithm lnx and thermodynamic temperature T function
由图4可得硫酸亚铁在纯水中的溶解度方程为:
线性相关系数:R2=0.995 1
硫酸亚铁在1∶1乙醇-水溶液中的溶解度方程为:
线性相关系数:R2=0.998 5
按照硫酸亚铁在纯水和1∶1乙醇-水溶液中拟合所得溶解度方程计算得到的溶解度与实测溶解度数据见表2和表3,表中xcal为计算值,xexp为实验值,E为相对误差:
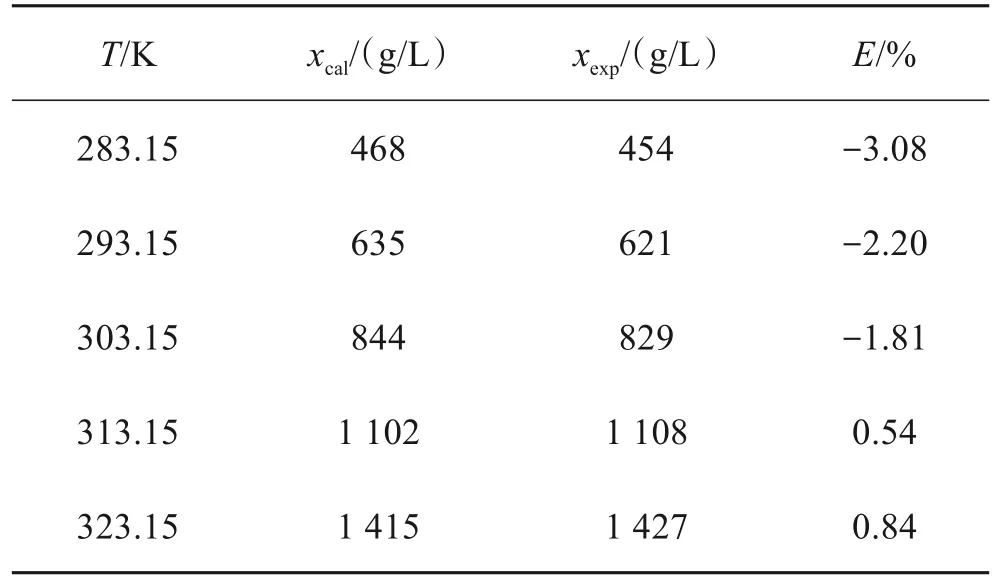
表2 硫酸亚铁在纯水中的溶解度计算结果与实测结果比较Table 2 Comparison between calculated results and measured results of solubility of ferrous sulfate in pure water
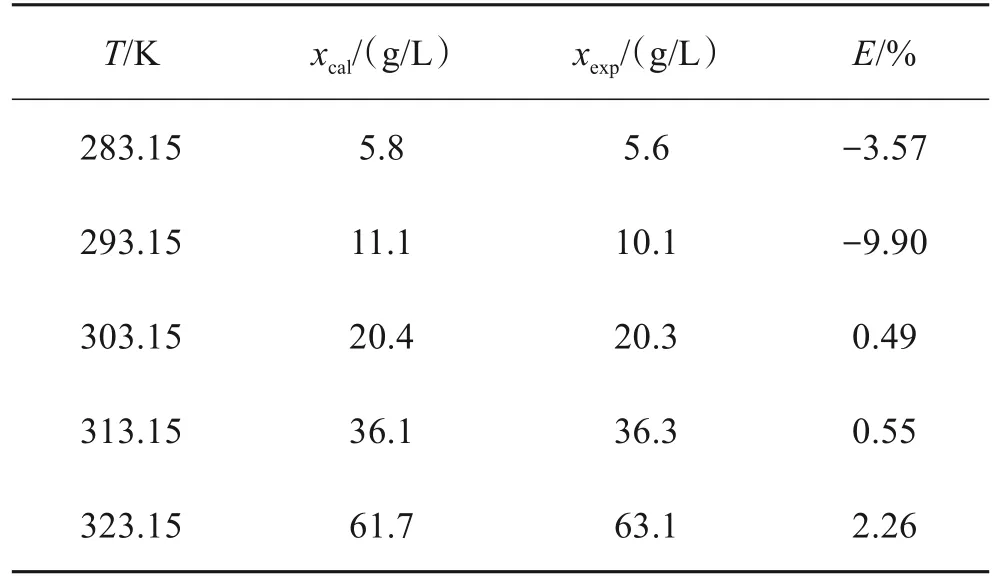
表3 硫酸亚铁在1∶1乙醇溶液中的溶解度计算值与实验值比较Table 3 Comparison betweer calculated results and measured results of solubility of ferrous sulfate in 1∶1 ethanol water solution
由表2和表3数据可以看出,在283.15 ~323.15 K温度范围内,实验数据与Apelblat模型关联度好,说明Apelblat模型能够很好地描述硫酸亚铁的溶解度。两表中的数据,回归相关系数R2均大于0.99,除了硫酸亚铁在1∶1乙醇-水溶液中的溶解度在T=293.15K处偏离系统外,其他的系统误差均小于5%。
2.2 操作条件对析出效果的影响
2.2.1 乙醇用量对结晶率的影响
溶析结晶涉及溶剂的回收和循环利用,其添加量对结晶效率和溶剂回收产生的能耗都有较大影响。固定硫酸亚铁初始浓度为200 g/L,温度为室温(293.15 K),其他因素不变的条件下,乙醇用量对硫酸亚铁结晶效果如图5所示。

图5 乙醇用量对结晶率的影响Fig.5 Effects of ethanol dosage on crystallization rate
由图5可知,当乙醇比例由0.2提高到1时,硫酸亚铁结晶率增幅较大,Fe2+在母液中的浓度降低很快。乙醇与水的体积比为1∶1时,结晶率为95.94%,且再增加乙醇用量,结晶率提升不大。这主要是因为随着乙醇不断地增加,Fe2+与SO42-离子溶剂减少,溶解能力降低,结晶率得到提高,但溶析剂作用有限,另外乙醇易挥发,使得溶液快速冷却结晶[38]。
2.2.2 硫酸亚铁初始浓度对结晶率的影响
在乙醇与酸浸还原液体积比为1∶1,温度为293.15 K,其他条件不变,考察了硫酸亚铁初始浓度(25、50、100、150、200、250 g/L)对结晶率的影响。实验结果如图6所示。
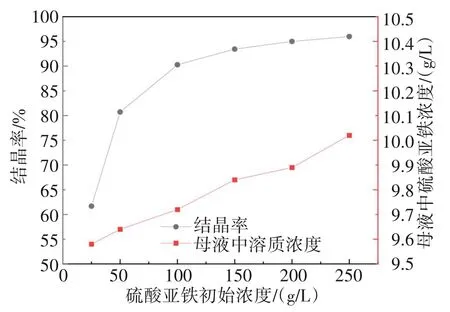
图6 硫酸亚铁初始浓度对结晶率影响Fig.6 Effects of initial concentration of ferrous sulfate on crystallization rate
由图6可知,随着溶液中硫酸亚铁初始浓度的增加,硫酸亚铁结晶率增大,当硫酸亚铁初始浓度为200 g/L时,结晶率达到95.06%,母液中硫酸亚铁浓度为9.89 g/L;硫酸亚铁初始浓度增至250 g/L,结晶率增幅并不十分明显,仅增加0.93%。考虑到酸浸液浓缩能耗问题,只需将酸浸液浓缩至150~200 g/L即可。
2.2.3 温度对结晶率的影响
固定硫酸亚铁初始浓度为200 g/L,乙醇与硫酸亚铁溶液体积比为1∶1,其他条件不变的情况下,考察温度(283.15、293.15、303.15、313.15、323.15 K)对结晶率的影响。实验结果如图7所示。
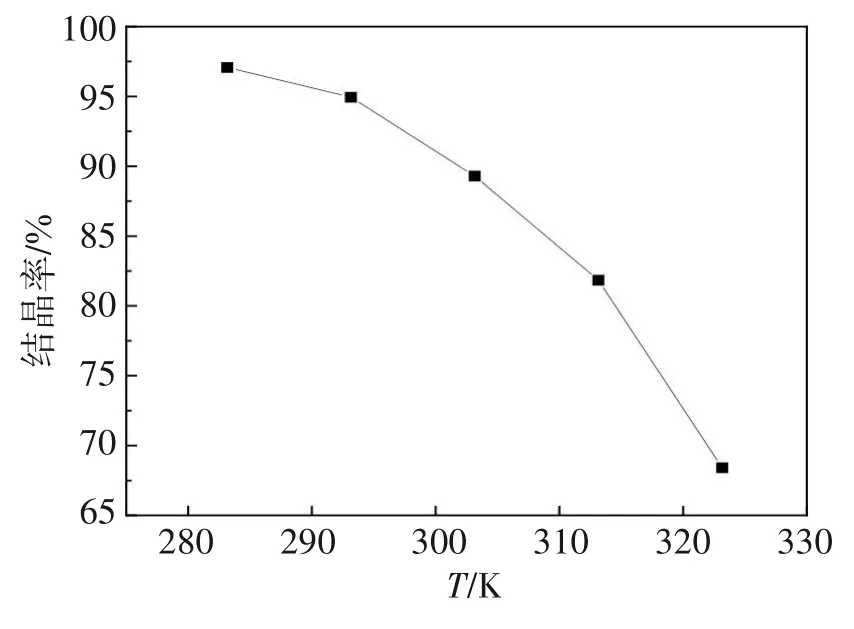
图7 温度对结晶率影响Fig.7 Effects of temperature on crystallization rate
由图7可见,硫酸亚铁结晶率随着温度T的升高而降低,硫酸亚铁在温度为283.15、293.15、303.15、313.15、323.15 K对应的结晶率为97.08%、94.95%、89.30%、81.85%、68.42%,这与溶析结晶通常在常温或低温条件下进行[33]是一致的,为了获得更高产率,选取温度283.15 K为较优溶析结晶温度。
2.2.4 搅拌速度、乙醇加入方式、晶种投放和陈化时间对结晶率的影响
为进一步提高分离效果,考察搅拌速度、乙醇加入方式、晶种投放和陈化时间等操作条件对硫酸亚铁结晶率的影响,实验在酸浸还原液初始硫酸亚铁浓度为200 g/L、温度为283.15 K、乙醇与溶液体积比1∶1的条件下进行,实验结果如图8—图10所示。
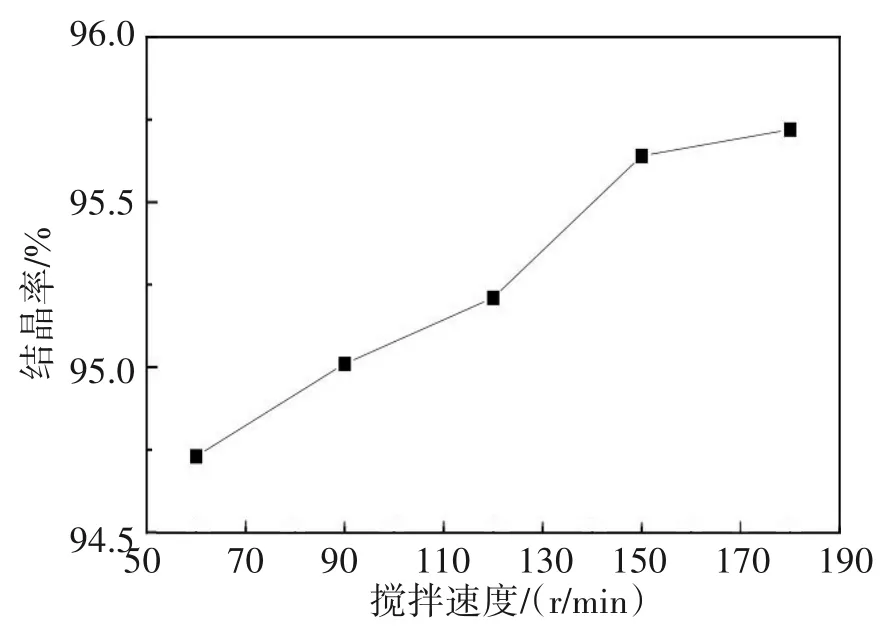
图8 搅拌速度对硫酸亚铁结晶率的影响Fig.8 Effects of stirring speed on crystallization rate of ferrous sulfate
由图8可知,加快搅拌速度,硫酸亚铁的结晶率增加,转速达到150 r/min时,结晶率达95.64%,继续增加到180 r/min,结晶率增幅甚微。这是因为搅拌速度的加快有助于物料充分混匀,避免瞬间局部过饱,否则会导致自发成核,影响晶体粒度分布,微晶不易截留,结晶率会下降[39-40]。
连续滴加实验结果如图9所示,连续滴加得到的结晶率比一次性加入好,但影响并不大。考虑到一次性加入可能会导致瞬间过饱和,进而出现自发成核现象[41],实际生产过程中最好采用连续加料方式,实验滴加速度为10 mL/min。

图9 滴加方式对硫酸亚铁结晶率的影响Fig.9 Influence of dropping method on crystallization rate of ferrous sulfate
溶析结晶完全后,结晶产物与母液通常要放置一段时间,这个过程称为“陈化”,也叫熟化。一方面是去除晶体沉淀中包藏的杂质,与此同时,小颗粒晶体会溶解,晶粒之间会进行重组进而改善晶体形状,从而改善物质结晶粒度分布,有利于促进结晶率的提高[42]。图10结果表明:乙醇加入完毕后,陈化时间约为60 min。

图10 熟化时间对硫酸亚铁结晶率的影响Fig.10 Effect of ageing time on crystallization rate of ferrous sulfate
2.3 优化实验
综上所述,溶析结晶硫酸亚铁的较优条件为:乙醇与硫酸亚铁溶液体积比为1∶1,硫酸亚铁初始浓度200 g/L,温度283.15 K,添加约溶质质量1%的晶种,连续加入乙醇速度10 mL/min,搅拌速度150 r/min,陈化时间60 min。依此条件进行平行实验,硫酸亚铁结晶率均值为95.28%,结晶较好。
3 产品表征与分析
3.1 ICP-AES的结果分析
综合上述实验结果,在较优条件下,采用溶析结晶法对真实二次废料还原液进行铁元素的回收,将从还原液中回收获得的硫酸亚铁产品,采用高锰酸钾滴定法进行纯度检测,采用ICP-AES测定杂质种类及含量[43],其结果与化学纯标准对比见表4。

表4 硫酸亚铁产品质量检测结果Table 4 Quality test results of ferrous sulfate products 单位:%(质量分数)
由表4可以看出,采用溶析结晶从还原液中回收获得的硫酸亚铁产品,其水不溶物、氯化物等物质含量均低于GB/T664-2011七水硫酸亚铁的国家标准。
3.2 XRD表征结果分析
在较优条件下,将从还原液中回收获得的硫酸亚铁进行XRD分析,结果见图11。
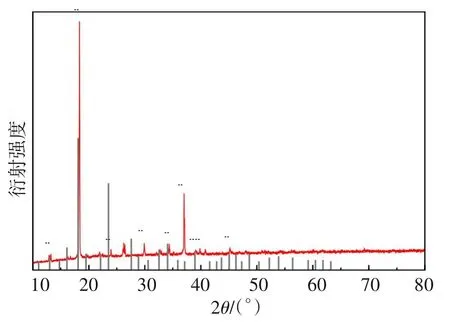
图11 硫酸亚铁的XRD分析图示Fig.11 XRD analysis of ferrous sulfate
由图11所示,产品的衍射峰与标准卡片ICDD No.00-001-0255对照,在对应的2θ分别为13.009°、18.089°、23.517°、30.591°、34.062°、38.958°、41.584°、45.068°出现衍射峰,对应七水硫酸亚铁的(200)、(111)、(-311)、(-221)、(-413)、(-422)、(-612)、(032)晶面。从图11中可以看出衍射峰强度大,说明产品结晶较好,几乎无杂峰出现,表明产品纯度高。
3.3 TGA热重分析
在温度T为293.15~1 073.15 K,氮气气氛,升温速率为10 K/min条件下,将从还原液中回收获得的硫酸亚铁产品进行热重分析,结果见图12。

图12 硫酸亚铁TGA 热重分析Fig.12 TGA thermogravimetric analysis plot of ferrous sulfate
分析结果显示,FeSO4·7H2O从296.60 K左右开始分解,到1 053.15 K结束热解,分解过程可分为4步:第1步,从296.60 K到340.15 K左右,失去率为15.77%,约失去3个结晶水(理论值19.29%),中间产物以FeSO4·4H2O为主;第2步,从340.15 K到386.15 K,失去约6个结晶水,总失重36.28%(理论值32.14%),中间产物以FeSO4·H2O为主;第3步,从386.15 K到549.15 K,失去最后1个结晶水,总失重44.08%(理论值45.00%),产物为FeSO4;第4步以549.15 K到1 053.15 K总失重达72.55%,主要是无水FeSO4分解为SO2、SO3的结果。整个热解过程的主要方程式为:
3.4 SEM分析
在较优条件下,将从还原液中回收获得的硫酸亚铁进行SEM分析,结果见图13。

图13 硫酸亚铁表面形态Fig.13 Ferrous sulfate surface morphology
由图13可以看出,采用溶析结晶从还原液中回收的硫酸亚铁晶体表面光滑,无任何杂质附着,与ICP-AES结果相对应,硫酸亚铁纯度高,杂质含量低。
4 结 论
1)通过测定硫酸亚铁在纯水和乙醇-水溶液中的溶解度以及采用Apelblat方程进行数据拟合,确定了溶析结晶法提纯硫酸亚铁实验的可行性。
2)最佳工艺条件:乙醇与硫酸亚铁溶液体积比为1∶1,初始硫酸亚铁浓度200 g/L,温度283.15 K,添加约溶质质量1%的晶种,连续加入乙醇速度10 mL/min,搅拌速度150 r/min,陈化时间60 min。在此条件下,硫酸亚铁结晶率达95.28%。
3)通过ICP-AES分析,采用溶析结晶从真实二次废料中回收所得的产品中杂质含量较低,其中杂质含量均低于国家标准GB/T664-2011。通过XRD分析,回收获得的产品衍射峰与标准卡片ICDD No.00-001-0255对比可知产品结晶较好,无杂峰,产品纯度高。TGA分析结果表明,产品的热解过程均符合理论值。SEM分析结果表明产品表面光滑,无杂质附着,与ICP-AES结果相一致。
4)采用溶析结晶法制备提纯硫酸亚铁,产品的结晶率和纯度都有着巨大优势,且操作简单,所需温度低,本方法经济效益高且环保。同时,各项表征结果也说明,本方法在实际操作中也是可行的。

