阳极泥中铜的常压氧化预脱除及动力学分析
张金凤, 崔雅茹*, 何喜红, 李林波, 张飞宇, 吕超飞, 周宇飞
(1.西安建筑科技大学冶金工程学院, 西安 710000; 2.国投金城冶金有限责任公司,河南 三门峡 472000)
近年来,国内很多黄金冶炼企业均采用铜氧气底吹/侧吹熔炼—连续吹炼—火法精炼三连炉系统处理含砷、锑高的难选、难处理金/铜混合精矿[1-3]。熔炼过程中,金银等贵金属被铜锍、粗铜所捕集,并在电解精炼环节富集到阳极泥中。采用的原料、生产工艺及电解参数不同,铜阳极泥的成分和物相组成也有所差别,通常均含有Cu、Ni、As、Sb、Bi、Pb、Se、Te、Au、Ag和铂族金属等,是稀贵金属提取的重要原料[4-8]。冶炼企业通常根据原料成分特点选择适宜的火法、湿法或者联合工艺路线,对其中的金、银等贵金属及硒、碲等稀散金属进行分级综合回收[9-13]。其处理工艺一般包括如下步骤[14]:①预处理工艺,综合分离回收Cu、Se、Te、As、Sb、Ni等金属元素;②火法熔炼或湿法浸出Au、Ag等贵金属;③电解精炼或还原提纯产出合格产品。相对而言,预处理工艺的目的主要是尽可能脱除Cu、Ni、As、Sb、Bi等金属,以减轻对后续工序的压力,实现贵金属富集[15]。研究人员对预处理方法做了大量的研究[16-21],其中火法焙烧如硫酸化焙烧、氧化焙烧、苏打焙烧等能耗高,烟尘量大,环境污染严重;而加压氧化浸出对设备要求高且操作复杂,且不便于在中小型冶炼厂应用。因此,相较而言,常压氧化酸浸安全性高、设备成本压力都小,较适合作为阳极泥预处理的手段。由于阳极泥中含有CuxSy[22],为提高铜的浸出效率,需要在浸出时添加适宜的氧化剂。常见的氧化剂中HNO3严重设备腐蚀,且可能会产生氮氧化合物[23],H2O2在温度较高时容易分解,实际消耗大,影响浸出效率[24];相较其他氧化剂,MnO2不仅会将铜的硫化物高效氧化为硫酸盐,且不会释放Cl2、SO2、NOx等有害气体,被认为是一种绿色浸出剂[25]。国内某冶炼厂对高砷高锑铜混合精矿采用火法造锍捕金工艺进行处理,精矿经氧气底吹熔炼—底吹吹炼—回转式阳极精炼—电解精炼,产出电铜和阳极泥。本研究以阳极泥为研究对象,选择MnO2为氧化剂,采用直接常压氧化酸浸工艺对阳极泥进行预脱铜处理,探讨预脱铜的相关工艺参数对脱铜效率及贵金属收得率的影响,为生产过程提供参考。
1 实验部分
1.1 实验原料与试剂
实验原料为某冶炼厂电解车间产出的铜阳极泥,采用化学滴定法、火试金法和ICP-AES分析法对元素组成进行分析,成分见表1。其中主要含Cu、Pb、Sb、Ag,As、Se,有价金属含量丰富。实验所用试剂H2SO4、MnO2均为分析纯,并用去离子水配制所需溶液。

表1 铜阳极泥的元素组成Table 1 Elemental composition of copper anode slime 单位:%(质量分数)
1.2 实验设备与分析仪器
实验中使用自制的浸出装置,采用北京市永光明医疗仪器产XMTD-7000电热恒温水浴锅,配置HW30顶置式搅拌器和SHB-B95循环水式多用真空泵。实验中使用的ICP-AES痕量成分分析设备为HK-8100型电感耦合等离子体光谱仪(波长180~500 nm,在180~500 nm整个波段内分辨率低于0.008 nm,相对标准偏差RSD≤0.5%);采用MIRA LMS型场发射扫描电子显微镜(TESCAN, 捷克,200 V~ 30 kV,二次电子图像分辨率:1.0 nm@30 kV)及EDS表征阳极泥形貌及微区成分;样品物相分析采用XRD-6000型X线衍射仪 ( 日本岛津公司,设定电压45 kV、电流40 mA、扫描速度为5 (°)/min )。
1.3 实验步骤
铜阳极泥的预处理脱铜实验在500 mL的烧杯中进行。首先按实验要求配制一定体积和浓度的酸性溶液于烧杯中,然后按照配比加入一定量MnO2,再将烧杯放入设定好温度的水浴锅中加热,待温度升至实验要求数值时加入50 g阳极泥,开启磁力搅拌器调节至指定转速进行浸出实验。实验结束后,通过真空抽滤设备使液固分离、洗涤,干燥,分析渣中铜、砷、硒含量并计算其浸出率。
1.4 实验表征结果及浸出原理分析
1.4.1 原料物相及形貌表征结果
采用XRD仪器对阳极泥的物相赋存状态进行了分析,其衍射图谱如图1所示。
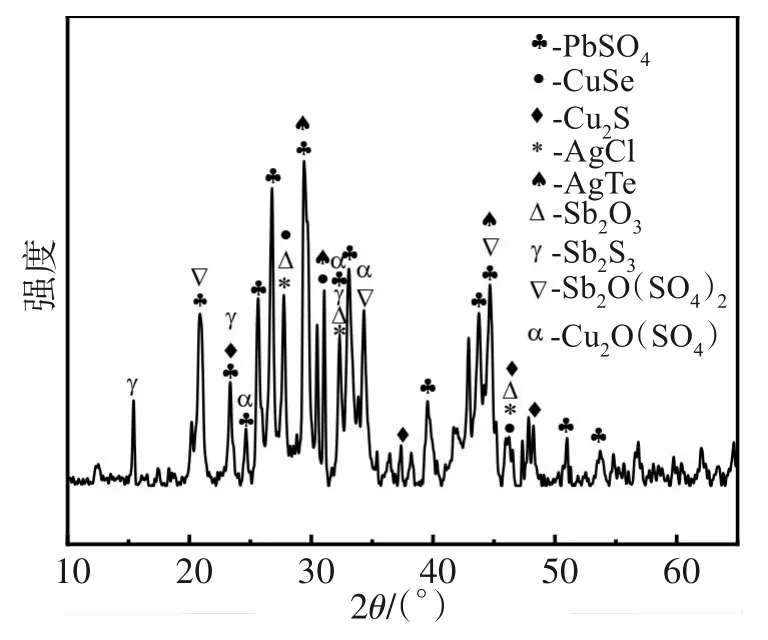
图1 铜阳极泥的XRD图谱Fig.1 XRD spectrum of copper anode slime
由图1可知,铜阳极泥中主要含Cu2S、CuSe、Cu2O(SO4)、PbSO4、AgCl、Sb2O3、Sb2O(SO4)2、Sb2S3等物相,Se、Te主要以铜、银的硒化物和碲化物的形式存在。其中,铜的硫化物和其他含铜化合物在酸性体系中不容易浸出,需要经选择被氧化后才能有效浸出。某些元素因含量少或结晶不完整的缘故,XRD仪器没有识别出明显的衍射峰,如金的矿相需要靠矿相分析来表征其赋存状态。
铜阳极泥的扫描电镜图和元素面扫及点扫能谱见图2。由图2(a)可知,铜阳极泥微观下主要以无定形的圆球状、棒状以及块状组成,能谱可以佐证XRD中Cu以硒化物、硫化物形式存在的分析结果。Pb、S、O出现位置重叠,并由能谱图2(b)中点1的Pb、S、O原子百分比推知Pb主要以PbSO4形式存在,这与XRD仪器分析结果一致;Se、Te出现位置与Cu、Ag分布大概一致,Cu可能与Se、Te存在于结合铜中,与物相分析结果相对应,而Ag可能与Se、Te共生,并结合能谱图2(b)中点2、点3和XRD图像分析,以Ag2Se、AgTe、AgCl的形式存在;As、Sb、S、O出现的位置几乎一致,其主要以氧化物、硫化物或砷锑酸盐的形式存在。

图2 铜阳极泥扫描电镜图和元素面扫能谱(a)及点扫能谱图(b)Fig.2 SEM and elemental surface scanning energy spectrum(a)and point scanning energy spectrum (b) of copper anode slime
1.4.2 浸出条件热力学分析
在H2SO4介质下,以MnO2为氧化剂进行浸铜实验,将阳极泥中铜的硒化物和硫化物等溶出,铜以硫酸铜的形式进入溶液,主要反应见式(1)—式(4)。采用HSC Chemistry 6.0软件进行浸出过程相关热力学的计算,根据吉布斯自由能的变化来判断特定条件下浸出反应的自发性和反应可进行限度。浸出过程热力学计算的ΔG-T的关系如图3所示,反应的吉布斯自由能均为负值,说明反应式(1)—式(4)是可以自发进行的,且随着温度的升高,反应的自由能变化值逐渐增大,说明反应进行趋势变小。

图3 反应式(1)—式(4)的ΔG-T的关系Fig.3 Relationship diagram of ΔG-T of reactions (1)—(4)
图4所示为25 ℃时,在P(O2)、P(H2)为标准大气压条件下,Cu-S-H2O、Cu-Se-H2O、Ag-Te-H2O、Mn-H2O系的Eh-pH图。其中,图4(a)是Cu-S-H2O系水溶液中稳定存在区域的Eh-pH图,单质Cu、Cu2S在pH 0~12的水溶液中均是稳定存在的,当有氧气或氧化剂存在且pH<3时,可以使不溶的Cu、Cu2S氧化为水溶性的Cu2+,S2-被氧化成S单质或SO42-(见图4(a)蓝色区域)。由Cu-Se-H2O系的Eh-pH图(图4(b))可见,其中Cu2Se、CuSe2、CuSe能稳定存在于pH 0~12的水溶液中,可通过在酸性体系中加入氧化剂调节溶液的氧化电势,使其转变为稳定态的Cu2+和SeO32-离子(见图4(b)蓝色影区域)。而从Ag-Te-H2O系的EhpH图(图4(c))可见,单质Ag和AgTe在不加氧化剂时是不溶于酸性或碱性溶液的,加入氧化剂时,电位升高有助于反应式(4)的进行。相对应在pH<3时由Mn-H2O体系的Eh-pH图可知,Mn(Ⅲ)位点从氧化锰晶体中释放进入溶液,转变为水溶性的Mn3+,而Mn3+仅在酸度超强条件下稳定存在。pH升高时,Mn3+会发生歧化反应,Mn(Ⅳ)被释放进入溶液并扩散至矿物表面完成氧化反应[26]。随着电势的降低,MnO2将转化为Mn2+,且酸度越大,Mn2+存在区域增大,MnO2转化成Mn2+的电势越高(见图4(d)蓝色区域),说明转化越容易进行。由图4(d)可知,MnO2在1.2 V才能稳定存在,足以说明MnO2具有强氧化性;而Cu、CuSe、Cu2S、AgTe等稳定存在的电位均在0.5 V以下,具有被MnO2氧化的趋势,同时在酸性条件下更容易被氧化,以离子形态进入溶液。因此,针对铜阳极泥中预处理脱铜过程,拟采取MnO2作为氧化剂,使铜单质以及铜的化合物氧化成Cu2+、SeO32-、SO42-,从而进入酸性溶液,理论上可行。

图4 25 ℃下不同体系的Eh-pH图:(a) Cu-S-H2O;(b) Cu-Se-H2O;(c) Ag-Te-H2O;(d) Mn-H2OFig.4 Eh-pH diagrams of different systems at 25 ℃:(a) Cu-S-H2O;(b) Cu-Se-H2O;(c) Ag-Te-H2O;(d) Mn-H2O
2 结果与讨论
本研究中考察了H2SO4浓度、MnO2添加量、液固比、反应温度和反应时间等单因素对铜浸出率的影响,以确定较优的浸出条件。
2.1 H2SO4浓度对Cu、As、Se浸出率的影响
在反应温度为80 ℃,浸出时间为120 min,液固比为4∶1,添加MnO2为10 g/L的条件下,根据图4 氧化还原电位(Eh)-pH图选定适宜的H2SO4浓度范围,考察H2SO4浓度对Cu、As、Se浸出率的影响,见图5。不加H2SO4时,铜的浸出率为46.62%,此时砷和硒基本不浸出,随着H2SO4浓度不断增大,硫酸铜氧化物溶解于酸性溶液中,且溶液中H+浓度较高,有助于增强MnO2氧化剂的活性,使CuSe、Cu2S等物相被氧化成Cu2+、SeO32-和SO42-进入溶液,使铜的浸出率持续提高,砷和硒的浸出率逐渐增大,当H2SO4体积浓度增至100 g/L时,铜的浸出率可以达到92.19%。MnO2的实际还原包括电化学和化学还原,而H+在两种还原途径中均起着重要的作用,促进MnO2和MnOOH的溶解以及Mn3+的产生[25,27],这恰好解释了在浸出过程中酸度较高的条件下,阳极泥预脱铜高这一实验结果。砷的浸出率随H2SO4浓度的增大先增大后趋于平缓,而硒浸出率在酸度增大到一定时反而有所下降,这一结果是由于Se(0)产生。在较高的H2SO4浓度下,不溶性的Se沉淀难以转化成可溶性的亚硒酸盐,进而硒浸出率降低[20]。后期,随着H2SO4浓度继续增加,铜的浸出率变化不明显。因此,针对铜阳极泥中MnO2预氧化处理酸浸脱铜过程,为保证较高的铜浸出率以及避免砷、硒的分散浸出,且为避免H2SO4浓度过高形成酸雾而造成工作环境的污染,综合考虑,选择H2SO4体积浓度100 g/L较为适宜。

图5 H2SO4体积浓度对Cu、As、Se浸出率的影响Fig.5 Effects of sulfuric acid concentration on leaching ratios of Cu, As and Se
2.2 MnO2添加量对Cu、As、Se浸出率的影响
控制浸出过程液固比为4∶1,设定H2SO4体积浓度为100 g/L,反应温度为80 ℃,浸出120 min,考察MnO2质量浓度对Cu、As、Se浸出率的影响,研究结果见图6。由图6可见,未添加氧化剂MnO2时,约有89%的铜被浸出;随着MnO2添加量增加,因MnO2的还原电位高于硫化矿物的还原电位,当其与这类矿物接触时会形成电偶腐蚀,前者作为阴极,后者作为阳极,两者之间产生强烈的电偶相互作用,尤其是当溶液中有足够的H+,促进更多的锰溶解[28],使大量铜的硫化物、硒化物被氧化并浸出,相应地,铜的浸出率逐渐提高;当MnO2添加量增至10 g/L时,铜的浸出率提高了约3%。然而,MnO2的添加量过多,未参加反应MnO2会使浸出渣率提高,铜的浸出率反而略有降低。与此同时,硒浸出率随MnO2的添加量的增大逐渐上升,砷浸出率从25.92%增大至37.99%,这与硒化物和砷化物等被氧化后生成少量硒酸根和砷酸根等离子密切相关。为此,考虑提高铜浸出率同时避免砷、硒的分散浸出原则,选择MnO2添加量为10 g/L较为适宜。

图6 MnO2添加量对Cu、As、Se浸出率的影响Fig.6 Effects of MnO2 addition on leaching ratios of Cu,As and Se
2.3 液固比对Cu、As、Se浸出率的影响
液固比的大小既影响矿浆黏度,又影响试剂消耗量和浸出率。本研究中设定反应温度为80 ℃,MnO2添加量为10 g/L,H2SO4体积浓度为100 g/L下浸出120 min,考察液固比为(1∶1)~(6∶1)对Cu、As、Se浸出率的影响,结果如图7所示,随着液固比的增大,铜的浸出率整体呈上升趋势,这是由于随着液固比增大,溶液黏度减小,阳极泥与浸出液和氧化剂接触面积增大,离子扩散更容易,使浸出速率加快,反应更彻底。当液固比增大为4∶1时,铜的浸出率达到最大值,继续增加液固比,铜的浸出率不再增加;与此同时,液固比从1∶1增加,砷的浸出率可从15.3%增加至35.0%,而硒的浸出率随液固比的增大变化不大。因此, 综合考虑浸出效率和试剂消耗量, 选择液固比4∶1较为适宜。
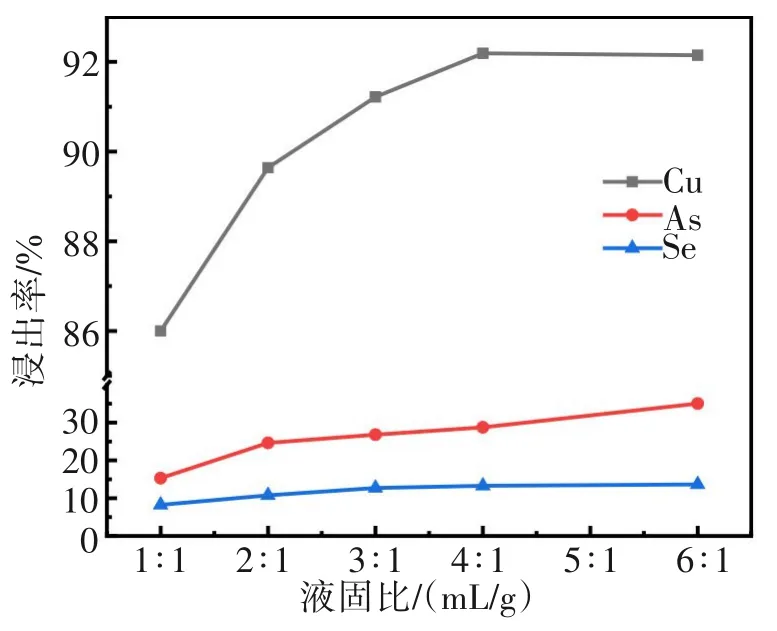
图7 液固比对Cu、As、Se浸出率的影响Fig.7 Effects of liquid-solid ratio on leaching ratios of Cu,As and Se
2.4 反应温度对Cu、As、Se浸出率的影响
提高浸出反应温度有利于扩散速率常数和体积化学反应速率常数的增大。设定液固比为4∶1,H2SO4体积浓度为100 g/L,添加MnO2为10 g/L条件下浸出120 min,考察反应温度对Cu、As、Se浸出率的影响,结果如图8所示。当温度从25 ℃升高到90 ℃,Cu的浸出率由88.38%增至92.45%,As的浸出率从23.63%提高到35.99%,Se浸出率从5.48%提高到15.29%。这与前人在H2SO4溶液中采用MnO2作氧化剂对黄铁矿、闪锌矿等硫化矿物高效氧化时获得的最佳温度在80~95 ℃研究结果是相似的[29],也与很多研究中温度对MnO2氧化Cu2S、CuSe、Ag(Se、Te)等的影响结果一致[30-31]。温度过高,容易形成浸出过程酸雾过大、污染环境,且有价金属分散严重,综合考虑,选择反应温度为80 ℃较为适宜。

图8 反应温度对Cu、As、Se浸出率的影响Fig.8 Effects of reaction temperature on leaching ratios of Cu, As and Se
2.5 反应时间对Cu、As、Se浸出率的影响
选定上述单因素实验中的较优工艺条件,即浸出过程反应温度为80 ℃,液固比为4∶1,H2SO4浓度为100 g/L、MnO2为10 g/L,探讨浸出时间对Cu、As、Se浸出率的影响,影响结果见图9。随着反应时间延长,铜浸出率逐渐增大,当浸出反应进行120 min时,铜浸出率达到92%,继续延长时间,铜浸出率增加幅度不大。随着反应时间增加到180 min,As的浸出率从23.02%提高到35.96%,Se浸出率基本维持在14%上下。综合考虑铜浸出率并避免砷、硒的分散浸出,选择适宜的反应时间为120 min。
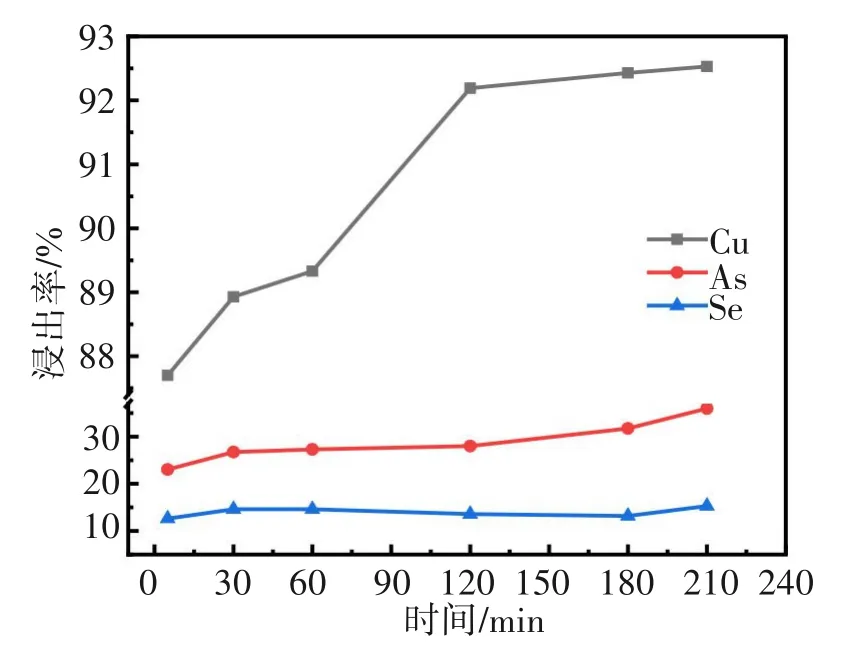
图9 反应时间对Cu、As、Se浸出率的影响Fig.9 Effects of reaction time on leaching ratios of Cu, As and Se
2.6 最优条件下的实验研究及浸出渣的XRD分析
根据以上的单因素实验可确定最优条件为:H2SO4浓度为100 g/L、液固比为4∶1、MnO2加入量为10 g/L、反应温度为80 ℃、反应时间为120 min。在以上条件下进行3次重复实验,其结果如表2所列。Cu、As、Se的平均浸出率分别为91.89%、28.18%和12.74%。浸出渣中Au、Ag等有价金属得到富集,由原来的0.97%和13.41%增加到1.24%和17.03%,便于后续回收,在一定程度上提高了金属的直收率。
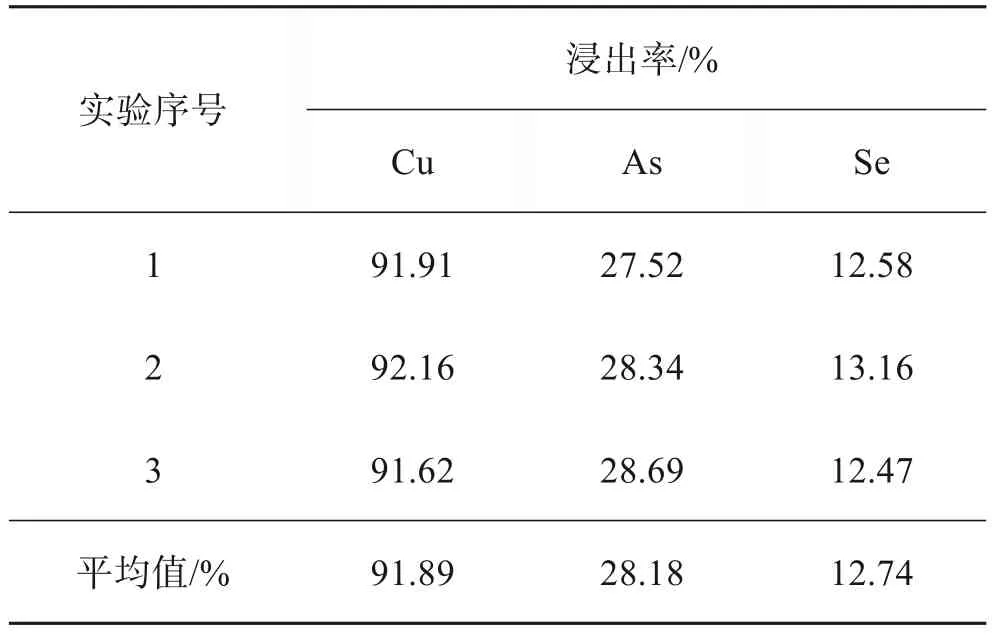
表2 最优条件浸出实验结果Table 2 Results of leaching experiment under optimal conditions
在最优条件下对阳极泥常压氧化浸出后的浸出渣进行XRD分析,其衍射图谱如图10所示,浸出渣中主要存在的物相有PbSO4、AgCl、Sb2O3、Sb2O(SO4)2、Sb2S3,与浸出前的XRD图谱分析结果相比,Pb、Ag、Sb的主要物相变化不明显,说明酸性预氧化处理对Pb、Ag、Sb元素的浸出影响不大,而含铜相Cu2S、CuSe消失,说明上述含铜相能被MnO2氧化为可溶的离子,从而达到有效浸出。这一点也验证了图4中酸性条件下 MnO2具有强氧化性,可使CuSe、Cu2S等被强烈氧化,以离子形态进入溶液的理论分析结果。
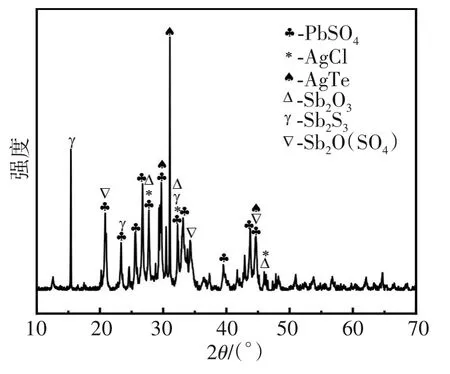
图10 浸出渣的XRD图谱Fig.10 XRD spectrum of leaching residue
2.7 浸出动力学分析
H2SO4体系中阳极泥的浸出过程属于液固相反应,矿物中的金属与酸反应后以离子形式进入溶液,该浸出过程可用收缩未反应核模型表示[32-34]。在液固比为4∶1,H2SO4含量为100 g/L,MnO2添加量为10 g/L的最优条件下,浸出温度分别为25、45、60、80 ℃,浸出时间分别为30、60、90、120、150、180 min,进行阳极泥浸出实验。反应温度不同时,铜浸出率随反应时间的变化趋势如图11所示。相同温度下,铜浸出率随浸出时间的延长而逐渐增大;浸出时间相同时,温度越高,铜浸出率越大。

图11 浸出温度不同时铜浸出率随反应时间的变化趋势Fig.11 Variation trend of copper leaching ratio with reaction time at different leaching temperatures
浸出过程的反应控制步骤主要有3种类型:化学反应控制、固膜扩散控制和混合控制[35],浸出速率取决于上述最慢的步骤。不同控制步骤的浸出反应动力学方程分别如下:
混合控制:ln(1-η)/3-1+(1-η)-1/3=k3t(7)式(7)中:ƞ为浸出率;t为反应时间;k为反应速率常数。
为了确定浸出反应过程的控制步骤,根据不同温度下的铜浸出率随反应时间的变化情况,将实验数据分为上述3个方程拟合,其中扩散控制的速率方程在25、45、60、80 ℃时线性拟合得到的相关系数R2依次为0.959 1、0.959 6、0.971 7、0.961 7,拟合曲线如图12所示。

图12 不同温度下1-3(1-ƞ)2/3+2(1-ƞ)与时间的关系Fig.12 Relationship between 1-3(1-ƞ)2/3+2(1-ƞ) and time at different temperatures
从图12中可知,不同温度下对应的拟合直线斜率分别为5.34×10-4、6.11×10-4、6.79×10-4、6.88×10-4。斜率作为反应速率常数k,不同温度时,以扩散控制方程的斜率lnk对1/T-作图,结果如图13所示。线性拟合系数R2为0.940 2,lnk与1/T-之间的线性关系良好,根据Arrhenius公式k=Aexp[-Ea/RT](k为反应的速率常数,A为指前因子,R为理想气体常数)计算反应的表观活化能Ea=4.1 kJ/mol。
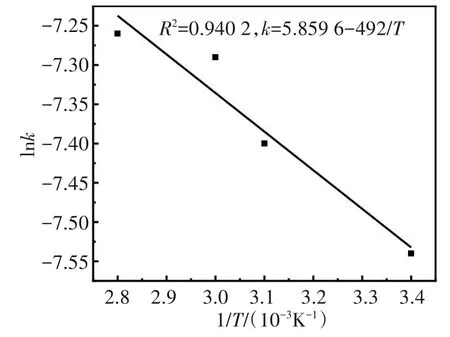
图13 lnk与1/T的关系Fig.13 Relationship between lnk与1/T
3 结 论
1)常压氧化脱铜实验的最优条件:H2SO4体积浓度为100 g/L、液固比为4∶1、MnO2加入量为10 g/L、反应温度为80 ℃、反应时间为120 min,在该条件下进行3次重复性实验,铜、砷、硒的平均浸出率分别分别91.89 %、28.18 %和12.74 %;根据动力学模型研究铜浸出率的控制步骤为扩散控制,由Arrhenius公式近似求得该浸出过程的表观活化能为4.1 kJ/mol。
2)本研究采用常压氧化脱铜预处理工艺处理铜阳极泥,优先脱出铜元素,降低渣中铜含量,减轻后续处理工艺压力,尤其降低对分金分银工序的影响,提高贵金属的回收率。与传统焙烧-酸浸法相比,具有烟尘率低、能耗低、环境友好等优点。

