激素治疗慢性肾脏病进展高风险IgA肾病患者的预后分析
——一项回顾性研究
高歌,张鑫越,冯玉华,窦婧予,吴雪莹,程根阳
450052 河南省郑州市,郑州大学第一附属医院肾脏内科
IgA 肾病(IgAN)是世界范围内常见的原发性肾小球肾炎[1],总发病率为2.5/10 万[2],约占我国原发性肾小球肾炎的45%[3]。IgAN 患者的临床表现各异,从无症状的尿路异常、高血压、肾病综合征到急进性肾小球肾炎(rapidly progressive glomerul-onephritis,RPGN)[4]。研究发现20%~40%的患者在诊断为IgAN后20~30年内逐渐发展为终末期肾病(end-stage renal disease,ESRD)[5],亚洲人群的肾功能下降更快,且预后较差[6-7]。
IgAN 的发病机制中免疫机制和自身免疫反应的参与均提示糖皮质激素(glucocorticoid,GC)对疾病治疗可能有益。2021年改善全球肾脏病预后组织(KDIGO)指南指出GC 在IgAN 患者治疗中的应用:对于给予最大程度支持治疗至少3 个月后,仍存在慢性肾脏病(CKD)进展高风险(24 h 尿蛋白定量仍>0.75~1.0 g/24 h)的患者,推荐考虑使用6个月的GC 治疗[当患者估算肾小球滤过率(eGFR)<50 mL·min-1·(1.73 m2)-1时,必须与患者讨论GC 治疗相关的毒性风险]。强化支持治疗对比免疫抑制策略治疗IgA 肾病(STOP-IgAN)研究发现,与支持治疗相比,加入GC 等免疫抑制剂治疗并没有改善CKD 进展风险高的IgAN 患者的预后,而且还增加了不良事件的发生率[8]。既往也有文献报道,GC 可以改善IgAN 患者的肾脏预后[9]。而TESTING 研究提出GC 治疗可以显著降低患者肾功能下降、肾衰竭或肾脏疾病导致死亡的复合结局的风险,改善患者的预后[10]。目前针对GC 治疗CKD 进展高风险IgAN 尚未得出统一结论。本研究旨在评估GC 对于CKD 进展风险高的IgAN 患者的治疗效果及其对IgAN 患者预后的影响,为该疾病的临床诊疗提供参考。
1 对象与方法
1.1 研究对象
本研究为一项单中心回顾性研究,收集2017年1月—2021年10月于郑州大学第一附属医院就诊的CKD进展高风险IgAN 患者。纳入标准:(1)年龄≥18 岁,随访至少6 个月,经肾组织活检确诊为IgAN;(2)支持治疗3 个月后24 h 尿蛋白定量的变化范围≥1.0 g/24 h、eGFR ≥30 mL·min-1·(1.73 m2)-1,考虑为CKD 进展风险高的IgAN 患者[10]。排除标准:(1)继发性IgAN,如继发于过敏性紫癜、系统性红斑狼疮、病毒性肝炎、肝硬化、银屑病、强直性脊柱炎等;(2)临床病理资料不完整,且肾活检样本中肾小球<8个;(3)合并微小病变肾病、膜性肾病或糖尿病肾病;(4)肾穿刺前GC 或免疫抑制剂使用时间>1 个月或随访过程中加用其他免疫抑制剂治疗的;(5)有严重的胃肠道疾病史;有活动性全身感染或严重感染史;合并其他主要器官系统疾病,包括充血性心力衰竭、慢性阻塞性肺疾病、哮喘,需要激素治疗等情况。本研究获郑州大学第一附属医院医学伦理委员会批准(2022-KY-1487)。
1.2 研究方法
1.2.1 资料收集:(1)临床资料,包括患者的性别、年龄、血压、血红蛋白、血白蛋白、血尿酸、血肌酐、eGRF、24 h 尿蛋白定量、尿红细胞计数、血压等。(2)肾脏病理资料,病理诊断参照2017年IgAN 牛津分型[11],①系膜细胞增生(M);②内皮细胞增生(E);③节段性硬化或粘连(S);④肾小管萎缩或间质纤维化(T);⑤新月体病变(C)。肾活检由经验丰富的病理学医师和肾病学医师进行评估。采用慢性肾脏病流行病学合作(CKD-EPI)方程计算eGFR。
1.2.2 分组及治疗:根据治疗方案将患者分为支持治疗组和激素治疗组。支持治疗组:患者接受最大耐受剂量的肾素-血管紧张素系统抑制剂(angiotensin converting enzyme inhibitor,ACEI)和/或血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)。当24 h 尿蛋白定量≥1 g/24 h 时,目标血压应控制在125/75 mmHg(1 mmHg=0.133 kPa)以下;当患者24 h 尿蛋白定量<1 g/24 h 时,目标血压应控制在130/80 mmHg 以下。
激素治疗组:患者在接受3~6 个月最大耐受剂量的ACEI/ARB 药物治疗的基础上24 h 尿蛋白定量仍≥1.0 g/24 h 时加用GC 治疗(甲泼尼龙片,起始剂量为0.4 mg·kg-1·d-1,最大剂量32 mg/24 h,2 个月后开始逐渐减量,每月减少4 mg,共使用6~9 个月)[9]。
观察患者治疗1年内疾病缓解情况及不良事件发生情况。完全缓解定义为尿蛋白定量<0.2 g/24 h,血白蛋白>35 g/L,血肌酐稳定(血肌酐上升<基线值的15%);部分缓解定义为24 h 尿蛋白定量<1 g/24 h,血清白蛋白>35 g/L,血肌酐稳定(血肌酐上升<基线值的15%);余均定义为未缓解[12]。
1.2.3 随访:随访时间定义为开始治疗至最后1 次就诊(门诊/住院)、死亡或ESRD 之间的时间间隔,随访至2022-10-31。主要终点事件定义为进入ESRD[eGFR<15 mL·min-1·(1.73 m2)-1]或透析。复合终点事件定义为:eGFR 较基线持续下降30%,或进入ESRD 或透析,或死亡。
1.3 统计学方法
采用SPSS 26.0 软件进行数据的统计学处理。符合正态分布的计量资料以(±s)表示,组间比较采用两独立样本t检验;非正态分布数据以M(P25,P75)表示,组间比较采用Kruskal-Wallis 检验。计数资料以相对数表示,组间比较采用χ2检验或者Fisher's 确切概率法。采用倾向性得分匹配法对两组患者的性别、年龄、24 h尿蛋白定量、eGFR 进行1∶1 匹配。采用Kaplan-Meier方法绘制生存曲线,采用Log-rank 检验比较两组主要/复合终点事件累积发生率的差异。采用单因素和多因素Cox 回归分析探究CKD 进展高风险IgAN 患者发生主要终点事件的影响因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料及肾脏病理
最终纳入CKD 进展高风险IgAN 患者236 例。根据治疗方案进行分组后,采用倾向性得分匹配法按照性别、年龄、24 h 尿蛋白定量、eGFR 对两组患者进行1∶1 匹配,最终激素治疗组和支持治疗组各有97 例患者。两组患者性别、年龄、血红蛋白、血白蛋白、血尿酸、血肌酐、eGFR、24 h 尿蛋白定量、收缩压、舒张压、肾脏病理M1、E1、S1、T1~2、C1~2 占比比较,差异无统计学意义(P>0.05),两组患者的基线资料匹配均衡,见表1。
2.2 不同治疗方案下两组患者的缓解情况
治疗1年时间内,激素治疗组出现完全缓解23 例,支持治疗组出现完全缓解10 例,激素治疗组完全缓解率高于支持治疗组,差异有统计学意义(χ2=6.171,P=0.013);激素治疗组出现部分缓解38 例,支持治疗组出现部分缓解25 例,激素治疗组部分缓解率高于支持治疗组,差异有统计学意义(χ2=3.973,P=0.046);激素治疗组未缓解36 例,支持治疗组未缓解62 例,激素治疗组未缓解率低于支持治疗组,差异有统计学意义(χ2=13.940,P<0.001)。
2.3 CKD 进展高风险IgAN 患者终点事件累积发生率的生存曲线
患者中位随访时间为18.00(9.75,28.00)个月;激素治疗组主要终点事件发生率(16.49%,16/97)低于支持治疗组(28.87%,28/97),差异有统计学意义(χ2=4.233,P=0.040)。Kaplan-Meier 生存分析结果显示,激素治疗组的主要终点事件累积生存率高于支持治疗组,差异有统计学意义(χ2=4.495,P=0.034),见图1A;激素治疗组复合终点事件发生率(24.74%,24/97)低于支持治疗组(41.24%,40/97),差异有统计学意义(χ2=5.969,P=0.015)。Kaplan-Meier 生存分析结果显示,激素治疗组的复合终点事件累积生存率高于支持治疗组,差异有统计学意义(χ2=4.419,P=0.036),见图1B。

图1 两组患者终点事件累积生存率Figure 1 Cumulative survival rate of end-point events in both groups
符合纳入标准的236 例患者中有177 例中等量蛋白尿(24 h 尿蛋白定量为1.0~3.5 g/24 h)患者,采用倾向性得分匹配法按照性别、年龄、尿蛋白定量、eGFR 对激素治疗和支持治疗的患者进行1∶1 匹配后,激素治疗中等量蛋白尿者与支持治疗中等量蛋白尿者各有76例患者匹配成功。对两组患者进行预后分析,激素治疗中等量蛋白尿者主要终点事件发生率(10.52%,8/76)低于支持治疗中等量蛋白尿者(26.32%,20/76),差异有统计学意义(χ2=6.304,P=0.012)。Kaplan-Meier生存曲线结果显示,激素治疗中等量蛋白尿者主要终点事件累积生存率高于支持治疗中等量蛋白尿者,差异有统计学意义(χ2=4.127,P=0.042),见图2A。两组患者中,激素治疗中等量蛋白尿者复合终点事件发生率(15.79%,12/76)低于支持治疗中等量蛋白尿者(36.84%,28/76),差异有统计学意义(χ2=8.686,P=0.003)。Kaplan-Meier 生存曲线分析结果显示,激素治疗中等量蛋白尿者的复合终点事件累积生存率高于支持治疗中等量蛋白尿者,差异有统计学意义(χ2=4.934,P=0.026),见图2B。

图2 中等蛋白尿患者终点事件累积生存率Figure 2 Cumulative survival rate of endpoint events in patients with moderate proteinuria
2.4 CKD 进展高风险IgA肾病患者发生主要终点事件的影响因素分析
以患者是否发生主要终点事件为因变量(赋值:是=1,否=0),以性别(赋值:男性=1,女性=0)、年龄(赋值为实测值)、高血压(赋值:是=1,否=0)、血红蛋白(赋值为实测值)、血白蛋白(赋值为实测值)、血尿酸(赋值为实测值)、血肌酐(赋值为实测值)、eGFR(赋值为实测值)、尿蛋白量(赋值为实测值)、尿红细胞计数(赋值为实测值)、M1(赋值:有=1,无=0)、E1(赋值:有=1,无=0)、S1(赋值:有=1,无=0)、T1~2(赋值:有=1,无=0)、C1~2(赋值:有=1,无=0)、应用激素(赋值:是=1,否=0)为自变量,进行单因素Cox 比例风险回归分析,结果显示,血红蛋白、血尿酸、血肌酐、eGFR、24 h 尿蛋白量、T1-2、应用激素是CKD 进展高风险IgA 患者发生主要终点事件的影响因素(P<0.05)。将单因素分析中P<0.05 的指标纳入多因素Cox 比例风险回归模型,结果显示,血红蛋白、血肌酐、eGFR、24 h 尿蛋白定量是CKD 进展高风险IgAN 患者发生主要终点事件的影响因素(P<0.05),见表2。
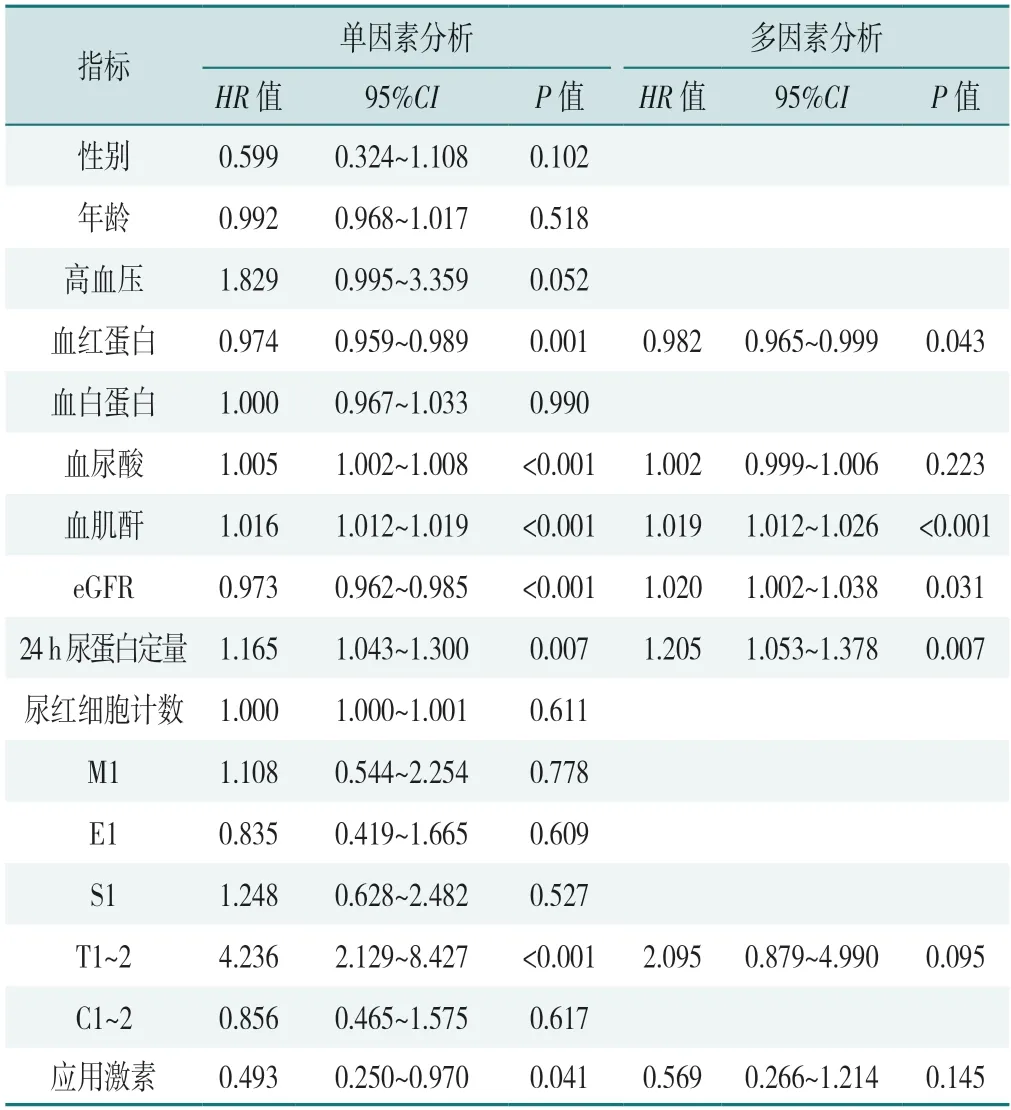
表2 CKD 进展高风险IgAN 患者主要终点事件影响因素的单因素和多因素Cox 比例风险回归分析Table 2 Cox regression analysis of influencing factors of primary endpoint event in IgAN patients with high risk of CKD progression
2.5 安全性评价
本研究记录了治疗1年内两组患者不良事件的发生情况,见表3。激素治疗组的感染发生率高于支持治疗组,差异有统计学意义(P<0.05);两组消化道症状和其他不良反应的发生率比较,差异无统计学意义(P>0.05)。激素治疗组有22 例患者在治疗1年内曾发生感染,包括上呼吸道的感染、肺部炎症以及带状疱疹,但多数症状较轻。此外,激素治疗组患者中有5 例在治疗6 个月内发生了类固醇糖尿病。
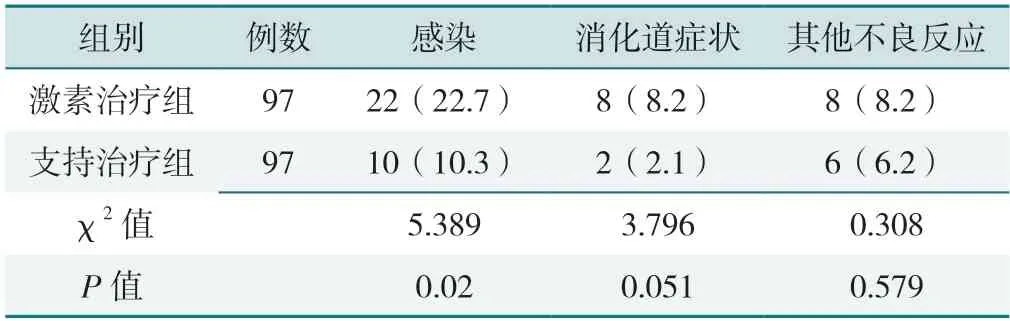
表3 两组患者不良事件发生率比较[例(%)]Table 3 Comparison of incidence of adverse reactions between the two groups
3 讨论
IgAN 作为世界上常见的原发性肾小球肾炎之一,也是ESRD 的主要病因,在临床实践中通常根据IgAN患者的临床和病理特征来进行个体化治疗。对于接受了至少3 个月的优化支持治疗,但持续出现24 h 尿蛋白定量>1 g/24 h 的患者而言,GC 是目前唯一可用的有证据支持其疗效的免疫抑制剂。但目前GC 治疗IgAN 的效果仍为目前讨论的热点[13]。因此,本研究探讨激素治疗对CKD 进展高风险IgAN 患者预后的影响,为临床工作提供更有力的证据。
激素具有降低蛋白尿、保护肾功能、减轻或延缓肾组织损害的作用。既往有研究表明低白蛋白血症是肾脏病进展的危险因素[14],原因可能与白蛋白具有抗氧化性,可以对系膜细胞起到保护作用有关,白蛋白的下降常伴随机体抗氧化能力的下降与肾脏病的进展。本研究在基线数据均衡的情况下,比较两组患者治疗1年内的缓解情况,发现GC 治疗可以提升IgAN 缓解率。
近些年LV 等[10]对原发性IgAN 患者进行了大型随机对照试验,纳入24 h 尿蛋白定量≥1.0 g/24 h、eGFR 30~120 mL·min-1·(1.73 m2)-1的患者,将入组患者随机分为激素治疗组和安慰剂治疗组,与安慰剂相比,6~9 个月的疗程口服甲泼尼龙,能够明显降低肾功能下降、肾衰竭需要透析、肾移植或由于肾脏疾病死亡的复合结局风险。研究对比得出减少剂量方案和原始全剂量方案之间的治疗效果没有显著的异质性;然而,口服甲泼尼龙增加了严重不良事件的发生率,与全剂量方案相比,减少剂量方案能够减少不良事件的发生率[9]。2020年发表的一项多中心研究结果也表明GC 在高危IgAN 患者中疗效明显优于支持治疗[15]。然而既往也有STOP-IGAN 试验和VALIGA 队列研究表明,激素加肾素-血管紧张素系统阻断(RASBs)与仅RASBs 在肾脏生存方面没有显著差异[8,16]。本研究从本院病例出发,将激素治疗组与支持治疗组患者出现缓解或终点事件的情况进行比较,Kaplan-Meier 生存曲线分析提示,激素治疗组的IgAN 患者的主要终点事件发生率低于支持治疗组,激素治疗可以提升肾脏缓解率,降低肾功能下降、肾衰竭风险。目前对于激素治疗中等蛋白尿的IgAN 患者的疗效仍有争议。既往一项回顾性研究将纳入患者按照不同蛋白尿水平进行分组,比较不同组别患者的临床病理特征、治疗方案和肾脏结局发现对于中度蛋白尿的IgAN 患者,与单独支持治疗或GC 加免疫抑制剂相比,GC 治疗能够更好地改善肾脏预后[17];本研究结果与之一致。
近十年来,人们在不断探索预测IgAN 长期预后的预测因子。本研究多因素Cox 比例风险回归分析结果显示血红蛋白、血肌酐、eGFR、24 h 尿蛋白定量是IgAN患者主要终点事件发生的影响因素。IgAN 患者临床表现各异,据报道有5%~10%患者起病时表现为肾病综合征[18],出现大量蛋白尿的患者常预示晚期失代偿性的严重肾小球损害。既往研究表明IgAN 患者的蛋白尿水平与肾脏预后呈强正相关,大量蛋白尿的患者常有较差的临床表现,如血压和血肌酐水平较高,eGFR 和血白蛋白水平较低,伴有大量蛋白尿的患者常有更差的肾脏预后,在随访期间发生ESRD 的发生率高于中等蛋白尿患者[17],也有研究支持这一观点,提出蛋白尿对于IgAN预后的影响尤其明显,24 h尿蛋白定量>1 g/24 h时,出现肾脏终点事件的风险明显上升[19]。既往研究提出肾功能不全是IgAN 患者预后不良的影响因素[20],本研究与之相似。目前有研究表明伴有24 h 尿蛋白定量>1.0 g/24 h、高血压、肾缺血因素的患者进展至ESRD的风险更高,随访期间持续蛋白尿是IgAN 进展的独立预测因素[21-22],也有研究提示组织学病变对于肾脏预后同样具有预测作用[23]。本研究发现是否应用激素并不是影响IgAN 患者预后的因素,这一结果可能与本研究纳入样本量少有关。因此对于早期大量蛋白尿、高血压、高尿酸血症和贫血应予以重视,加强肾功能监测,早期给予积极治疗和评估。
GC 是非特异性免疫抑制剂,并可能通过其对IgAN的自身免疫性发病机制的影响而产生益处。但同时,GC 的使用也会伴随不良事件的出现。GC 可能会增加感染的风险,由于本研究中患者口服激素的剂量受到严格控制,故并未出现严重不良事件。22 例患者在治疗过程中曾发生了感染,包括上呼吸道感染、肺炎和带状疱疹,但多数症状较轻。5 例患者在随访2 个月或3 个月时发生类固醇糖尿病。有研究报道,类固醇糖尿病的发病率为1.5%~55%。类固醇糖尿病的最短发病时间为7 d,大多数类固醇糖尿病发生在类固醇治疗后3~6 个月[24]。长期高血糖存在血管受损、动脉硬化和慢性糖尿病微血管病的发生风险增加等危害,并且随着病情的发展,可能出现血管通透性改变和闭塞性疾病或组织长期缺氧导致的心脏、肾脏、眼等脏器的损伤,并出现失明、伤口愈合缓慢、慢性皮肤溃疡或截肢等情况。在以往关于GC 治疗肾小球肾炎的研究中,类固醇糖尿病常被忽略,今后应增加对此类情况的重视。
本研究存在一定的局限性,首先,由于本研究为单中心回顾性研究,研究结果不一定能代表其他地区。其次,本研究随访时间较短,考虑到IgAN 是一种进展缓慢的疾病,可能需要更长的随访期(>10年)才能得出更可信的结论。再次,本研究中未记录到严重的不良事件,患者对激素的耐受性良好。这可能与随访过程中大多数患者不记得轻微或中度的不良事件有关。因此,需要进一步开展大规模、多中心、长期随访、更详细的临床和病理数据研究,为IgAN 患者的最佳治疗方案提供更科学的依据。
综上所述,在CKD 进展高风险IgAN 患者中,与单纯支持治疗相比,GC 治疗可以明显提升肾脏缓解率,降低肾功能下降、肾衰竭风险。但仍需警惕其不良反应的发生。
作者贡献:程根阳进行文章的构思与设计,研究方案的可行性分析,对文章整体负责,监督管理;高歌进行数据整理、统计学处理并撰写论文;张鑫越、冯玉华、窦婧予、吴雪莹进行数据收集。
本文无利益冲突。

