社区H型高血压患者药物基因作用靶点多态性分布及叶酸联合维生素D干预效果研究
庞爱梅,高伟,张恒,蒲双双,郭莉莉,范子荣,刘海霞,刘瑞霞*
1.250011 山东省济南市,山东中医药大学附属医院检验科 山东中医药大学附属医院老年医学保健科
2.250021 山东省济南市,济南和合医学检验所
高血压是我国常见的慢性病之一,也是心脑血管病最主要的危险因素。H 型高血压[原发性高血压伴同型半胱氨酸(Hcy)升高]的患者较不伴Hcy 升高的高血压患者心脑血管并发症发生率高5 倍,较正常人群的心脑血管并发症发生率高25~30 倍[1],严重影响人们的健康及生活质量。目前用于治疗高血压的常用药物主要有利尿剂、β 受体阻滞剂、血管紧张素转化酶抑制剂(ACEI)、钙离子通道抑制剂(CCB)、血管紧张素Ⅱ受体拮抗剂(ARB)。临床上对高血压患者一线施药过程中,降压作用个体差异较大,约61%的患者使用的降压药物不合适[2-3],药物代谢过程中药物代谢酶与药物作用靶点基因对于其代谢情况均有重要影响[4]。为提高基层医务人员和社会公众的知晓率、达标率,本研究随机抽取济南市槐荫区20 个社区的200 例高血压血压控制不佳患者,探寻其基因分布的多态性及用药情况,为高血压患者进行个体化用药指导提供理论依据。
1 对象与方法
1.1 研究对象
2020年6月—2022年6月,随机抽取山东省济南市槐荫区20 家街道办事处社区卫生服务中心,每家卫生服务中心随机收集血压控制不佳的高血压患者10例,共计200 例。其中男性101 例,女性99 例;年龄45~65 岁,平均(53.7±18.2)岁。纳入标准:参照《中国高血压防治指南2018年修订版》[5]H 型高血压诊断标准,收缩压≥140 mmHg(1 mmHg=0.133 kPa)和/或舒张压≥90 mmHg;男性Hcy<11.4 μmol/L,女性Hcy<10.4 μmol/L;曾连续接受15 d 以上抗高血压药物治疗。排除标准:患有严重的心、肺、脑及血液系统疾病及肝肾功能衰竭者;患有癫痫、卒中或其他神经系统器质性疾病史或精神病史者;恶性肿瘤及其他危重症的患者。患者均签署知情同意并能够严格遵照医嘱要求。本研究已获得山东中医药大学附属医院伦理委员会伦理审批[(2020)临床科研申报第(151)号]。
1.2 研究方法
1.2.1 对研究对象实施家庭医生签约模式,建立档案、高血压达标健康科普宣教、定期随访。对符合纳入标准的200例患者治疗前首先进行5类常用抗高血压药物[利尿剂(氯噻嗪、氢氯噻嗪、苄氟噻嗪、氯噻酮),β受体阻滞剂(美托洛尔、卡维地洛、阿普洛尔、比索洛尔、拉贝洛尔),ACEI(贝那普利、福辛普利、依那普利、培哚普利、雷米普利),CCB(硝苯地平、非洛地平、拉西地平、氨氯地平、西尼地平),ARB(氯沙坦、伊贝沙坦、坎地沙坦、缬沙坦、厄贝沙坦)]相关高血压个体化用药基因位点的基因多态性检测。将患者随机分为基因导向治疗组(基因组)与基因导向协同叶酸、维生素D 治疗组(基因导向组),每组100 例。基因组根据检测的高血压基因位点的特点调整用药;基因导向组在基因组治疗方案的基础上同时服用叶酸、维生素D。
1.2.2 干预初始(M0)、干预3 个月(M3)、干预6 个月(M6)时采集患者晨间(8:00~10:00)未服用降压药物情况下坐位收缩压和舒张压。晨起服药前抽取各组患者空腹静脉血2 mL 置于抗凝管,按照要求操作存储,用于生化指标和基因多态性检测。记录患者病例情况、不良反应发生情况、脑卒中发生情况。采用Fascan 48E多通道荧光分析仪、SNP-U6 天隆测序反应通用试剂盒进行基因测序;采用液相色谱串联质谱法检测血清Hcy浓度。血液样本检测由济南和合医学检验所完成。
1.3 诊断标准
参考《高血压合理用药指南(第2 版)》[6]、药物代谢酶和《药物作用靶点基因检测技术指南(试行)》[7],5 类抗高血压药物作用靶点基因中,与药物代谢酶基因多态性位点相关的分别是CYP3A5(A6986G)、CYP2C9(c.1075A>C)、CYP2D6(c.100C>T),CYP3A5 基因型AA、AG、GG 分别显示代谢功能正常、略低与较低;CYP2C9 基因型AA、AC、CC 分别显示代谢功能正常、略低与较低;CYP2D6 基因型CC、CT、TT、c.100 C>T:CYP2D6*5/*5 分别显示代谢功能正常、略低与较低;与药物作用靶点敏感性基因多态性位点相关的是ADRB1/ACEI(I/D)/AGTR1/NPPA,ADRB1 c.1165 G>C:CC、GC、GG位点分别显示敏感性较高、略高于正常;ACEI(I/D):D/D、I/D、I/I 位点分别显示敏感性较高、略高于正常;AGTR1 c.1166 A>C:AA、AC 位点分别显示敏感性正常、略高;NPPA T2238C:CT、TT 位点分别显示敏感性略高于正常。
1.4 统计学方法
采用Excel 软件建立数据库,2 名研究者分别独立录入数据并进行核对。采用SPSS 20.0 统计学软件进行数据分析。符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,重复测量资料采用重复测量方差分析。计数资料以相对数表示,组间比较采用χ2检验。采用Pearson 相关性分析或Spearman 秩相关分析探究性别、年龄、收缩压、舒张压与Hcy 的相关性。以P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象一般资料比较
男性和女性高血压患者年龄、收缩压、舒张压比较,差异无统计学意义(P>0.05),见表1。
表1 研究对象一般资料特征(±s)Table 1 Baseline characteristics of study subjects

表1 研究对象一般资料特征(±s)Table 1 Baseline characteristics of study subjects
性别 例数年龄(岁)收缩压(mmHg)舒张压(mmHg)男10157.0±6.0148±1589±10女9956.0±6.0148±1590±10 t 值0.8150.110-0.093 P 值0.4170.9120.926
2.2 性别、年龄、收缩压、舒张压与Hcy 的相关性分析
研究对象性别、收缩压、舒张压与Hcy 水平具有相关性(P<0.05),见表2。

表2 研究对象的年龄、性别、收缩压、舒张压与Hcy 水平的相关性分析Table 2 Correlation analysis of sex,age,systolic blood pressure,diastolic blood pressure and Hcy level
2.3 高血压患者基因多态性的不同基因位点表达分析
5 类抗高血压药物基因中,与药物代谢酶基因多态性位点相关的分别是CYP3A5(A6986G)、CYP2C9(c.1075A>C)、CYP2D6(c.100C>T),CYP3A5 基因型代谢功能正常、略低与较低表达频数占比分别为7.00%、33.50%、59.50%;CYP2C9 基因型代谢功能正常、略低与较低表达频数占比分别为88.00%、11.50%、0.50%;CYP2D6 基因型代谢功能正常、略低与较低表达频数占比分别为26.26%、38.38%、35.35%、1.00%。与药物作用靶点敏感性基因多态性位点相关的是ADRB1、ACEI(I/D)、AGTR1、NPPA,ADRB1 药物作用靶点敏感性较高、略高于正常表达频数占比分别为50.50%、41.50%、8.00%;ACEI(I/D)药物作用靶点敏感性较高、略高于正常表达频数占比分别为9.00%、43.50%、47.50%;AGTR1 药物作用靶点敏感性敏感性正常、略高表达频数占比分别为91.00%、9.00%;NPPA 药物作用靶点敏感性略高于正常表达频数占比分别为1.50%、98.50%,见表3。
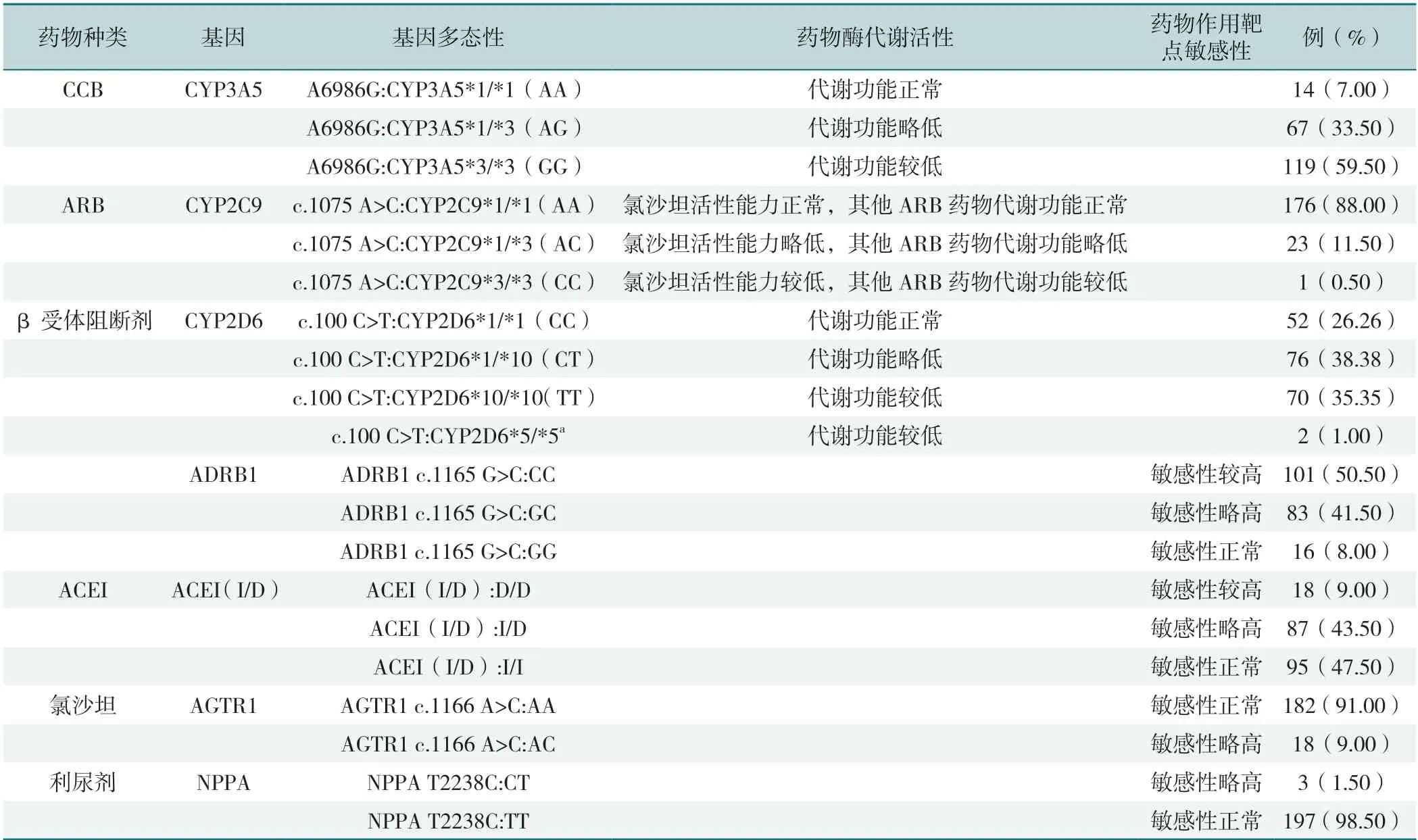
表3 药物代谢酶基因多态性分布与药物作用靶点基因多态性分布(n=200)Table 3 Distribution of polymorphism and target polymorphism of drug metabolism enzymes
2.4 基因组高血压基因多态性个体化用药对血压的影响
A6986G:CYP3A5*1/*1(AA)、ACEI(I/D):D/D、c.100 C>T:CYP2D6*1/*1(CC)患者M3、M6舒张压 低 于M0,A6986G:CYP3A5a1/a3(AG)、ADRB1 c.1165 G>C:GG、c.1075 A>C:CYP2C9*1/*3(AC)、c.1075 A>C:CYP2C9*3/*3(CC)患者M6舒张压低于M0,A6986G:CYP3A5*3/*3(GG)、ADRB1 c.1165 G>C:CC、ACEI(I/D):I/I、c.1075 A>C:CYP2C9*1/*1(AA)、AGTR1 c.1166 A>C:AA、NPPA T2238C:TT、c.100 C>T:CYP2D6*10/*10(TT)患者M3、M6收缩压、舒张压低于M0,ADRB1 c.1165 G>C:GC、ACEI(I/D):I/D、c.100 C>T:CYP2D6*1/*10(CT)患者M6收缩压低于M0,M3、M6舒张压低于M0,差异有统计学意义(P<0.05);AGTR1 c.1166 A>C:AC、c.100 C>T:CYP2D6*1/*1(CC)患者M0、M3、M6收缩压、舒张压比较,差异均无统计学意义(P>0.05),见表4。
表4 基因组治疗前后基因多态性与患者的血压水平改善情况(±s,mmHg,n=100)Table 4 Gene polymorphism and improvement in blood pressure before and after treatment in the genome group

表4 基因组治疗前后基因多态性与患者的血压水平改善情况(±s,mmHg,n=100)Table 4 Gene polymorphism and improvement in blood pressure before and after treatment in the genome group
注:M0=干预初始,M3=干预3 个月,M6=干预6 个月;a 表示与M0 比较P<0.05;患者血压重复测量3 次。
基因多态性例数收缩压舒张压M0M3M6F 值P 值M0M3M6F 值P 值CYP3A5 A6986G:CYP3A5*1/*1(AA)6144±14 130±12133±92.285 0.10692±884±6a81±5a5.194 0.007 A6986G:CYP3A5*1/*3(AG)35146±24 142±17139±163.048 0.05189±10 86±10 84±9a6.411 0.002 A6986G:CYP3A5*3/*3(GG)59148±14 140±16a137±13a 15.206 <0.001 90±10 84±8a 83±10a 27.650 <0.001 ADRB1 ADRB1 c.1165 G>C:CC50147±15 136±13a135±13a 14.017 <0.001 90±10 83±8a83±9a 19.724 <0.001 ADRB1 c.1165 G>C:GC43149±16 144±18140±15a6.960 0.00190±987±8a 84±10a 13.417 <0.001 ADRB1 c.1165 G>C:GG7139±37 144±10134±142.568 0.08191±1086±7 80±12a 6.905 0.001 ACEI(I/D)ACEI(I/D):D/D5152±21 148±24143±141.973 0.14492±884±6a 82±10a 6.401 0.002 ACEI(I/D):I/D46144±19 139±15136±13a5.857 0.00489±10 84±6a 82±11a 14.325 <0.001 ACEI(I/D):I/I49149±16 139±15a138±15a 12.477 <0.00191±985±9a84±8a 16.318 <0.001 CYP2C9 c.1075 A>C:CYP2C9*1/*1(AA)87148±15 139±16a137±14a 19.227 <0.001 90±10 84±10a 83±10a 33.004 <0.001 c.1075 A>C:CYP2C9*1/*3(AC)12142±32 144±13138±131.814 0.16891±789±11 84±9a4.389 0.015 c.1075 A>C:CYP2C9*3/*3(CC)1141±23 140±14140±181.138 0.28889±989±11 85±7a5.417 0.022 AGTR1 AGTR1 c.1166 A>C:AA95146±18 139±15a136±13a 18.258 <0.00190±984±8a83±9a 39.089 <0.001 AGTR1 c.1166 A>C:AC5153±18 148±24147±190.669 0.51489±1287±687±15 0.293 0.746 NPPA NPPA T2238C:CT 2141±98147±15 127±15128±40.658 0.52088±1183±680±40.799 0.452 NPPA T2238C:TT18 140±16a138±14a 17.698 <0.001 90±10 85±8a 83±10a 33.931 <0.001 CYP2D6 c.100 C>T:CYP2D6*1/*1(CC)29150±17 146±18143±172.595 0.07991±986±9a83±8a9.712 <0.001 c.100 C>T:CYP2D6*1/*10(CT)41143±19 137±11135±10a6.111 0.00389±10 84±7a83±9a 11.772 <0.001 c.100 C>T:CYP2D6*10/*10(TT)30147±14 137±14a135±14a 10.095 <0.001 90±10 84±8a 83±11a 14.501 <0.001
2.5 基因组与基因导向组干预前后Hcy 水平、血压比较
基因组与基因导向组Hcy 水平组间比较结果显示,M0基因组与基因导向组M0Hcy 水平比较,差异无统计学意义(P>0.05),M3、M6基因导向组Hcy 水平低于基因组,差异有统计学意义(P<0.05)。组内比较结果显示,基因组M6Hcy 水平低于M0,基因导向组M3、M6Hcy 水平低于M0,M6Hcy 水平低于M3,差异有统计学意义(P<0.05),见表5。
表5 基因组与基因导向组干预前后Hcy 水平比较(±s,μmol/L)Table 5 Comparison of Hcy levels before and after intervention between the genome and gene-directed group

表5 基因组与基因导向组干预前后Hcy 水平比较(±s,μmol/L)Table 5 Comparison of Hcy levels before and after intervention between the genome and gene-directed group
注:a 表示与M0 比较P<0.05,b 表示与M3 比较P<0.05。
组别例数M0M3M6F 值P 值基因组10016.01±6.4816.38±6.9015.17±4.27a 4.726 0.042基因导向组 10016.16±5.6213.47±5.70a 13.01±5.70ab 4.937 <0.001 t 值0.7381.1792.844 P 值0.462<0.0010.005
基因组与基因导向组收缩压、舒张压组间比较结果显示,M0基因组与基因导向组收缩压、舒张压比较,差异无统计学意义(P>0.05),M3、M6基因导向组收缩压、舒张压低于基因组,差异有统计学意义(P<0.05)。组内比较结果显示,基因组、基因导向组M6收缩压、舒张压低于M0,M6收缩压低于M3,差异有统计学意义(P<0.05),见表6。
表6 基因组与基因导向组干预前后血压比较(±s,mmHg)Table 6 Comparison of blood pressure before and after intervention between the genome and gene-directed group
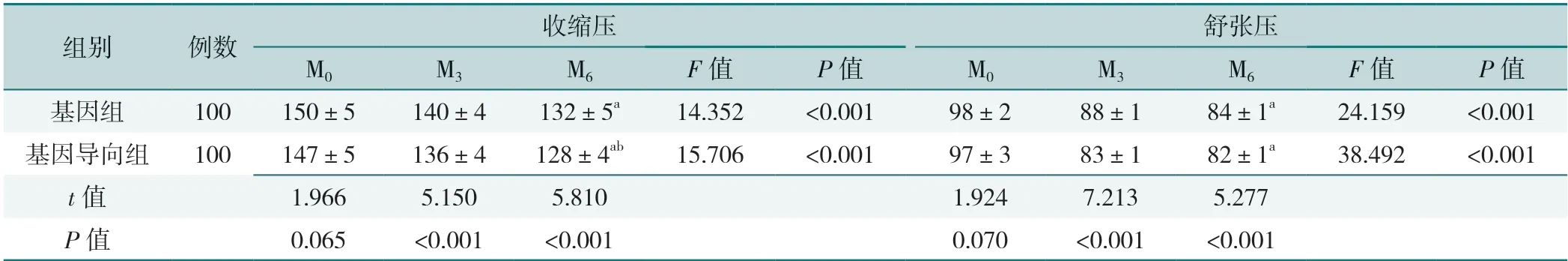
表6 基因组与基因导向组干预前后血压比较(±s,mmHg)Table 6 Comparison of blood pressure before and after intervention between the genome and gene-directed group
注:a 表示与M0 比较P<0.05,b 表示与M3 比较P<0.05。
组别例数收缩压舒张压M0M3M6F 值P 值M0M3M6F 值P 值基因组100150±5140±4132±5a14.352<0.00198±288±184±1a24.159<0.001基因导向组100147±5136±4128±4ab15.706<0.00197±383±182±1a38.492<0.001 t 值1.9665.1505.8101.9247.2135.277 P 值0.065<0.001<0.0010.070<0.001<0.001
3 讨论
个体编码基因的遗传差异进而诱导药物在体内的药物代谢动力学发生改变,是引起药物临床疗效差异的关键因素[8],药物代谢酶以及药物作用受体或靶位等药物反应相关蛋白的基因变异是引起药物反应个体差异和种族差异的根本原因[9-10]。有关中国原发性高血压患者ACEI 类药物治疗与ACEI I/D 基因型多态性相关性的11 项随机对照研究发现,DI 基因型和DD 基因型的患者对ACEI 类降压药物具有更好的疗效反应。β 受体阻滞剂降压的作用位点有显著的个体和族群差异,其中CYP2D6*10 为亚洲人特有。ARB 在体内主要通过CYP2C9 代谢,CCB 类药物主要受CYP3A5 基因多态性影响较大,对于CCB 在体内的代谢主要依靠CYP3A5,CYP3A5*3 突变可以引起CYP3A 酶活性下降,增加药物毒性,在临床药物治疗中应适当减少药物的用量等。因此,从基因表型的定位确定疾病相关基因为切入点,可以诠释体质与疾病易感性及药物反应性的相关机制。一方面,不同基因型的人对药物剂量的耐受能力不同;另一方面,不同基因型的人对药物种类的反应性、耐受性、选择性也有所不同。
通过对随机20 个社区高血压人群进行基因多态性检测研究发现,影响酶代谢活性的基因有CYP3A5/CYP2C9/CYP2D6,影响药物敏感性基因ADRB1/ACEI(I/D)/AGTR1/NPPA,各个基因型不同突变类型分布均存在明显差异。根据研究对象不同基因位点对不同药物代谢酶活性的影响、代谢敏感性等,制订个体化用药方案,比较发现不同时间点收缩压、舒张压变化情况,CYP3A5 GG 基因组、ADRB1 GC、CC 基因组、ACEI(I/D)I/D、I/I 基因组、CYP2C9 AA 基因组、AGTR1 AA 基因组、NPPA TT 基因组、CYP2D6 CT、TT 基因组的收缩压、舒张压均明显降低。结果表明,根据个体基因型差异,确定药物剂量和选择药物种类,辨体用药、精准施治能够达到更好的降压效果。
现阶段,高血压常用的5 大类降压药物均可作为初始治疗用药,建议根据特殊人群的类型、合并症选择针对性的药物进行个体化治疗。应根据血压水平和心血管风险选择初始单药或联合治疗,老年人及高龄老年人初始治疗时通常应采用较小的有效治疗剂量,根据需要可逐渐增加至足剂量[11-14]。现有多种高血压药物,最常用药有硝苯地平、缬沙坦、美托洛尔等。不同人由于基因组、蛋白组、酶代谢、表观遗传等不同,对药物代谢水平不尽相同。使用基因指导针对不同高血压患者个体,精确地制订最佳的高血压诊疗方案值得探讨与尝试。
高血压Hcy 水平高显著增加了心、脑血管事件危险及其协同作用的致病性。目前认为高血压和血浆Hcy 升高在脑卒中发病上具有明显的协同作用[15]。《中国高血压防治指南2018年修订版》也指出,高Hcy 血症与脑卒中风险呈正相关[5,16-18],强调同时控制高血压和高Hcy 可能是有效降低我国脑卒中高发的一个有效途径。
近年研究发现维生素D 缺乏和高血压的发病有关。MARTINS 等[19]对美国第三次全国健康与营养调查(NHANES Ⅲ)数据分析,FORMAN 等[20]、SCRAGG等[21]研究均证明维生素D 与高血压密切相关,且维生素D 水平低者有较高的高血压患病风险。维生素D 缺乏是缺血性卒中患者产生氯吡格雷耐药性的独立危险因素[22]。维生素D 缺乏在中国非常普遍,研究显示中国中老年人群维生素D 缺乏和不足的发生率分别为69.2%和24.4%[23-24]。查阅文献,社区人群进行维生素D 与叶酸协同干预高血压的研究较少,考虑社区人群普遍存在维生素D 缺乏现状,也普遍缺乏对H 型高血压危害的认识,尝试服用降压药物的同时,观察补充维生素D与叶酸的降压效果。在本研究中,研究初期开始治疗的同时进行了维生素与叶酸的补充,结果发现M3血压明显改善,与M0血压水平相比显著降低,效果明显。在研究过程中未出现脑卒中、心肌梗死等因高血压导致的各种心脑血管并发症患者。
本研究方案将慢性病医院就诊项目落地于社区卫生所,更利于了解慢病真实状况,更贴近疾病发生、发展的监控状态。本研究将高血压的高危因素、药物靶向基因型检测和维生素D 血药浓度、叶酸一同作为一套诊疗方案,系统化的调查高血压的基本情况,研究发现补充维生素D 与叶酸,能够协同显著降低血压水平,按照研究对象的不同基因位点对不同药物代谢酶活性的影响、代谢敏感性等,制订个体化用药方案,均能显著降低血压水平,减少脑卒中、心肌梗死等危重症的心脑血管并发症的发生。本研究为随机抽取的20 个社区进行的探讨,下一步将尝试利用社区慢病管理大数据平台,甚至与全市、全省区域大数据平台,真正切实地从社区到医院,从群体习惯用药到个体化精准给药,进行全市、全省全面开展高血压医防融合工作,为今后高血压疾病的治疗和控制提供有效的治疗途径和给药方式。
作者贡献:庞爱梅负责文献查阅、文章构思设计与可行性分析并撰写论文;高伟负责数据分析工作,并提供技术指导;张恒、蒲双双进行论文的数据整理;郭莉莉负责论文数据、图标的核对;范子荣、刘海霞负责数据收集与整理;刘瑞霞负责文章的质量控制及审校,并对文章整体负责及监督管理。
本文无利益冲突。

