甘草预防气管插管致呼吸道损伤的有效成分筛选
张杰,丁声双,郭敏,薛阳,徐紫清,侯怀晶,薛建军*
1.730050 甘肃省兰州市,甘肃省中医院麻醉科
2.730050 甘肃省兰州市,甘肃省中西医结合麻醉临床研究中心
3.730000 甘肃省兰州市,甘肃中医药大学第一临床医学院
4.730050 甘肃省兰州市,甘肃省中医院
气管插管术是全身麻醉过程中最重要、最安全的呼吸支持方式。但由于其属于侵入性操作,可引起多种并发症。术后咽喉痛(POST)是全身麻醉后常见的轻微但令人不快的术后并发症之一,发病率高达62%[1]。POST 会使患者术后的不适感增加、住院时间延长,严重影响了患者满意度和术后恢复质量[2-3]。随着全身麻醉气管插管手术患者日趋增多和加速康复外科(ERAS)的快速发展,POST 的防治受到广大麻醉医师的关注。最近一项网状Meta 分析[4]比较了6 种外用药物预防气管插管POST 的疗效,结果发现利多卡因并不是预防POST 的最佳外用药物,建议根据临床经验和患者的喜好选择甘草甜素、皮质类固醇、非甾体抗炎药或N-甲基-D-门冬氨酸(NMDA)受体拮抗剂用于减轻POST。目前,针对POST 的干预措施多以术前预防为主,具有一定的缓解作用,但POST发生率仍然较高[5]。因此,寻找具有疗效确切且不良反应小的临床干预方法已成为研究热点。
甘草来源于豆科植物甘草、胀果甘草或光果甘草的干燥根和根茎[6],主要包括三萜皂苷类化合物、黄酮类化合物和多糖类化合物等[7],具有抗炎、免疫调节、抗氧化等多种功效[8],是临床常用中药之一。本课题组前期研究[9]发现甘草喷剂能明显减轻大鼠气管黏膜水肿渗出和炎性细胞浸润,降低大鼠气管插管后血清促炎因子肿瘤坏死因子(TNF)-α、白介素(IL)-1 的表达水平。此外,通过临床研究发现甘草喷雾剂可减轻全身麻醉气管插管应激反应和POST 的发生率[10],同时基于循证医学的证据显示甘草制剂局部应用能有效预防气管插管后的咽喉痛[11],但目前尚无针对甘草具体有效成分防治插管后气道损伤或POST 的研究。因此,本研究通过建立全身麻醉气管插管大鼠模型,筛选甘草预防气管插管致呼吸道损伤的有效成分,从中医药角度为防治全身麻醉气管插管致呼吸道损伤提供新思路。
1 资料与方法
1.1 实验动物
SPF 级Wistar 大鼠60 只,6~8 周龄,雌雄各半,体质量(200±20)g,购于甘肃中医药大学实验动物中心(合格证号62001000000591)。所有动物操作获得甘肃中医药大学动物实验伦理委员会审查(伦理审批编号:2020-233),并根据国际疼痛研究协会的动物实验指南进行。
1.2 实验仪器与试剂
DH-140 型小动物呼吸机(深圳市瑞沃德生命科技有限公司),高速冷冻离心机(5424R,德国Eppendorf),病理切片机(RM2016,德国徕卡),组织摊片机(KD-P,郑州博邦仪器有限公司),显微拍照系统(ICX41,宁波舜宇光学科技有限公司),酶标仪(ELX800,美国Bio Rad 公司)。
异氟醚购自深圳市瑞沃德生命科技有限公司,丙二醛(MDA)、总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)试剂盒购于南京建成科技有限公司,TNF-α、IL-2、IL-4、IL-10、皮质醇(Cor)、肾上腺素(E)和去甲肾上腺素(NE)试剂盒购于江苏酶免实业有限公司。
1.3 甘草提取物的制备
甘草购于甘肃数字本草检验中心有限公司,并经该公司鉴定为甘草根和茎。将甘草饮片粉碎,过60 目筛;称取甘草粉末三份,每份约10.0 g,加水200 mL,超声提取1 h,离心(3 000 r/min,5 min),取上清液,醇沉(80%乙醇、9 h),离心,取上清液,水浴浓缩至约50 mL,得总多糖(TP);加75%乙醇200 mL,超声提取1 h,过滤,滤液用AB-8 大孔吸附树脂纯化,80%乙醇洗脱,洗脱液浓缩至约50 mL,得总黄酮;加75%乙醇200 mL,回流提取90 min,过滤,滤液用HPD-300 大孔吸附树脂纯化,50%乙醇洗脱,洗脱液浓缩至约50 mL,得总皂苷。
1.4 研究方法
1.4.1 动物分组及处理:本研究于2021年4月—2022年7月进行。将60 只SPF 级Wistar 大鼠按随机数字表法分为6 组:对照组、气管插管组、利多卡因组、总多糖组、总皂苷组、总黄酮组,每组10 只。除对照组外,其余五组采用1%戊巴比妥钠麻醉,制备气管插管模型。插管前各治疗组按1 mL/100 g(按体质量计)分别经口喷入1%利多卡因、总多糖、总皂苷、总黄酮,浸润软腭及悬雍垂周围组织。对照组和气管插管组经口喷入等体积0.9%氯化钠溶液。
1.4.2 参照文献[8]制备气管插管大鼠模型。模型制备:将大鼠用1%戊巴比妥钠溶液(50 mg/kg)腹腔注射麻醉后,3~5 min 后大鼠意识消失,全身肌肉松弛。将麻醉后的大鼠仰卧固定于手术板上,把固定的大鼠同手术台一起倾斜约45°(大鼠头朝上),用手术钳将大鼠舌头小心拉出口腔,左手持大鼠喉镜,右手持自制气管导管(16G 血管穿刺针),趁大鼠吸气时声门打开瞬间将自制气管导管插入气道,用棉签确认气管导管的位置,然后连接呼吸机。参数设置:频率80 次/min,潮气量5~10 mL,吸呼比为1∶1.5。麻醉维持:持续吸入1.3%异氟醚,机械通气期间观察大鼠状态,包括大鼠胸廓起伏频率与程度、口唇黏膜是否红润、有无异动等,若发现异常,及时检查呼吸回路。麻醉苏醒:机械通气2 h后停止异氟醚吸入,待大鼠完全清醒后拔除气管导管,将其放回鼠笼待解剖。
1.4.3 苏木精-伊红(HE)染色:气管导管拔除2 h 后,在1%戊巴比妥钠深麻醉(80 mg/kg)状态下,采集大鼠咽部黏膜组织,用4%多聚甲醛固定,观察病理。将标本脱水,石蜡包埋,制作5 μm 厚切片,用HE 染色,并采用宁波舜宇ICX41 显微镜拍照系统进行观察、拍照。
1.4.4 酶联免疫吸附(ELISA)测定:拔除气管导管2 h后,在1%戊巴比妥钠深麻醉(80 mg/kg)状态下,从腹主动脉采集血液样本,在3 500 r/min 条件下离心10 min,收集血清并保存在-80 ℃冰箱备用。按照ELISA 试剂盒说明书检测炎性因子(TNF-α、IL-2、IL-4、IL-10)、氧化应激指标(MDA、T-AOC、SOD)及应激激素(Cor、E、NE)水平。
1.4.5 免疫组化检测Toll 样受体2(TLR2)和Toll 样受体4(TLR4)表达水平:将制备好的咽部黏膜组织石蜡切片用二甲苯脱蜡,然后依次加入高至低浓度乙醇使组织再水化,加入抗原修复液,然后用3% H2O2消除过氧化物酶,然后用牛血清密封。经一抗和二抗孵育后,进行脱蜡洗涤,抗原修复,加入DAB 显色,脱水密封后使用显微拍照系统观察和拍照。通过Image-Pro Plus 6.0软件计算各视野TLR2 和TLR4 平均光密度值(AOD),以AOD=IOD/Area(即intDen/Area)表示。
1.5 统计分析
采用SPSS 22.0 软件(IBM 公司,阿蒙克市,美国)进行统计分析,使用GraphPad Prism 9.0 软件作图。计量数据以(±s)表示。当方差齐检验没有呈现出显著性(α=0.05)时,采用单因素方差分析和Tukey 事后检验来评估多重比较。反之,采用Dunnett's T3 进行组间分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 甘草不同成分对大鼠咽部黏膜组织病理变化的影响
对照组黏膜层和黏膜下层结构完整,细胞形态结构正常,未见炎性细胞浸润现象。气管插管组可见黏膜脱落,黏膜下结构严重破坏并伴有大量炎性细胞浸润。与气管插管组相比,利多卡因组黏膜层及黏膜下层结构破坏较轻,可见大量炎性细胞浸润;总多糖组和总黄酮组黏膜及黏膜下层结构相对完整,炎性细胞浸润相对减少;总皂苷组黏膜及黏膜下层结构基本完整,细胞形态接近正常,可见散在的炎性细胞,见图1。

图1 6 组大鼠咽部黏膜病理变化(HE 染色,×200)Figure 1 Pathological changes of pharyngeal mucosa among 6 groups
2.2 甘草不同成分对大鼠血清炎性因子的影响
6 组大鼠血清炎性因子TNF-α、IL-2、IL-4、IL-10 水平比较,差异有统计学意义(P<0.05)。与对照组相比,气管插管组大鼠血清中的TNF-α、IL-2 水平升高,IL-4、IL-10 水平降低,差异有统计学意义(P<0.05)。与气管插管组相比,总多糖组IL-4 水平升高,总皂苷组大鼠血清TNF-α 和IL-2 水平下降,IL-4 和IL-10 水平升高,差异有统计学意义(P<0.05);利多卡因组和总黄酮组大鼠血清TNF-α 水平低于气管插管组,差异有统计学意义(P<0.05),见表1。
表1 6 组大鼠血清炎性因子的比较(±s)Table 1 Comparison of serum inflammatory factors among 6 groups
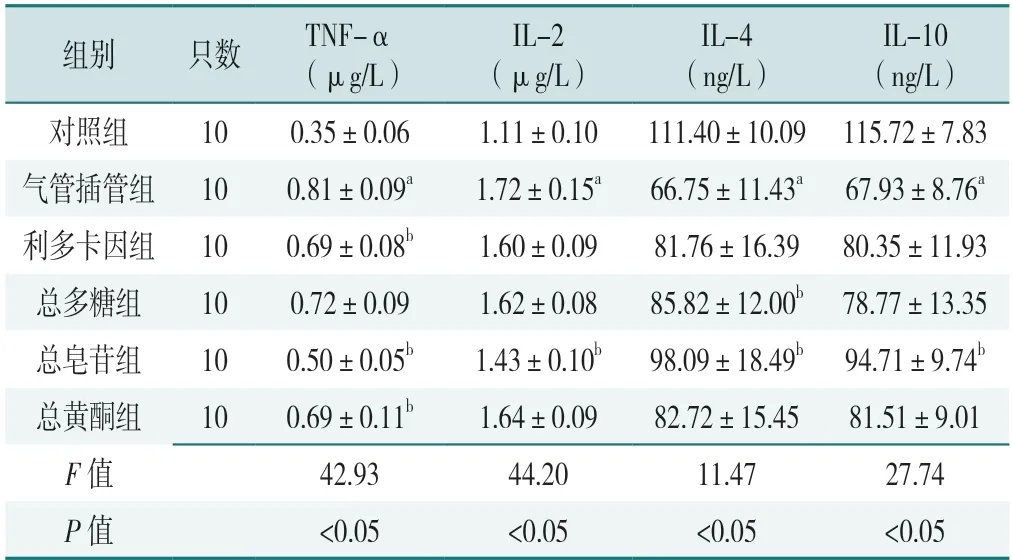
表1 6 组大鼠血清炎性因子的比较(±s)Table 1 Comparison of serum inflammatory factors among 6 groups
注:TNF-α=肿瘤坏死因子α,IL=白介素;a 表示与对照组比较P<0.05,b 表示与气管插管组比较P<0.05。
IL-10(ng/L)对照组100.35±0.061.11±0.10111.40±10.09 115.72±7.83气管插管组100.81±0.09a1.72±0.15a66.75±11.43a 67.93±8.76a利多卡因组100.69±0.08b1.60±0.0981.76±16.39 80.35±11.93总多糖组100.72±0.091.62±0.0885.82±12.00b 78.77±13.35总皂苷组100.50±0.05b1.43±0.10b98.09±18.49b 94.71±9.74b总黄酮组100.69±0.11b1.64±0.0982.72±15.4581.51±9.01 F 值42.9344.2011.4727.74 P 值<0.05<0.05<0.05<0.05组别只数TNF-α(μg/L)IL-2(μg/L)IL-4(ng/L)
2.3 甘草不同成分对氧化应激的影响
6 组大鼠血清氧化应激指标MDA、SOD、T-AOC水平比较,差异有统计学意义(P<0.05)。与对照组相比,气管插管组大鼠血清中的MDA水平升高,SOD和T-AOC水平下降,差异有统计学意义(P<0.05)。利多卡因组和总多糖组大鼠血清MDA、SOD、T-AOC 水平与气管插管组比较,差异无统计学意义(P>0.05)。与气管插管组相比,总皂苷组和总黄酮组大鼠血清MDA 水平下降,SOD 和T-AOC 水平升高,差异有统计学意义(P<0.05),见表2。
表2 6 组大鼠血清氧化应激水平的比较(±s)Table 2 Comparison of serum oxidative stress level among 6 groups
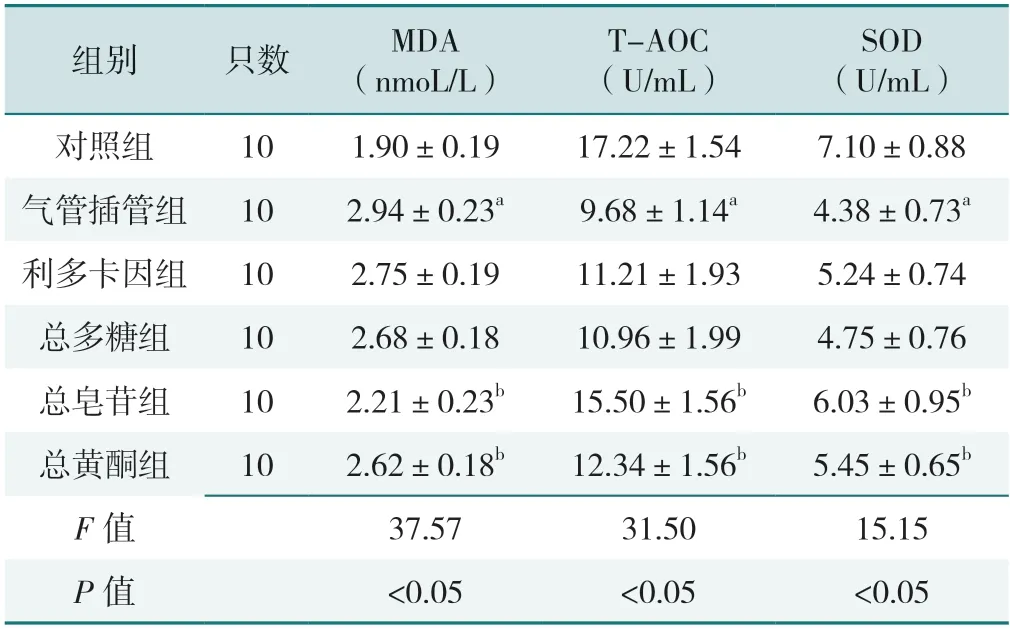
表2 6 组大鼠血清氧化应激水平的比较(±s)Table 2 Comparison of serum oxidative stress level among 6 groups
注:MDA=丙二醛,T-AOC=总抗氧化能力,SOD=超氧化物歧化酶;a 表示与对照组比较P<0.05,b 表示与气管插管组比较P<0.05。
SOD(U/mL)对照组101.90±0.1917.22±1.547.10±0.88气管插管组102.94±0.23a9.68±1.14a4.38±0.73a利多卡因组102.75±0.1911.21±1.935.24±0.74总多糖组102.68±0.1810.96±1.994.75±0.76总皂苷组102.21±0.23b15.50±1.56b6.03±0.95b总黄酮组102.62±0.18b12.34±1.56b5.45±0.65b F 值37.5731.5015.15 P 值<0.05<0.05<0.05组别只数MDA(nmoL/L)T-AOC(U/mL)
2.4 甘草不同成分对应激激素水平的影响
6 组大鼠血清应激激素Cor、E、NE 水平比较,差异有统计学意义(P<0.05)。气管插管组大鼠血清Cor、E 和NE 水平高于对照组,差异有统计学意义(P<0.05)。利多卡因组和总皂苷组大鼠血清中Cor、E 和NE 水平低于气管插管组,差异有统计学意义(P<0.05)。总多糖组和总黄酮组大鼠血清Cor、E 和NE 水平与气管插管组比较,差异无统计学意义(P>0.05),见表3。
表3 6 组大鼠血清应激激素水平的比较(±s)Table 3 Comparison of serum stress hormone level among 6 groups

表3 6 组大鼠血清应激激素水平的比较(±s)Table 3 Comparison of serum stress hormone level among 6 groups
注:Cor=皮质醇,NE=去甲肾上腺素,E=肾上腺素;a 表示与对照组比较P<0.05,b 表示与气管插管组比较P<0.05。
组别只数 Cor(μg/mL)NE(ng/L)E(pg/mL)对照组10100.28±7.80 140.66±13.01 135.97±11.52气管插管组 10 157.40±11.11a 206.16±18.84 a 201.53±10.40 a利多卡因组 10141.11±8.04b 187.01±13.36b 187.93±11.98b总多糖组10 145.33±17.77 192.14±8.97 192.98±9.19总皂苷组10 130.15±10.06b 164.54±14.09b 162.10±5.92b总黄酮组10143.70±8.67 192.48±16.28 190.42±6.77 F 值31.4227.1615.15 P 值<0.05<0.05<0.05
2.5 甘草不同成分对TLR2 和TLR4 表达的影响
6 组大鼠咽部黏膜组织TLR2、TLR4 蛋白表达水平比较,差异有统计学意义(P<0.05)。气管插管组TLR2 和TLR4 表达的AOD 高于对照组,差异有统计学意义(P<0.05)。利多卡因组、总多糖组、总皂苷组和总黄酮组大鼠咽部组织TLR2 表达的AOD 与气管插管组相比,差异无统计学意义(P>0.05)。总皂苷组大鼠咽部组织TLR4 表达的AOD 明显低于气管插管组(P<0.05),而利多卡因组、总多糖组和总黄酮组大鼠咽部组织TLR4 表达的AOD 与气管插管组相比,差异无统计学意义(P>0.05),见图2、表4。

图2 6 组大鼠咽部组织TLR2 和TLR4 表达免疫组化染色图(×200)Figure 2 Immunohistochemical staining of TLR2 and TLR4 expression in pharyngeal tissues among 6 groups
表4 6 组大鼠咽部组织TLR2、TLR4 蛋白表达AOD 比较(±s)Table 4 Comparison of AOD expressed by TLR2 and TLR4 protein in the pharyngeal tissues among 6 groups

表4 6 组大鼠咽部组织TLR2、TLR4 蛋白表达AOD 比较(±s)Table 4 Comparison of AOD expressed by TLR2 and TLR4 protein in the pharyngeal tissues among 6 groups
注:TLR2=Toll 样受体2,TLR4=Toll 样受体4;a 表示与对照组比较P<0.05,b 表示与气管插管组比较P<0.05。
组别只数TLR2TLR4对照组60.048±0.005 0.049±0.010气管插管组60.093±0.017a 0.081±0.009a利多卡因组60.084±0.012 0.075±0.004总多糖组60.090±0.013 0.074±0.007总皂苷组60.084±0.010 0.056±0.006b总黄酮组60.086±0.010 0.071±0.011 F 值11.4913.95 P 值<0.05<0.05
3 讨论
在接受全身麻醉的患者中,气管内插管对于保持气道通畅至关重要,在临床上应用广泛,其侵入性操作带来的机械刺激易引起咽喉部黏膜屏障破坏,诱发机体出现炎性反应、应激反应等,从而引起咽喉部疼痛及咳嗽等呼吸道并发症。虽然可以通过选择直径较小的气管导管,使用适当的气管导管套囊压力[12],静脉注射或局部应用利多卡因[13],包括利多卡因碱化气管导管套囊,以及类固醇等抗炎药[4]降低POST 的发生率,但上述措施均不令人满意。此外,喉镜的放置通常伴有严重的交感神经刺激,这对心血管疾病患者极为危险。目前已经设计了许多技术来减少围术期应激反应发生的可能性,例如对喉黏膜进行局部麻醉、静脉给予局部麻醉药、短效阿片类药物或β 肾上腺素能拮抗剂[14]。然而,这些方法无法有效抑制应激反应。近年来,中医药技术广泛应用于气管插管呼吸道并发症的防治。现代药理学研究表明,甘草具有补脾益气、清热解毒、抗炎、抗氧化、调节免疫等药理作用[15-18],广泛应用于呼吸系统疾病。
以往研究表明,气管导管与人或猪的气管黏膜接触导致机械性损伤,表现为咽喉痛(人)、气管炎、中性粒细胞活化[19-21],同时弹性蛋白酶、活性氧(ROS)、IL-1β、TNF-α 和细胞间黏附分子1 表达增加[21]。甘草的抗炎活性及其在炎症性疾病中的应用自古以来就有记载[22]。有学者认为甘草的抗炎作用主要由皂苷类和黄酮类化合物介导[23],甘草中的三萜皂苷类化合物是其具有特异性标志的成分,其中甘草酸和甘草次酸是甘草根的主要成分[23],二者在药理学上表现出相似的特征。KAGEYAMA 等[24]认为甘草酸的抗炎作用与糖皮质激素和盐皮质激素相似。黄酮类化合物是甘草中仅次于三萜皂苷类的第二大化合物。甘草类黄酮显示出良好的抗炎作用,在肺炎、肝炎、溃疡性结肠炎、胃炎和其他炎症性疾病中显示出治疗效果[25]。本研究发现气管插管组大鼠咽部黏膜脱落,黏膜下层结构破坏严重并伴有大量炎性细胞浸润,血清中促炎因子TNF-α 和IL-2 水平显著升高,抗炎因子IL-4 和IL-10 水平降低。总皂苷组大鼠咽部黏膜及黏膜下层结构破坏减轻,炎性细胞浸润减少。大鼠血清中促炎因子TNF-α 和IL-2水平下降,抗炎因子IL-4 和IL-10 水平升高。这些结果提示总皂苷对气管插管引起的气道损伤和炎性反应有一定的抑制作用,这一结果与梁曦等[9]研究结果一致。
甘草的抗氧化活性是其广泛使用的主要原因之一。三萜皂苷类化合物甘草酸的抗辐射、神经保护、抑制线粒体通透性变化、防止缺血再灌注损伤及缓解肝损伤等多种活性与其清除自由基、对抗氧化应激的作用密切相关[23]。有学者将甘草的抗氧化活性归因于黄酮类化合物[26]。MDA 是一种能间接反映机体ROS 代谢状态和对组织的氧化损伤程度的脂质过氧化反应的中间产物[27],也是机体发生氧化应激的重要标志;SOD 作为抗氧化剂,能减少ROS 在体内的积聚,减少MDA 的产生[28],从而减轻氧化应激损伤;T-AOC 可反映机体内总体的抗氧化水平[29]。本研究发现:气管插管组大鼠血清中MDA 水平明显增加,SOD 和T-AOC 水平明显下降。给予甘草提取物预处理后,发现总皂苷组和总黄酮组MDA 水平降低,SOD 和T-AOC 水平升高,表明总皂苷和总黄酮对气管插管引起的氧化应激损伤均有一定的抑制作用,这一研究结果与王军等[30]研究一致。
气管插管等应激反应促使交感-肾上腺髓质和下丘脑-垂体-肾上腺皮质轴兴奋为主的一系列神经内分泌反应,促使机体儿茶酚胺和糖皮质激素分泌增加[31]。因此,血浆中Cor、E 和NE 浓度能够评估应激反应的程度。杨开银等[10]通过临床研究发现甘草喷雾剂能降低气管拔管后24 h 内血清E 和NE 水平。本研究发现利多卡因组和总皂苷组大鼠血清中Cor、E 和NE 水平较气管插管组显著降低,表明甘草抑制气管插管时的应激反应可能与总皂苷相关。
TLR 是参与非特异性反应的蛋白分子[32],TLR 有多重亚型,其中TLR4 被认为是无菌炎症的主要介质[33],促进炎性因子的合成和释放是其主要的生物学功能。有研究表明,促炎介质HMGB1 在细胞外与TLR 结合,进而激活核因子(NF)-κB 通路,诱导氧化应激反应,加剧炎性因子释放[34],从而介导组织伤过程。本研究结果发现,气管插管组TLR2 和TLR4 表达的AOD 高于对照组,表明气管插管诱导的气道损伤可以激活TLR2和TLR4 蛋白表达。总皂苷组大鼠咽部组织TLR4 表达的AOD 明显低于气管插管组,提示TLR4 在甘草预防全身麻醉气管插管所致的呼吸道损伤中发挥重要作用。
综上,本研究通过观察甘草不同成分对大鼠气管插管模型咽部组织病理形态学、炎性因子、氧化应激、应激激素和TLR 等相关指标的影响,分别考察甘草不同成分对气管插管引起的气道损伤的作用。结果表明总皂苷成分可通过减轻炎性反应、氧化应激和抑制TLR4 表达改善气管插管大鼠呼吸道损伤,故初步确定甘草预防全身麻醉气管插管呼吸道损伤的有效成分为总皂苷。
作者贡献:张杰和薛建军构思并设计了实验,指导研究实施与修改稿件;张杰、丁声双、郭敏、薛阳负责实验实施和血清学指标检测;张杰和郭敏撰写论文初稿。丁声双和徐紫清进行HE 染色和免疫组化;丁声双和侯怀晶统计分析数据;所有作者审阅并批准了最终稿件。
本文无利益冲突。

