羊口蹄疫病毒·羊口疮病毒和山羊痘病毒多重PCR检测方法的建立及应用
潘 永,杨 莉,李 婷,莫本田,李 刚,赵 滨,唐远江,杨粤黔,孙启跃,徐景峨
(贵州省农业科学院畜牧兽医研究所,贵州贵阳 550005)
近年来,在贵州省大力推动羊产业高质量发展的背景下,羊存栏数截至2022年3月已突破390万只。随着养殖业的发展,养殖规模不断扩大,疾病防控压力也日益增大,特别是羊病毒性疾病,因其传播快,致死率高,对羊养殖业发展构成严重威胁。羊口蹄疫、羊口疮和山羊痘是分别由口蹄疫病毒、羊口疮病毒和山羊痘病毒引发的疫病,引种、免疫失败、新变异病毒株是感染上述病毒的常见因素[1-3]。由于3种疾病在临床上有类似的特征,加之混合感染存在,给临床诊断造成困难。因此,快速鉴别诊断对防控上述3种羊病具有重要意义。
口蹄疫(foot-and-mouth disease,FMD)、羊口疮(Contagious ecthyma,CE)和山羊痘(Goat pox,GTP)疫病在临床上存在类似症状。口蹄疫是由口蹄疫病毒(foot-and-mouth disease virus,FMDV)引起的一种急性、热性、高度接触性传染病,俗称“口疮”。家养或野生偶蹄动物为该病毒的易感动物,临床表现为唇、舌面、内面、齿龈、脸颊部黏膜、四肢下端和乳房处等无毛部位形成水疱,水疱破溃后形成红色溃烂,严重时蹄壳脱落,导致动物跛行[4]。羊口疮是由羊口疮病毒(Orf virus,ORFV)引起的一种接触性、嗜上皮性传染病,可通过接触传播。山羊、绵羊、鹿科及骆驼科等其他反刍类动物为该病的易感动物,临床表现为口、舌、唇、乳房和鼻镜等皮肤部位形成脓疱、水泡和结痂[5]。山羊痘是由山羊痘病毒(Goat pox virus,GTPV)引起的羊的一种急性、热性、接触性传染病,临床表现为发热、结膜炎、鼻炎、过度流涎、皮肤黏膜发生疱疹和丘疹病变[6]。随着养羊业的迅速发展,羊病的种类也开始增多且难以控制。另外,还存在多种病毒混合感染的现象,如颜新敏等[7]报道我国存在GTPV、ORFV及山羊传染性胸膜肺炎混合感染羊的病例。
通过文献查新发现,目前尚缺乏同时针对FMDV、ORFV和GTPV的快速检测方法。鉴于传统检测方法在检测混合感染病例时费时费力且容易误诊,现急需建立一种同时针对FMDV、ORFV和GTPV的快速鉴别诊断方法。笔者旨在利用PCR技术,建立可同时检测FMDV、ORFV和GTPV的多重PCR方法,以期为未来流行病学调查和疾病防控奠定基础。
1 材料与方法
1.1 试验材料研究所涉及的ORFV、GTPV、FMDV疫苗株、蓝舌病灭活病毒和小反刍兽疫病毒疫苗株、魏氏梭菌、羊结核杆菌和山羊支原体样品均由实验室保存。临床样品包括132份抗凝血和8份已鉴定的羊口疮阳性痂皮组织,于2021年12月至2022年11月采集自贵州地区各规模化养羊场。
1.2 主要试剂和仪器设备核酸提取试剂盒DNA/RNA Extraction Kit、胶回收试剂盒FastPure® Gel DNA Extraction Mini Kit、质粒提取试剂盒RapidLyse Plasmid Mini Kit、反转录试剂盒HiScript® II 1st Strand cDNA Synthesis Kit、DNA聚合酶混合物2 × AceTaqMaster Mix(Dye Plus)、基因克隆载体ClonExpress MultiS One Step Cloning Kit和DH5α 化学感受态细胞均为诺维赞产品;DL2000 DNA Marker为天根公司产品;PCR仪为BIO-RAD产品;凝胶电泳仪为北京六一公司产品。
1.3 引物设计下载NCBI中已上传的不同血清型FMDV全基因序列、ORFV全基因序列和GTPV全基因序列,利用clustlW软件对同一病毒不同血清型基因序列进行多序列比对,在保守性高的区域设计引物并由生工生物工程股份有限公司合成。引物信息及预扩增目的片段大小见表1。

表1 引物序列Table 1 Information of primer sequences used
1.4 核酸提取病毒样品和待检临床样品核酸的提取均使用DNA/RNA提取试剂盒,DNA样品保存于-20 ℃,RNA样品随即进行反转录,所获cDNA产物于-20 ℃保存,剩余RNA 于-80 ℃保存。
1.5 目的片段的扩增及克隆分别以FMDV、ORFV和 GTPV病毒样品DNA/cDNA为模板,利用合成的引物进行PCR扩增。反应体系为2 × AceTaqMaster Mix 12.5 μL,上下游引物(10 μmol/L)各1.0 μL,DNA/cDNA模板2.0 μL,最后ddH2O补足至25 μL。反应程序为95 ℃ 5 min;95 ℃ 10 s,56 ℃ 30 s,72 ℃ 40 s,共30个循环;72 ℃ 8 min。产物经2%琼脂糖凝胶电泳后进行胶回收并纯化。参照诺维赞ClonExpress MultiS One Step Cloning Kit试剂盒方法分别将回收产物与载体连接,转化至DH5α 化学感受态细胞,挑取重组子进行测序验证。将阳性重组质粒分别命名为pFMDV、pORFV和pGTPV,测定各质粒浓度并计算拷贝数。
1.6 多重PCR反应条件的优化以重组质粒pFMDV、pORFV和pGTPV为模板,对反应体系中的模板和引物用量以及反应程序中的退火温度进行优化,以ddH2O作为阴性对照模板,通过观察琼脂糖凝胶电泳结果,确定多重PCR的最佳反应体系和条件。
1.7 特异性试验在已提取获得DNA/cDNA模板的基础上,ddH2O作为阴性对照模板,pFMDV、pORFV和pGTPV质粒作为阳性对照,利用优化后的多重PCR方法分别对蓝舌病病毒、小反刍兽疫病毒、魏氏梭菌、羊结核杆菌和山羊支原体进行检测,以判断该方法的特异性。
1.8 敏感性试验将pFMDV、pORFV和pGTPV质粒稀释至同一拷贝数量级并等比例混合,以10倍梯度稀释混合物并作为模板,检测多重PCR方法的最低检测限,ddH2O作为阴性对照模板。
1.9 重复性试验将pFMDV、pORFV、pGTPV混合物等比例混合并作为模板,通过多重PCR反应方法检测重复性,重复试验3次。分别将FMDV疫苗株、ORFV和GTPV病原分离物混合后匀浆,提取总RNA和总DNA,总RNA随即反转录为cDNA,以cDNA和总DNA混合物为模板,通过多重PCR反应方法检测重复性,重复试验3次。
1.10 临床样品的检测所检测临床样品包括采集的132份抗凝血、8份阳性羊口疮痂皮病料按照100 μL病毒细胞培养上清和200 μL阴性全血混合分别制备3份ORFV模拟样品和1份GTPV模拟样品,将FMDV疫苗株10倍稀释后与200 μL阴性全血混合制备1份FMDV模拟样品,将3种病毒液等量混合后取100 μL和200 μL阴性全血制备2份混合型模拟样品。提取样品核酸用该试验建立的多重PCR与常规PCR方法进行检测。
2 结果与分析
2.1 FMDV、ORFV、GTPV三重PCR反应建立与优化通过对引物和模板用量以及退火温度的优化,确定了该多重PCR最佳反应体系为2 × AceTaqMaster Mix 12.5 μL,FMDV上下游引物终浓度200 nmol/L,ORFV引物上下游引物终浓度400 nmol/L,GTPV上下游引物终浓度200 nmol/L,质粒、cDNA/DNA模板均为1.5 μL,ddH2O补足至25 μL。
为明确多重PCR最佳反应程序,在最佳反应体系确定的基础上,对退火温度进行梯度优化处理,琼脂糖凝胶电泳以及测序结果显示,54~58 ℃均可同时扩增出3条大小正确的目的条带,当退火温度为57 ℃时,目的片段产量较高、引物二聚体较少(图1)。结果表明,57 ℃可作为反应程序的最佳退火温度,PCR最佳反应程序为95 ℃ 5 min;95 ℃ 10 s,57 ℃ 30 s,72 ℃ 40 s,共30个循环;72 ℃ 8 min。
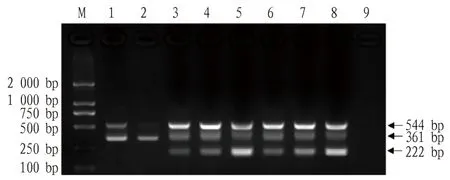
注:M.DL 2 000 DNA 相对分子质量标准;1.53.0 ℃;2.53.3 ℃;3.54.0 ℃;4.54.9 ℃;5.56.1 ℃;6.57.0 ℃;7.57.6 ℃;8.58.0 ℃;9.阴性对照。Note:M.DL 2 000 DNA marker;1.53.0 ℃;2.53.3 ℃;3.54.0 ℃;4.54.9 ℃;5.56.1 ℃;6.57.0 ℃;7.57.6 ℃;8.58.0 ℃;9.Negative control.图1 多重PCR退火温度优化Fig.1 Optimization of multiplex PCR annealing temperature
利用优化后的多重PCR反应体系及条件检测质粒pFMDV、pORFV和pGTPV单一或等比例混合模板,以模拟7种阳性检测结果。琼脂糖凝胶电泳以及测序结果显示,该法检测单一或混合质粒模板,目的条带类型及大小均与预期相符(图2)。结果表明,该法可正确检测出FMDV、ORFV和GTPV的单一或混合感染。
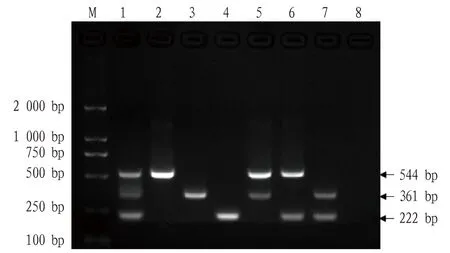
注:M.DL 2 000 DNA 相对分子质量标准;1.pFMDV、pORFV、pGTPV混合;2.pFMDV;3.pORFV;4.pGTPV;5.pFMDV、pORFV混合;6.pFMDV、pGTPV混合;7.pORFV、pGTPV混合;8.阴性对照。Note:M.DL 2 000 DNA marker;1.Mixtures of pFMDV,pORFV and pGTPV;2.pFMDV;3.pORFV;4.pGTPV;5.Mixtures of pFMDV and pORFV;6.Mixtures of pFMDV and pGTPV;7.Mixtures of pORFV and pGTPV;8.Negative control.图2 单一或混合质粒模板的多重PCR检测Fig.2 Multiplex PCR detection of single or mixed plasmid templates
2.2 特异性试验通过建立的多重PCR方法检测5种非FMDV、ORFV和GTPV羊源病原体,以检验该法的特异性。结果显示,与pFMDV、pORFV和pGTPV作为模板的阳性对照相比,5种羊源病原体无预扩增条带(图3)。结果表明,利用该法检测FMDV、ORFV和GTPV,特异性较好。

注:M.DL 2 000 DNA 相对分子质量标准;1.pFMDV、pORFV、pGTPV混合;2.pFMDV;3.pORFV;4.pGTPV;5.蓝舌病病毒;6.小反刍兽疫病毒;7.魏氏梭菌;8.羊结核杆菌;9.山羊支原体;10.阴性对照。Note:M.DL 2 000 DNA Marker;1.pFMDV,pORFV,pGTPV mixed;2.pFMDV;3.pORFV;4.pGTPV;5.BTV;6.PPRV;7.Clostridium weisseri;8.M.tuberculosis;9.Mycoplasma capricolum;10.Negative control.图3 多重PCR检测不同羊常见病原的特异性试验Fig.3 Multiplex PCR detection of common pathogens in different sheep
2.3 敏感性试验为检测多重PCR方法对模板的最低检测限,对pFMDV、pORFV和pGTPV不同数量级拷贝数模板进行多重PCR扩增(图4)。结果显示,当pFMDV和pGTPV数量级为103~108拷贝/μL,pORFV数量级为104~108拷贝/μL时均可扩增出与预期大小相符的目的条带。结果表明,该法对pFMDV和pGTPV最低检测数量级为103拷贝/μL,对pORFV则为104拷贝/μL。

注:M.DL 2 000 DNA 相对分子质量标准;1~8分别为108~101拷贝/μL的pFMDV、pORFV、pGTPV混合物;9.阴性对照。Note:M.DL 2 000 DNA Marker;1-8.The pFMDV,pORFV and pGTPV mixtures are available at concentrations of 108-101 copies per microliter;9.Negative control.图4 多重PCR敏感性试验Fig.4 Susceptibility test for multiplex PCR
2.4 重复性试验通过对重组质粒的混合物以及FMDV疫苗株、ORFV和GTPV病原混合物进行多重PCR检测,检验该法的重复性(图5)。琼脂糖凝胶电泳以及测序结果显示,该法对重组质粒混合物或FMDV疫苗株、ORFV和GTPV阳性组织样品混合物的3次试验,均能扩增出与预期大小相符的目的条带。结果表明,该法具有较好的重复性。

注:M.DL 2 000 DNA 相对分子质量标准; 1~3.pFMDV、pORFV、pGTPV混合物(1∶1∶1);4~6.FMDV疫苗株、ORFV和GTPV混合核酸提取物;7.阴性对照。Note:M.DL 2 000 DNA Marker;1-3.Mixtures of pFMDV,pORFV and pGTPV(1∶1∶1);4-6.FMDV vaccine strain and nucleic acid mixtures of ORFV and GTPV;7.Negative control.图5 多重PCR重复性试验Fig.5 Reproducibility of multiplex PCR
2.5 临床样品检测应用常规PCR和建立的多重PCR方法对132份全血样品、7份全血模拟样品和8份阳性羊口疮痂皮组织进行检测,结果显示,多重PCR方法检出全血样品ORFV 感染病例1例,检出模拟样品FMDV 3份、ORFV5份、GTPV3份以及FMDV、ORFV 和GTPV的混合全血模拟样品2份,检出组织样品ORFV 感染8份。与常规PCR检查结果符合率为100%(表2)。
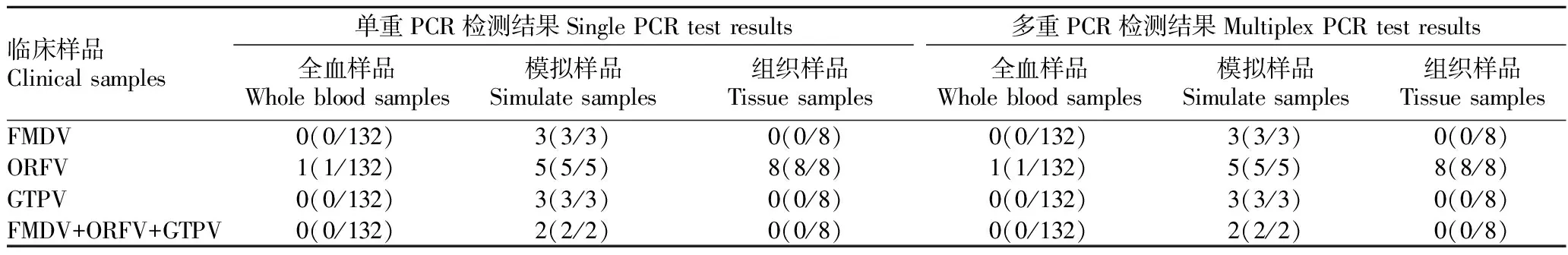
表2 临床样品的检测结果Table 2 Test results of clinical samples
3 讨论
多重 PCR(Multiplex polymerase chain reaction,MPCR)是指通过一次反应可同时扩增出2个或以上的靶基因,因其低成本、高效率、高通量而被广泛应用。该技术目前在疾病诊断和科学研究等领域应用较多。
多重PCR相较于常规PCR有诸多优势,同时也存在着一些不足。该研究在对多重PCR敏感性检测时发现,对FMDV和GTPV的最低检测限达到103数量级的拷贝,而对ORFV需要104,通过总结前人建立的多重PCR方法发现,仅有少数建立的多重PCR检测限能达到102数量级拷贝[8-9]。该研究在检测临床样品时,全血样品仅检出1例ORFV感染,检出率较低,但不能排除血液样本病毒载量低,致使核酸模板未达到该多重PCR方法的最低检测限的可能。而使用该方法检测羊口疮阳性病料,检出率为100%。上述结果提示,使用该研究建立的多重PCR检测ORFV、ORFV和GTPV时,病料的采集应尽可能取病毒载量较高的痂皮、水疱皮、水疱液和丘疹。若病原体难以培养,RNA或DNA提取率较低,如支原体、衣原体等病原,则需利用敏感性更高,检测限可至100数量级的科学工具[10-11]。勾倩倩等[12]建立了一种针对蓝舌病病毒、小反刍兽疫病毒、ORFV和GTPV的基于TaqMan探针技术的多重荧光定量PCR方法,在检测病原时具有较好的特异性,并且对4种病原的最低检出量分别达到17、12、8和9 拷贝/μL。随着科学技术的不断进步,基于荧光染料、荧光探针、微流控和于固相载体的多重荧光定量PCR技术将成为未来核酸多重检测的重要研究方向,在疾病检测方面扮演着重要角色[13-17]。
秦敏等[18]曾建立了蓝舌病、FMDV、小反刍兽疫和水泡性口炎的多重PCR检测方法,何亚鹏等[19]建立了涉及FMDV、蓝舌病、小反刍兽疫的多重RT-PCR方法,在临床应用上都有着较好的效果。因羊痘在西北地区较为流行,何亚鹏等[20]建立了针对绵羊痘病毒、GTPV及ORFV的多重PCR检测方法。尽管前人有关多重PCR的研究均涉及FMDV、ORFV和GTPV,但尚缺乏针对FMDV、ORFV以及GTPV病原进行系统多重PCR检测方法研究的相关报道。而该研究通过多项试验验证,建立了一种可同时检测FMDV、ORFV和GTPV的多重PCR方法,为这3种病毒的快速诊断和流行病学调查等研究提供技术支持。
4 结论
该研究建立了可同时检测FMDV、ORFV和GTPV的多重PCR方法,该方法具有较高的敏感性和特异性,可用于羊病的流行病学调查、鉴别诊断和疫情防控。

