耐盐反硝化菌属富集培养研究
杨宏 吴文元 赵广泽
(北京工业大学城市建设学部 北京 100124)
0 引言
高盐对生物脱氮技术有着很大的影响,反硝化细菌作为细胞结构本身会受到渗透压的影响,而且高盐会抑制细菌的正常生长代谢,导致细菌脱氮能力降低甚至消失。在现有的工业生产中,像皮革生产、化肥制造、垃圾填埋、采油等行业产生的废水为高盐废水[1],用一般的活性污泥法进行处理时,细菌活性必然会受到抑制。DINCER 等[2]研究了盐度对反硝化脱氮的影响,发现NaCl 浓度从0 提升至60 g/L 时,NO3--N 的去除率下降为原来的30%,可见盐度对反硝化速率影响较大。反硝化细菌不是某一种细菌,而是具有反硝化能力的细菌集合。目前所知的反硝化细菌大约有50 多个属,130 多个种[3],其中也包括一部分嗜盐菌,这部分反硝化菌可以在相对较高的盐度下高效地发挥反硝化作用。有研究表明盐单包菌(Halomonas)因产生渗透压补偿溶质而具有适应高盐环境的能力,是中度嗜盐菌的典型菌属[4]。那么如何富集培养耐盐反硝化细菌成为本次讨论的重点。
本研究以实验室初期筛选污泥为接种污泥,采用SBR 培养方式,探究污泥富集培养过程中污泥浓度、污泥量、反硝化速率等的变化规律,并结合高通量测序技术探究富集培养过程中菌群结构的变化,最终找出培养方案的不足并提出改进措施,以寻求高效可行的污泥培养方案。
1 材料与方法
1.1 接种污泥
污泥最初取自北京某污水处理厂回流污泥,经过1 个月左右的筛选培养,污泥的菌群结构发生了较大变化,其中反硝化菌属以固氮弓菌属(Azoarcus)为主,占比21.28%,Halomonas(12.4%)次之。本实验将该污泥作为接种污泥。
1.2 实验原水
实验中发酵罐的体积为3 000 L,容积较大,故采用高浓度低流量进药的方式。为了延长配药周期,配制接近饱和的硝酸盐原水,将碳氮比控制为3.3 左右,并加入微量元素[8],以达到最佳的富集培养效果。具体配比见表1。
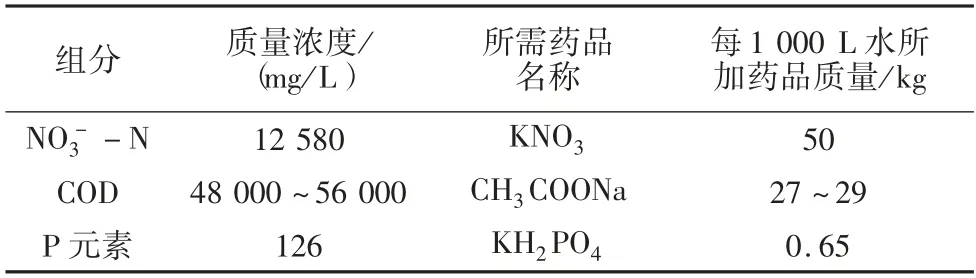
表1 实验原水营养盐配比
1.3 反应装置
发酵罐实验室反应装置示意图见图1。
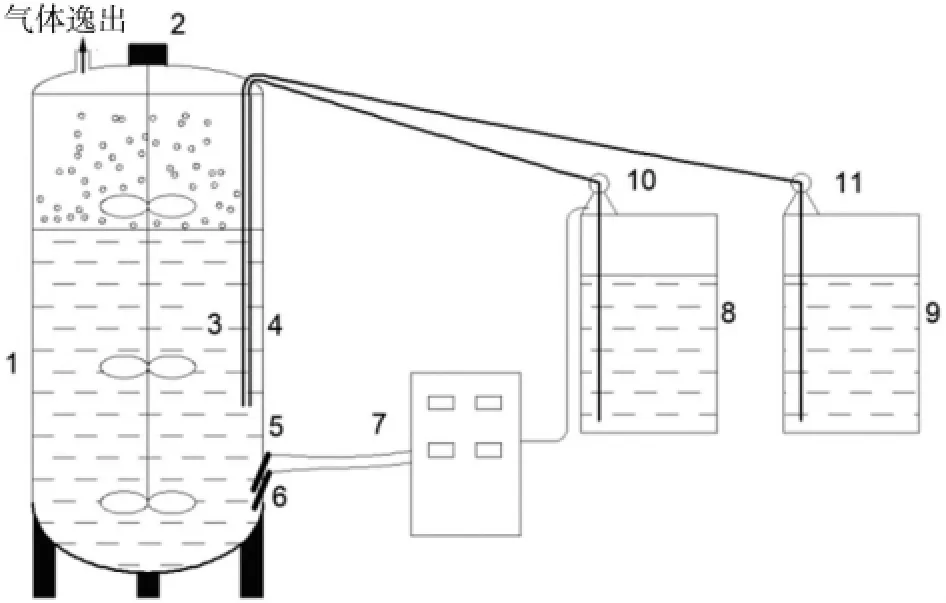
图1 发酵罐装置图
如图1 所示,污泥富集培养的主体装置为3 000 L 的发酵罐,并设有pH、温度在线监测仪表,搅拌装置,水浴加热装置等。通过PCL 自控设备控制发酵罐内pH 为8.0~8.5 之间,温度控制在25~30 ℃之间。设有悬浮标尺用以计算发酵罐内混合液体积。罐体下端设有取泥口,中间部分设有取样口,便于监测污泥的增长状态。
1.4 运行工况
反硝化细菌的培养采用SBR 运行方式,分为反应、静置、排水、进水4 个阶段。搅拌强度视污泥浓度而定,一般设为13~20 r/min。
(1)反应:根据上阶段的反硝化效率,确定本阶段的进药流量;运行时硝酸盐的积累量维持在20~30 mg/(L·h)。
(2)静置:根据反应速率和硝酸盐、亚硝酸盐的积累量,确定搅拌停止时间,再静置30~60 min,待上清液清澈后,便可排水。
(3)排水:排水过程中为了防止污泥的流失,用潜水泵将上清液抽走。要避免水流搅动导致污泥浮动,确定污泥不流失的最低排水液面。
(4)进水:将事先配制好的高浓度硝酸盐原水以流加的方式加入发酵罐,通过计量泵调节进水流量,使之与反硝化速率匹配。
1.5 分析项目及检测方法
实验过程中涉及到检测指标包括:NO2--N、NO3--N、COD、混合液悬浮固体浓度(MLSS)、挥发性有机物浓度(MLVSS)、pH 和温度等,均采用标准监测方法进行测定[5]。样品处理前每个水样都经过0.45 μm 滤膜的预处理,避免水样中游离细菌及固体悬浮物的影响。为保证检测真实有效,每个水样均保证一式三份进行检测。此外,采用16S rRNA 高通量测序技术对反硝化污泥中微生物菌群的多样性及菌群结构进行分析[6],以探究反硝化菌群结构的适应性变化。
2 结果与讨论
2.1 富集培养过程中污泥的增长情况分析
如图2 所示为反硝化污泥稳定富集培养阶段的相关数据,污泥培养采用SBR 模式周期运行,图中1~4 d(Ⅰ),5~8 d(Ⅱ),10~13 d(Ⅲ),14~17 d(Ⅳ),18~21 d(Ⅴ),22~24 d(Ⅵ)分别对应1 个运行周期。结合相关数据,就污泥浓度、MLSS、MLVSS 进行如下分析。
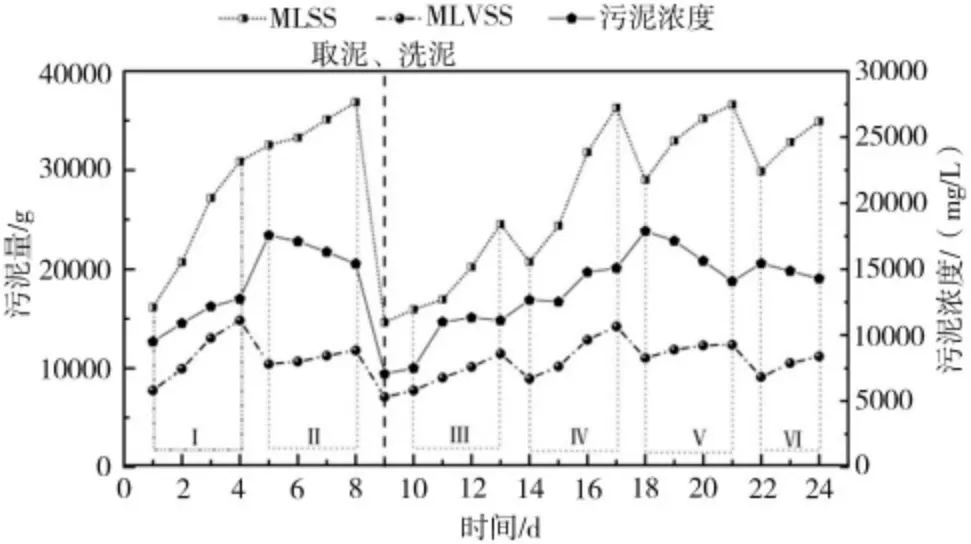
图2 富集培养过程中MLSS、MLVSS 污泥浓度的变化情况
2.1.1 污泥浓度分析
如图2 所示,在Ⅰ、Ⅲ、Ⅳ3 个运行周期中,污泥浓度逐渐增大。需要说明的是,图中的污泥浓度数值为不同体积下的实测值,说明在这3 个阶段运行过程中,污泥增长迅速。对比Ⅱ、Ⅴ、Ⅵ3 个周期,污泥浓度在周期内呈现下降趋势。不同的是Ⅰ、Ⅲ、Ⅳ周期污泥浓度的基数相对较低,为7 000~14 000 mg/L之间,说明这个浓度范围内更有利于污泥的增长。当污泥基数>15 000 mg/L 时,污泥的比增长速率降低了。该结论与张鑫等[7]、何海超等[8]的研究结果相符。导致这种现象的原因可能是由于菌群密度较大,限制了污泥的生长。一方面,在高菌群密度情况下,反硝化速率较高,代谢产物分泌旺盛,再加上SBR 运行模式会导致代谢产物的大量积累,代谢产物中存在有害物质,限制了细菌的增长;另一方面,菌群之间会存在竞争生长,造成了环境容量限制。
2.1.2 MLSS 相关分析
有关MLSS 分析从两方面展开,首先是运行周期内MLSS的变化。由图2 中MLSS 增长曲线可以看出,在Ⅱ、Ⅴ、Ⅵ3 个周期中曲线的变化大致相同,整体呈现增长趋势但是斜率越来越小,说明污泥的增长速率减慢,说明当污泥浓度>15 000 mg/L时不利于污泥增长。而在Ⅰ、Ⅲ、Ⅳ3 个周期中,MLSS 不仅整体呈现上升趋势而且斜率也有所上升。如图2 所示,在第2、12、15 天对应的斜率较大,此时的污泥比增长速率最大,这3 d对应的污泥浓度均在11 000~13 000 mg/L 之间,这与2.1.1 小节关于污泥比增长速率的分析存在交集,最终确定污泥比增长速率的最大值在12 000 mg/L 左右。其次是周期间的分析,在第14、18、22 天均存在MLSS 减少的情况,这是由于排水阶段有污泥损失,第14 天减少MLSS 大约为4 000 g,第18、22 天减少量约为6 000 g,说明污泥浓度越大,污泥损失量越大。造成该现象的原因一方面是由于污泥浓度较大,可以允许排水的最低液位没有及时做出调整,导致排水过程中泥面受到水力搅动,部分污泥随之排出;另一方面,发酵罐中如果存在硝酸盐的积累,会在静置沉淀过程中反应,再加上发酵罐中盐度较大,细菌多以絮体的形式存在[9],液体较为浑浊黏稠,产生的气体不易从絮体表面脱落,致使絮体密度降低,污泥上浮,导致细菌流失。
2.1.3 MLVSS 相关分析
实验过程中对MLVSS 进行检测,以此来反映污泥中有机物占比,间接反映出菌量。如图2 所示,每个时间点对应的MLSS-MLVSS 为无机物的量。令A=MLSS-MLVSS,在每个运行周期内,A 值都呈现增大趋势,产生这个现象的原因是运行过程中存在盐度积累。由于发酵罐容积较大,采用高浓度进水的方式,进水中除了一些有用的营养盐被细菌消耗掉之外,还有一些其他离子,如钠离子、钾离子等,这些离子会在发酵液中积累,因此盐度每个周期内都会增加。第9 天时取泥,并对罐中污泥进行清洗,降低盐度,所以第10 天时A 值较小,伴随反应的进行A 值增大,对应的盐度也越来越高。赵凯峰等[9]表明,污泥容积指数(SVI)随着盐度的升高而降低,与本实验所得结论一致。6 个周期间,每个周期MLVSS 的量几乎一致,也就是说在这6 个周期,虽然持续进药,但MLVSS 没有升高。这主要是由于SBR 运行模式下,细菌损失造成的。
2.2 反硝化速率的变化规律
污泥培养驯化阶段硝化速率变化曲线见图3。
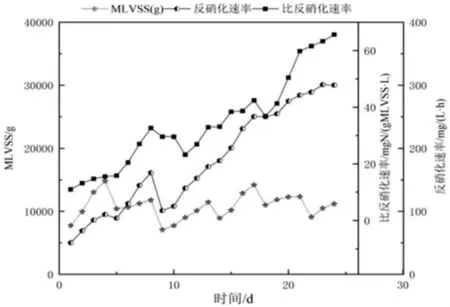
图3 污泥培养驯化阶段反硝化速率变化曲线
如图3 所示,污泥的反硝化速率呈现稳定的上升趋势,第24 天时,反硝化速率达到300 mg/(L·h)。在第9 天时,反硝化速率有一个明显的降低,一方面是取泥导致污泥量减少,从而使得整体反硝化速率降低;另一方面是由于洗泥造成的,自来水水温较低并且水中含有少量余氯,会使得反硝化细菌活性受到抑制。结合比反硝化速率来看,倘若只是污泥减少导致的反硝化速率降低,那么比反硝化速率不会降低,然而实际比反硝化速率降低了,说明是两者综合作用的结果。实验中比反硝化速率是以MLVSS 为基础计算出来的,比反硝化速率呈现稳步上升的趋势,最高可达到65 mg N/(g MLVSS·h),结合高通量测序可知是由于菌群结构发生了较大变化,优势菌群为盐单胞菌(Halomonas),占比57.79%,该菌可以在较高的盐度下高效地发挥反硝化作用。
2.3 微生物群落多样性分析
2.3.1 菌群多样性分析
培养前后样本菌群结构多样性变化见表2。
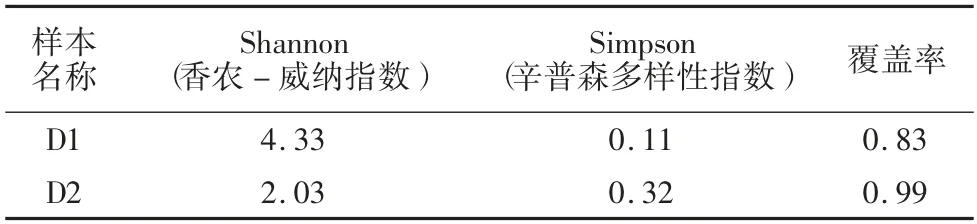
表2 培养前后样本菌群结构多样性变化
实验过程中,为探究培养过程中污泥菌群结构的变化,进行了高通量跟踪测定,第1 天与第24 天进行取样,分别命名为D1、D2。如表2 所示,D1 的Shannon 指数为4.33,大于D2的Shannon 指数,并且D1 的Simpson 指数低于D2 Simpson 指数,说明D1 的多样性大于D2,也就是说运行24 d 后,菌群多样性降低了。这主要是由于富集培养过程中条件(温度、pH、底物类型等)单一,只有某几种微生物在适宜的环境下生长,其他更多的微生物受到限制,从而降低了菌群多样性。
2.3.2 优势菌群结构分析
D1、D2 样本微生物菌群结构(门水平)见图4,D1、D2 样本中微生物种类及占比情况(属水平)见图5。
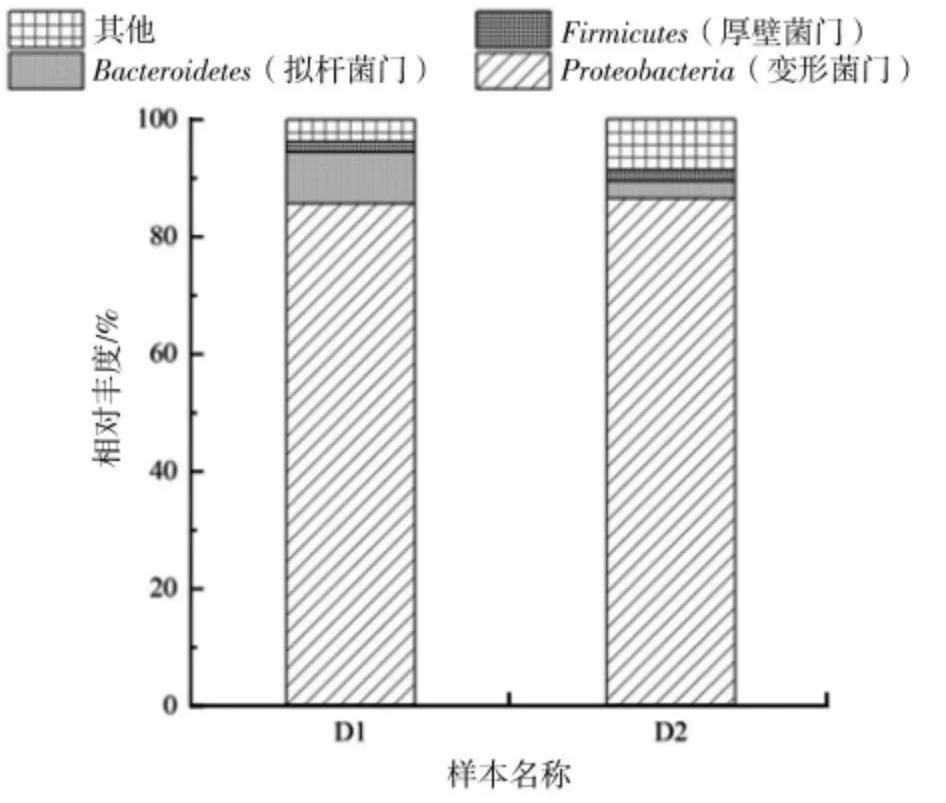
图4 D1、D2 样本微生物菌群结构(门水平)
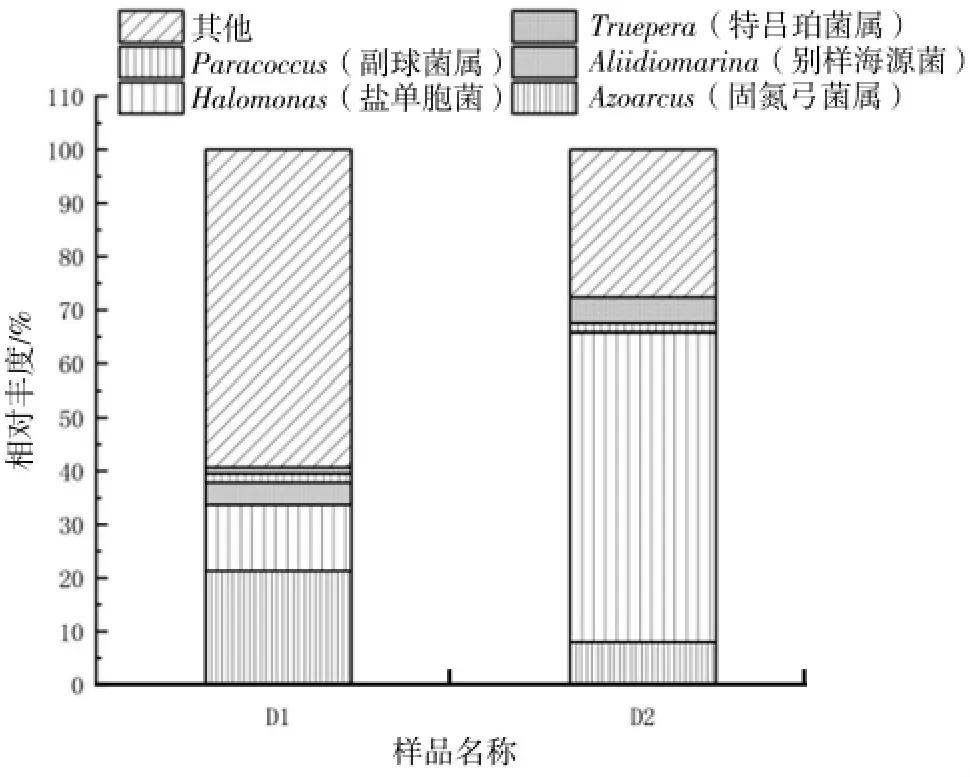
图5 D1、D2 样本中微生物种类及占比情况(属水平)
如图4 所示,在门水平上,D1、D2 样本没有较大差异,都以Proteobacteria 为主,在D1、D2 样本中分别占比85.7%、86.58%,LIAO 等[10]称大多数的反硝化细菌属于Proteobacteria菌门。其他菌门占比较低,应该是由于单一环境下,其他菌门细菌的生长受到限制。
如图5 所示,在属水平上,D1 的反硝化菌属以Azoarcus(21.28%)为主,Halomonas(12.4%)次之,经过了24 d 的富集培养后,D2 的Halomonas 样本占比57.79%,Azoarcus 占比降至7.95%。有报道称Halomonas 菌属可以在高盐环境中进行高效的反硝化作用,并且对于亚硝酸盐具有很强的耐受能力和还原能力[11-13]。物竞天择,适者生存,对于微生物而言亦是如此。可见该培养模式下,可以富集培养高效的耐盐反硝化细菌。
3 结论
(1)当污泥浓度超过15 000 mg/L 时,污泥的增长速率会下降。要想实现污泥的连续生产培养,污泥浓度应控制在12 000 mg/L 左右,以获得最大的污泥增长率。
(2)高浓度进药的培养方式会导致盐度积累,导致污泥容积指数(SVI)降低,无机组分含量升高。
(3)SBR 运行模式会存在污泥流失的风险,在培养过程中应注意把握好污泥沉降性、沉淀时间和允许排水最低液面三者之间的关系。
(4)富集培养过程中反硝化速率增长较快,比效率最高可达到65 mg N/(g MLVSS·h),并且菌群结构在培养过程中因盐度积累发生变化,形成了以Halomonas 为主的耐盐反硝化污泥。

