Ki-67联合p16检测对HPV持续高危阳性患者子宫颈高级别鳞状上皮内病变的诊断价值*
陈园 李忠敏 矫静
子宫颈鳞癌是全球范围内第二高发妇科肿瘤,发病率仅次于乳腺癌,全球每年有9%左右女性癌症人群死于该病[1-2]。从子宫颈癌前病变发展到子宫颈鳞癌需10~20 年时间,高危型人乳头状瘤病毒(HR-HPV)长期持续感染可导致癌前病变,进而恶化为子宫颈鳞癌[3]。因此早期准确诊断子宫颈鳞癌及癌前病变,早日开展对症治疗措施对改善子宫颈病变患者预后意义重大。目前临床诊断子宫颈病变的方法主要有HR-HPV 测定、液基薄层细胞学检测,此类诊断手段对设备、技术要求颇高,临床普及有限[4-5]。细胞周期蛋白激酶的抑制因子16(p16)为细胞周期蛋白激酶的抑制因子,其水平表达与子宫颈肿瘤的发生有关。原癌基因细胞增殖核抗原(Ki-67)有利于维持细胞增殖活性[4-6]。为了进一步探讨、验证高危型HPV 感染与细胞周期蛋白表达的关系,本研究选取新余市人民医院2017 年12 月—2020 年11 月收治的慢性子宫颈炎患者开展对照试验,详情如下。
1 资料与方法
1.1 一般资料
纳入标准:(1)均为慢性子宫颈炎[7];(2)年龄>18 岁;(3)术前未接受任何形式治疗;(4)临床资料完整。排除标准:(1)伴有其他部位恶性肿瘤、阴道炎;(2)重要脏器功能不全;(3)伴有免疫缺陷性疾病、传染性疾病、性病;(4)哺乳期或妊娠期。回顾性选取新余市人民医院2017 年12 月—2020 年11 月收治的慢性子宫颈炎患者134 例、子宫颈低级别鳞状上皮内病变131 例、子宫颈高级别鳞状上皮内病变129 例、HPV 持续高危阳性患者118 例,分别记为对照1 组、对照2 组、对照3 组、研究组。研究经过医院医学伦理委员会批准。
1.2 方法
检测方法:一般情况下TCT 检查结果提示子宫颈高级别鳞状上皮内病变时,检查阴道镜活检。
Ki-67 与p16 测定方法:采取免疫组化法检测四组患者组织中Ki-67、p16 表达情况,子宫颈组织标本石蜡包埋、切片,灭活、微波抗原修复、洗涤,添加鼠抗人Ki-67 单克隆抗体、p16 抗体(美国Abcam 公司),复染、脱水、封片。染色程度为无色(0 分)、淡黄色(1 分)、黄色(2 分)、棕黄色(3 分),分别记为0、1、2、3 分,计算染色程度与染色范围评分(0 分:无染色或非常弱的染色,即标记物没有在组织中出现;1 分:弱染色,在组织中仅有轻微的标记物染色;2 分:中等染色,标记物呈现中等程度的强度和范围;3 分:强染色,标记物呈现较强的染色强度且范围广泛)的乘积,将结果为0 分者记为阴性(-)表达,否则记为阳性(+)表达(1~4 分记为+,5~8 分记为++,>8 分记为+++)。
1.3 观察指标
(1)四组病灶组织Ki-67、p16 蛋白表达情况及阳性率比较。(2)采用列联表法分析各组子宫颈高级别鳞状上皮内病变与病灶组织Ki-67、p16 蛋白表达的关系。(3)Ki-67 联合p16 检测对HPV 持续高危阳性患者子宫颈高级别鳞状上皮内病变的诊断价值。
1.4 统计学处理
采用SPSS 23.0 软件进行统计学分析。计数资料以率(%)表示,比较采用χ2检验,等级资料采用秩和检验;正态分布且方差齐的计量资料表示以(±s),两组间比较采用t 检验,多组间采用方差分析;采用列联表法分析在各组子宫颈高级别鳞状上皮内病变与病灶组织Ki-67、p16 蛋白表达的关系。采用受试者操作特征(ROC)曲线判定Ki-67联合p16 检测对HPV 持续高危阳性患者子宫颈高级别鳞状上皮内病变的诊断效能。P<0.05 为差异有统计学意义。计数资料两两比较需调整检验标准为α',其中α'=α/k×(k-1)/2,α=0.05,k=4。
2 结果
2.1 四组一般资料比较
对照1 组年龄21~71 岁,平均(42.11±4.55)岁,病程3 个月~8 年,平均(3.12±0.41)年;对照2 组年龄21~72 岁,平均(43.58±5.58)岁,30 例行子宫全切术,48 例单纯行LEEP 子宫颈锥形切除术;对照3 组年龄20~75 岁,平均(43.85±5.55)岁,51 例行子宫全切术,78 例单纯行子宫颈锥形切除术;研究组年龄25~71 岁,平均(42.31±4.59)岁。四组年龄差异无统计学意义(P>0.05),具有可比性。
2.2 四组病灶组织Ki-67、p16 蛋白表达情况及阳性率比较
四组病灶组织Ki-67、p16 蛋白表达分布比较差异均有统计学意义(Z=29.852,P<0.001;Z=25.856,P<0.001),研究组病灶组织Ki-67、p16 蛋白表达阳性率均高于其余三组(P<0.01),且对照2 组、对照3 组病灶组织Ki-67、p16 蛋白表达阳性率均高于对照1 组(P<0.01)。见表1、2。
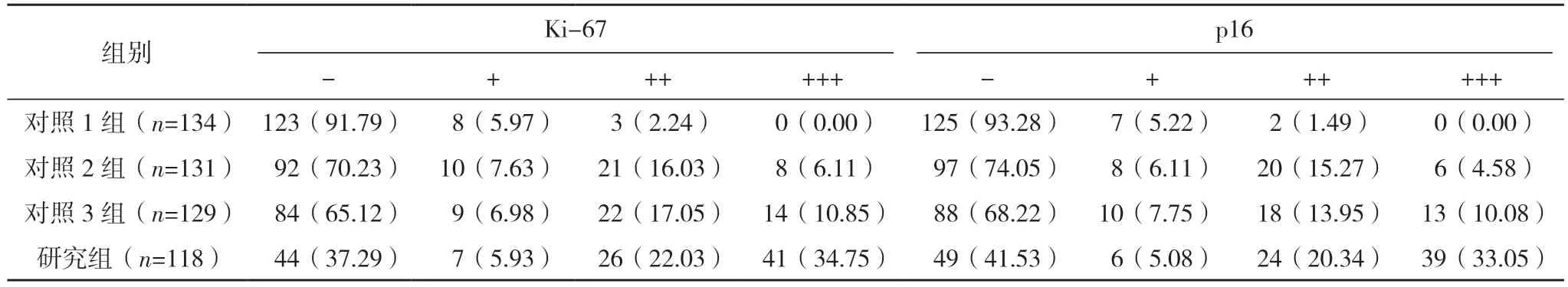
表1 四组病灶组织Ki-67、p16蛋白表达情况对比[例(%)]
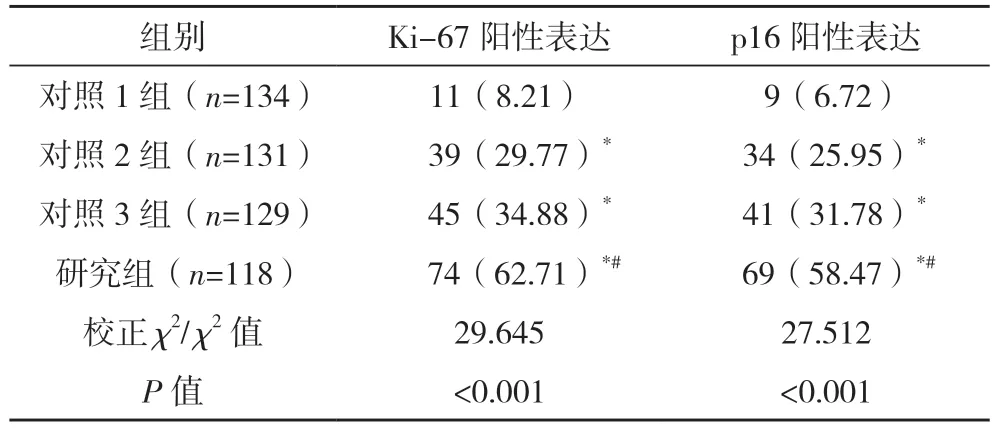
表2 四组病灶组织Ki-67、p16蛋白阳性表达率[例(%)]
2.3 子宫颈高级别鳞状上皮内病变与病灶组织Ki-67、p16 蛋白表达的关系
研究组子宫颈高级别鳞状上皮内病变106 例,子宫颈高级别鳞状上皮内病变与病灶组织Ki-67、p16蛋白表达均呈正相关(C=0.745、0.641,P<0.01),见表3、4。
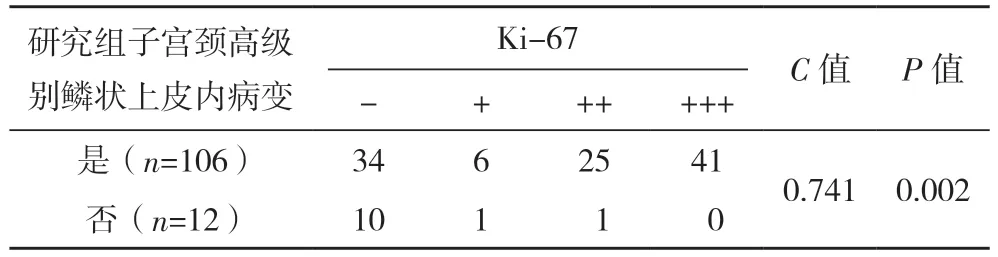
表3 四组子宫颈高级别鳞状上皮内病变与病灶组织Ki-67蛋白表达的关系(例)

表4 四组子宫颈高级别鳞状上皮内病变与病灶组织p16蛋白表达的关系(例)
2.4 Ki-67、p16 诊断子宫颈高级别鳞状上皮内病变的价值
HPV 持续高危阳性患者Ki-67、p16 及联合诊断子宫颈高级别鳞状上皮内病变的敏感度分别为65.40%、69.20%、78.90%,特异度分别为71.70%、73.60%、73.60%,AUC 分别为0.718、0.729、0.816,联合诊断的AUC 值高于Ki-67、p16 单一诊断(Z=6.854,P=0.000;Z=6.741,P=0.000),见表5、图1。
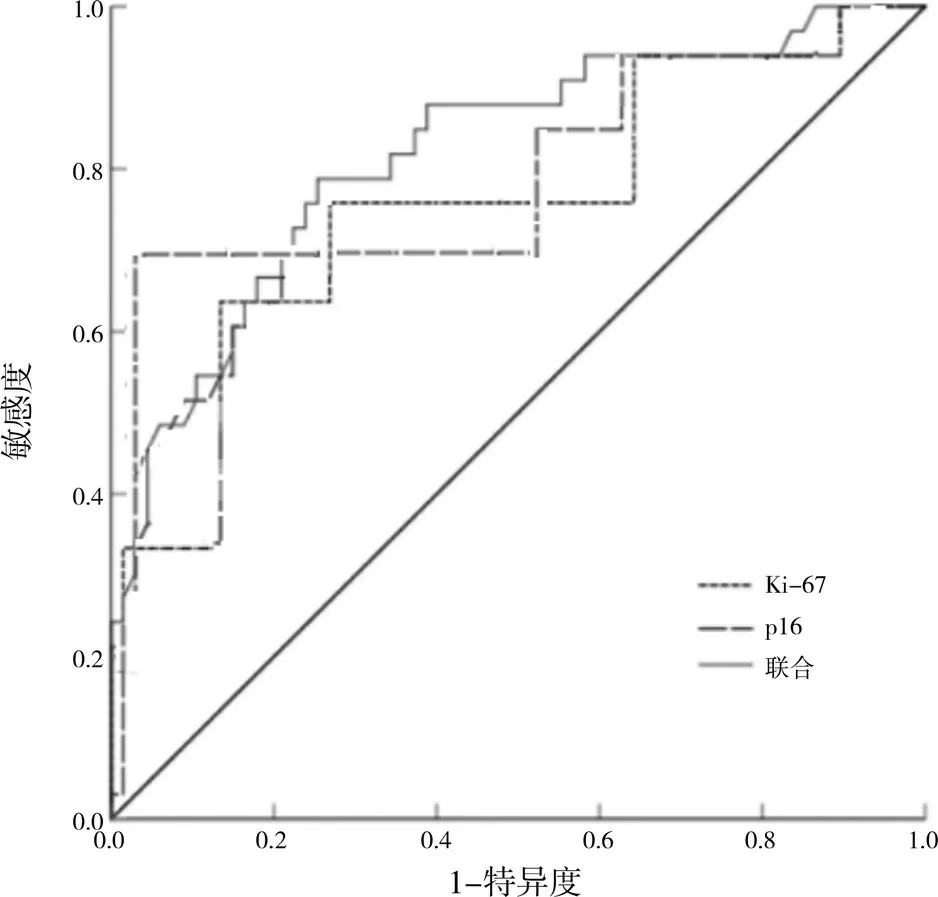
图1 HPV持续高危阳性患者组织标本中Ki-67、p16诊断子宫颈高级别鳞状上皮内病变的ROC曲线

表5 HPV持续高危阳性患者组织标本中Ki-67、p16诊断子宫颈高级别鳞状上皮内病变的价值
3 讨论
不同分型的HPV 往往对子宫颈组织细胞的影响是不同的,发展成HPV 持续高危阳性患者的概率也不同。子宫颈鳞状细胞癌致病因素较多且发病机制复杂[8]。目前临床治疗中通过子宫切除等虽可有效治愈部分患者,但由于对子宫颈鳞状细胞癌的临床诊断多以病理组织活组织检查为金标准,部分患者随着病情迁延,早期确诊及治疗积极性较低,病死率仍居较高水平[9-10]。因此寻找子宫颈鳞状细胞癌诊断的指标,有利于提高临床检出率,降低病理组织活检对患者机体造成的损伤。
本研究发现,四组病灶组织Ki-67、p16 蛋白表达分布比较差异均有统计学意义,研究组病灶组织Ki-67、p16 蛋白表达阳性率均高于其余三组,且对照2 组、对照3 组病灶组织Ki-67、p16 蛋白表达阳性率均高于对照1 组,提示在HPV 持续高危阳性患者中病灶组织Ki-67、p16 蛋白表达阳性率表达偏高。Ki-67 将pRb 磷酸化,从而进一步解除p16 的抑制效应,启动DNA 复制,促进细胞的增殖[11]。p16 作为转录调节因子细胞[12]。有研究证实,在人类的HPV 持续高危阳性患者中均存在Ki-67、p16 的异常表达[13]。
本研究还发现,研究组子宫颈高级别鳞状上皮内病变与病灶组织Ki-67、p16 蛋白表达均呈正相关,ROC 曲线分析结果显示,HPV 持续高危阳性患者Ki-67、p16 及联合诊断子宫颈高级别鳞状上皮内病变的敏感度分别为65.40%、69.20%、78.90%,特异度分别为71.70%、73.60%、73.60%,AUC 分别为0.718、0.729、0.816,联合诊断的AUC 值高于Ki-67、p16 单一诊断,提示子宫颈高级别鳞状上皮内病变与病灶组织Ki-67、p16 蛋白表达均呈正相关,Ki-67 联合p16 检测对HPV 持续高危阳性患者子宫颈高级别鳞状上皮内病变的诊断价值较高。Ki-67 是目前已知的增殖抗原中最具增殖能力代表性,且是应用广泛的细胞增殖标记。有研究指出,高水平的p16 蛋白能增加HPV 持续高危阳性患者转移概率,其机制可能与诱导AP-1 活性的正反馈循环有关[14-15]。本研究与上述相关报道相符,且二者均可表明p16 可发挥促癌或抑癌活性的作用,其异常表达与子宫颈高级别鳞状上皮内病变的发病及进展存在一定关联。
综上所述,子宫颈高级别鳞状上皮内病变与HPV 持续高危阳性患者病灶组织Ki-67、p16 蛋白表达均呈正相关,Ki-67 联合p16 检测对HPV 持续高危阳性患者子宫颈高级别鳞状上皮内病变的诊断价值较高。

