尼妥珠单抗联合同步放化疗治疗鼻咽癌的效果及对血清肿瘤标志物的影响*
钟琼 聂启鸿 吴仁瑞 黄芸
鼻咽癌起源于鼻咽黏膜柱状上皮,在各年龄段人群中均可发病,其作为一种头颈部恶性肿瘤,主要累及患者鼻咽部,随着病情发展,肿瘤病灶可能影响周围组织[1]。临床上多采用同步放化疗治疗该病,放疗射线可破坏肿瘤细胞结构,增加其对化疗药物的摄入[2]。以顺铂为主的化疗药物能够抑制肿瘤细胞DNA 双链形成,干扰肿瘤细胞生长、增殖[3]。但同步放化疗缺乏靶向性,导致其治疗效果有限,患者易出现鼻咽癌复发的情况。尼妥珠单抗具有高度专一性,能够特异性针对肿瘤细胞开展靶向治疗,逆转肿瘤细胞的恶性生物学行为[4]。本研究对92 例鼻咽癌患者进行分析,旨在探讨尼妥珠单抗联合同步放化疗的疗效及对血清肿瘤标志物的影响,详情如下。
1 资料与方法
1.1 一般资料
选取2021 年1 月—2022 年1 月赣州市人民医院收治的92 例鼻咽癌患者。纳入标准:(1)符合文献[5]《中国鼻咽癌分期2017 版(2008 鼻咽癌分期修订专家共识)》中的诊断标准;(2)预计生存周期>6 个月;(3)首次接受放化疗治疗;(4)生命体征相对平稳,可耐受治疗。排除标准:(1)合并其他部位恶性肿瘤;(2)合并重要脏器器质性病变;(3)合并精神异常;(4)对本研究所用药物过敏;(5)存在放疗禁忌证。以随机数字表法分成研究组(n=46)与对照组(n=46)。本研究经本院医学伦理委员会批准,患者知情同意。
1.2 方法
对照组给予同步放化疗治疗,患者取仰卧位,以热塑头颈肩膜固定头颈部,采用螺旋CT 模拟定位机扫描患者头顶至锁骨下3 cm 的范围,根据扫描图像定位靶区,其中低危区(颈部未发生转移的淋巴引流区)给予50~54 Gy/28~30 F 放射剂量,高危区(原发灶、原发灶周围组织、发生转移的淋巴引流区)给予60~66 Gy/30~33 F 放射剂量,肿瘤区(原发灶及转移淋巴结外扩3~5 mm)给 予69.96 Gy/33 F 放射剂量,每周4、5 次,48 d内完成33 次;静脉滴注注射用顺铂(生产厂家:山东罗欣药业集团股份有限公司,批准文号:国药准 字H20046375,规 格:10 mg)40 mg/m2,1 次/周。研究组给予尼妥珠单抗联合同步放化疗(同对照组)治疗,静脉滴注尼妥珠单抗注射液(生产厂家:百泰生物药业有限公司,批准文号:国药准字S20080001,规格:50 mg/瓶)200 mg/次,每次滴注时间控制在1 h 以上,1 次/周。两组均治疗6 周。
1.3 观察指标及评价标准
(1)近期疗效:参照实体瘤临床疗效评价标准(RECIST),病灶全部消失,且维持时间>4 周,判定为完全缓解(CR);病灶缩小≥30%,且维持时间>4 周,判定为部分缓解(PR);病灶缩小<30%,或增大<20%,判定为疾病稳定(SD);病灶增大≥20%,或出现新病灶,判定为疾病进展(PD)[6]。客观缓解率(ORR)=(CR+PR)例数/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)例数/总例数×100%。(2)血清肿瘤标志物:治疗前、治疗6 周后抽取患者空腹静脉血3 mL,离心(转速设置为3 000 r/min,半径设置为10 cm,时间10 min)后取上层清液,测定细胞角蛋白19 片段(CYFRA21-1)、鳞状细胞癌相关抗原(SCCAg)水平(酶联免疫吸附法)。(3)氧化应激指标:治疗前、治疗6 周后抽取患者空腹静脉血3 mL,以2 500 r/min 转速、12.5 cm 半径离心10 min,测定丙二醛(MDA)水平(硫代巴比妥酸法)、一氧化氮(NO)水平(酶联免疫吸附法)、超氧化物歧化酶(SOD)水平(黄嘌呤氧化法)。(4)不良反应:比较两组Ⅰ~Ⅳ级黏膜反应、胃肠道反应、肝肾功能损害、骨髓抑制、放射性皮炎等的发生情况。
1.4 统计学处理
采用SPSS 25.0 统计学软件处理所得数据,计量资料用(±s)描述,组间比较采用独立样本t 检验,组内比较采用配对t 检验,计数资料用率(%)描述,组间比较行χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
研究组男26 例,女20 例,年龄56~77 岁,平均(62.63±4.04)岁,肿瘤分期:Ⅲ期35 例,Ⅳ期11 例,肿瘤类型:鳞状细胞癌33 例,未分化癌13 例;对照组男24 例,女22 例,年龄57~79 岁,平均(63.05±4.39)岁,肿瘤分期:Ⅲ期37 例,Ⅳ期9 例,肿瘤类型:鳞状细胞癌32 例,未分化癌14 例。两组上述一般资料比较差异均无统计学意义(P>0.05),具有可比性。
2.2 两组近期疗效比较
研究组ORR、DCR 均较对照组高,差异均有统计学意义(χ2=5.324、9.144,P=0.021、0.002),见表1。

表1 两组近期疗效比较
2.3 两组血清肿瘤标志物比较
治疗前,两组CYFRA21-1、SCCAg 水平比较差异均无统计学意义(P>0.05),治疗后,两组CYFRA21-1、SCCAg 水平均较治疗前降低,研究组均较对照组低,差异均有统计学意义(P<0.05),见表2。
表2 两组血清肿瘤标志物比较(±s)
*与本组治疗前比较,P<0.05。
组别 CYFRA21-1(μg/L)SCCAg(ng/mL)治疗前 治疗后 治疗前 治疗后研究组(n=46) 22.39±5.62 4.27±1.13* 18.21±4.29 2.23±0.56*对照组(n=46) 22.05±6.43 6.55±2.08* 18.63±4.40 3.52±0.91*t 值 0.270 6.533 0.464 8.188 P 值 0.788 0.000 0.644 0.000
2.4 两组氧化应激指标比较
治疗前,两组MDA、NO、SOD 水平比较差异均无统计学意义(P>0.05),治疗后,两组MDA、NO 水平均较治疗前升高,SOD 水平均降低,但研究组MDA、NO 水平均较对照组低,SOD 水平较对照组高,差异均有统计学意义(P<0.05),见表3。
表3 两组氧化应激指标比较(±s)
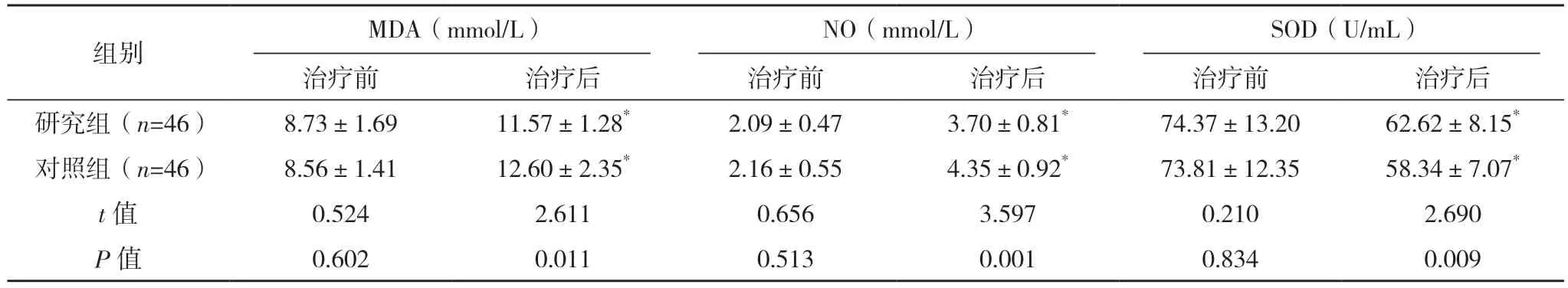
表3 两组氧化应激指标比较(±s)
*与本组治疗前比较,P<0.05。
组别 MDA(mmol/L)NO(mmol/L)SOD(U/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后研究组(n=46) 8.73±1.69 11.57±1.28* 2.09±0.47 3.70±0.81* 74.37±13.20 62.62±8.15*对照组(n=46) 8.56±1.41 12.60±2.35* 2.16±0.55 4.35±0.92* 73.81±12.35 58.34±7.07*t 值 0.524 2.611 0.656 3.597 0.210 2.690 P 值 0.602 0.011 0.513 0.001 0.834 0.009
2.5 两组不良反应发生情况比较
研究组不良反应发生率与对照组比较差异均无统计学意义(P>0.05),见表4。
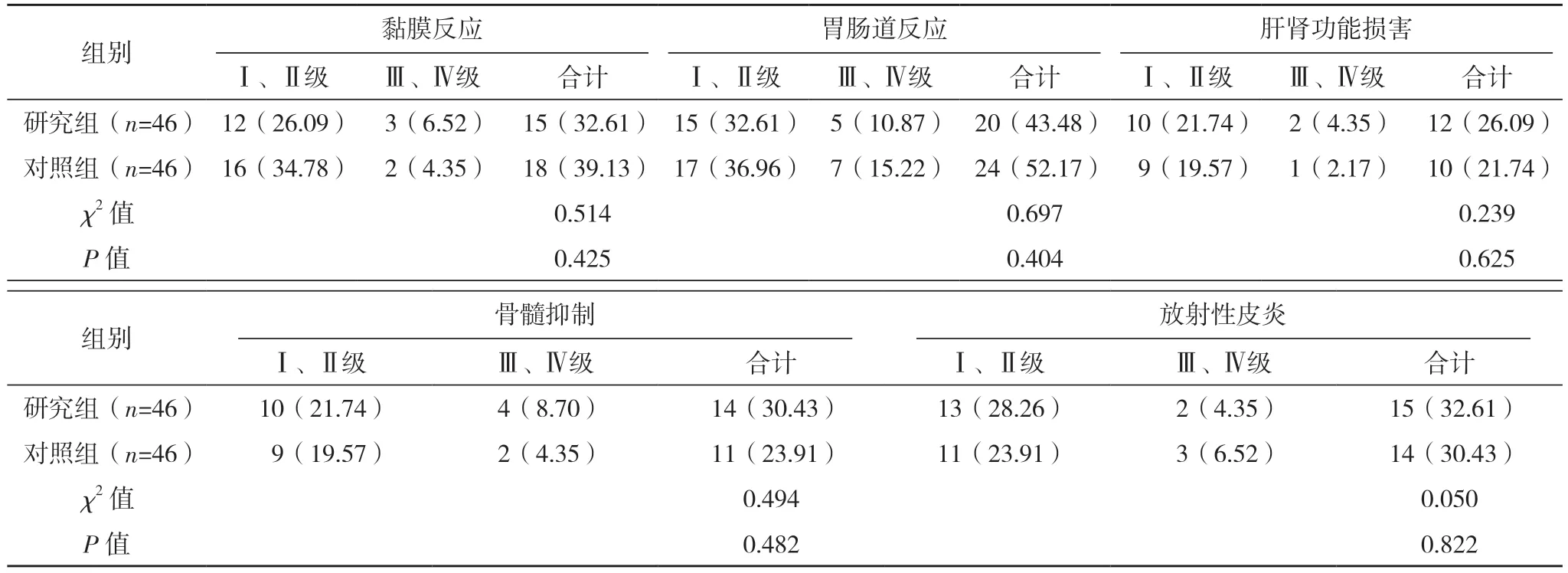
表4 两组不良反应发生情况比较[例(%)]
3 讨论
鼻咽癌的发病原因尚不明确,临床上多认为与遗传易感性、环境污染、爱泼斯坦-巴尔病毒感染等因素有关,患者可出现颈部肿块、听力下降、流鼻血等症状[7-8]。该病的发病率、死亡率均较高,若不积极采取治疗措施,肿瘤细胞可能发生远处转移,进一步危害患者健康[9]。
同步放化疗是临床上治疗鼻咽癌的常用方法,患者同时接受放疗、化疗治疗,通过小剂量化疗药物来增强放射治疗效果,可局部杀伤肿瘤细胞[10]。但该方法单用时疗效有限,肿瘤细胞对同步放化疗的敏感度不足,需要引入其他治疗措施[11]。尼妥珠单抗具有选择性强、安全性高的优势,其作为一种单克隆抗体类药物,能够作用于表皮生长因子受体,阻断相应传导通路,从而降低肿瘤细胞的增殖、分化活性,并抑制肿瘤血管生长,延缓病灶扩散[12-13]。该药能够增强肿瘤细胞对电离辐射的敏感度,使放射治疗更好地发挥效果,提高肿瘤细胞膜通透性,促进化疗药物吸收[14]。
何树燕等[15]研究发现,将尼妥珠单抗与同步放化疗联合应用,可达成靶向治疗目的,精准杀灭肿瘤细胞,增强整体治疗效果,延长患者生存周期。本研究中,研究组ORR、DCR 与对照组比较均更高。分析其原因,尼妥珠单抗联合同步放化疗能够发挥协同作用,终止肿瘤细胞分裂并加快其凋亡速度,同时提高肿瘤细胞对放化疗的敏感度,精准杀灭肿瘤细胞,达成靶向治疗目的,从而增强近期疗效。鼻咽癌患者体内的肿瘤细胞激活蛋白酶,使细胞降解速度增快,细胞内的CYFRA21-1 大量释放入血,血清CYFRA21-1 水平随之升高[16]。SCCAg能够参与肿瘤细胞的生长,对鼻咽癌肿瘤细胞增殖、分化起到促进作用[17]。本研究结果中,治疗后研究组CYFRA21-1、SCCAg 水平与对照组比较均更低。推测其原因,联合治疗能够破坏肿瘤细胞结构、干扰DNA 合成,同时阻止表皮生长因子受体与其配体结合,抑制表皮生长因子受体的过度表达,从而降低血清肿瘤标志物水平[18]。
鼻咽癌患者多处于微炎症状态,加之受到放疗射线的高能粒子电离影响,体内活性氧生成量增多,可提高机体氧化应激水平,引发正常细胞凋亡[19]。本研究结果显示,两组治疗后MDA、NO 水平均升高,SOD 水平均降低,但研究组MDA、NO 水平与对照组比较均更低,SOD 水平更高。分析其原因,联合治疗能够选择性提升肿瘤细胞对放化疗的敏感性,更好地保护正常细胞,使其代偿性释放抗氧化物质,减轻机体氧化应激反应[20]。此外,研究组不良反应发生率与对照组比较差异均无统计学意义,提示尼妥珠单抗联合同步放化疗的安全性较高,不增加不良反应,考虑与尼妥珠单抗对肿瘤细胞的高度选择性有关,其能够发挥靶向性、特异性治疗作用,对正常细胞造成的影响较小。
综上所述,尼妥珠单抗联合同步放化疗治疗鼻咽癌患者,可促进近期疗效提高,对血清肿瘤标志物有显著调节作用,能够减轻氧化应激反应,安全性较高。

