脑膜瘤组织中Ki-67蛋白、ADAMDEC1蛋白表达及其与临床病理特征相关性分析
王 鹤,王浩岩,李英夫
(佳木斯大学附属第一医院神经外科, 黑龙江 佳木斯 154003)
脑膜瘤是一种原发性颅内肿瘤,多为良性肿瘤,生长较为缓慢,早期基本无明显症状,随着瘤体的不断增大,压迫周围脑组织,会引起头痛、恶心呕吐等症状,并可伴随局灶性神经功能缺损等,影响患者工作及生活[1,2];少数为恶性,而恶性脑膜瘤临床表现不典型,影像学检查虽有一些特征性及相对特征性表现,但有时候良恶性鉴别还是有一定难度,确诊仍需要病理学检查[3]。目前,手术是临床治疗该病的主要手段,通过切除颅内的脑膜瘤组织,可解除颅内占位,避免压迫其他脑组织,从而减轻疾病症状,必要时还可辅助放射治疗,最大限度破坏脑膜瘤细胞组织,改善患者预后[4,5]。虽然手术是主要治疗手段,但手术同时也会给患者带来很多并发症,如:尿崩、下丘脑及垂体前叶功能障碍、精神症状、癫痫、嗅觉减退等[6]。此外,经临床长期随访发现,脑膜瘤仍存在较高的复发风险,尤其是世界卫生组织(WHO)Ⅱ级、Ⅲ级患者,其肿瘤常呈侵袭性,手术易出现不完整切除现象,导致术后即使规范化放射治疗,仍会出现复发风险。因此,还需深入研究在脑膜瘤发生及发展中存在重要作用的分子标志物,以寻找新的治疗靶点,降低远期复发风险。增殖细胞核抗原(Ki-67)蛋白是一种细胞增殖标志物,可用于评估某一细胞群增殖比例,其常存在于乳腺癌、前列腺癌等多种恶性肿瘤中,且高表达会影响患者预后[7]。解聚素金属蛋白酶癸蛋白1(ADAMDEC1)则为去整合素-金属蛋白酶家族重要成员,具有参与细胞黏连、降解细胞外基质蛋白等多种作用,或可参与恶性肿瘤侵袭或转移[8]。鉴于此,本研究分析脑膜瘤组织内Ki-67蛋白、ADAMDEC1蛋白表达与临床病理特征间的关系。报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2021年1月本院的82例脑膜瘤患者作为观察组,另选同期因外伤行颅脑手术的患者60例作为对照组。观察组男39例,女43例;年龄24~65岁,平均(42.15±4.18)岁;体质量指数18~28kg/m2,平均(24.15±1.47)kg/m2;WHO分级:40例Ⅰ级,32例Ⅱ级,10例Ⅲ级;文化程度:42例高中及以上,40例初中及以下。对照组男31例,女29例;年龄28~67岁,平均(42.23±4.21)岁;体质量指数18~28kg/m2,平均(24.18±1.49)kg/m2;文化程度:32例高中及以上,28例初中及以下。经医学伦理委员会批准。(1)纳入标准:脑膜瘤经手术病理确诊;均行手术治疗;临床资料完整;精神状态良好;患者及家属知情同意。(2)排除标准:术前接受放射治疗;合并其他恶性肿瘤;存在急性脑血管疾病;既往有脑部手术史;中途随访失联。
1.2 方法
脑膜瘤患者均行手术治疗,术中切除脑膜瘤标本送检;外伤行颅脑手术患者均切除外伤性脑组织作为正常标本送检。免疫组化染色法检测Ki-67、ADAMDEC1表达:所有标本均经甲醛溶液固定,石蜡包埋,常规切片、脱蜡、水化处理,之后在摊片机上烘烤后脱蜡处理,并开展脱二甲苯处理;待30% H2O22mL与蒸馏水混匀后,室温20min,阻断内源性过氧化物酶,之后水洗;再使用高压锅进行抗原修复,快速冷却,以PBS缓冲液冲洗3次,滴加正常血清,37℃下孵育30min,将多余血清甩去后,加入各自特异性抗体,并置于4℃环境内过夜;再次以PBS冲洗,滴加二抗,37℃孵育30min,再以PBS冲洗3次;之后DAB显色处理,再水洗,待苏木素复染后,进行返蓝、脱水、透明及封片处理。结果判读:以染色强度及阳性细胞百分比为判读依据,其中染色强度为0~3分,对应无着色、淡黄色、棕黄色及棕褐色;阳性细胞百分比为0~3分,对应无阳性细胞、1%~10%、11%~50%、51%~100%;两项得分相乘≥3分则为阳性,反之则为阴性。
1.3 观察指标
(1)Ki-67蛋白、ADAMDEC1蛋白表达:比较脑膜瘤组织及正常组织中Ki-67蛋白、ADAMDEC1蛋白表达差异。(2)Ki-67蛋白、ADAMDEC1蛋白表达与病理特征间关系:比较不同Ki-67蛋白、ADAMDEC1蛋白表达患者年龄、性别、肿瘤大小、WHO分级、瘤周水肿、脑膜尾征、骨侵犯等病理特征方面差异。(3)Ki-67蛋白、ADAMDEC1蛋白表达与预后关系:所有脑膜瘤患者均随访两年,记录疾病复发情况,并分析疾病复发与Ki-67蛋白、ADAMDEC1蛋白表达间的关系。
1.4 统计学方法

2 结果
2.1 Ki-67蛋白、ADAMDEC1蛋白表达
观察组Ki-67蛋白、ADAMDEC1蛋白阳性表达率高于对照组,差异有统计学意义(P<0.05),见表1。
2.2 Ki-67蛋白、ADAMDEC1蛋白表达与病理特征间关系
Ki-67蛋白阳性组、ADAMDEC1蛋白阳性组WHO分级Ⅱ-Ⅲ级、瘤周水肿、骨侵犯占比高于Ki-67蛋白阴性组、ADAMDEC1蛋白阴性组,差异有统计学意义(P<0.05),见表2。

表2 Ki-67蛋白、ADAMDEC1蛋白表达与病理特征间关系[n(%)]
2.3 Ki-67蛋白、ADAMDEC1蛋白表达与预后间关系
82例患者随访2年,共出现11例复发,复发率为13.41%(11/82);Ki-67蛋白阳性组、ADAMDEC1蛋白阳性组复发率略高于Ki-67蛋白阴性组、ADAMDEC1蛋白阴性组,差异无统计学意义(P>0.05),见表3。
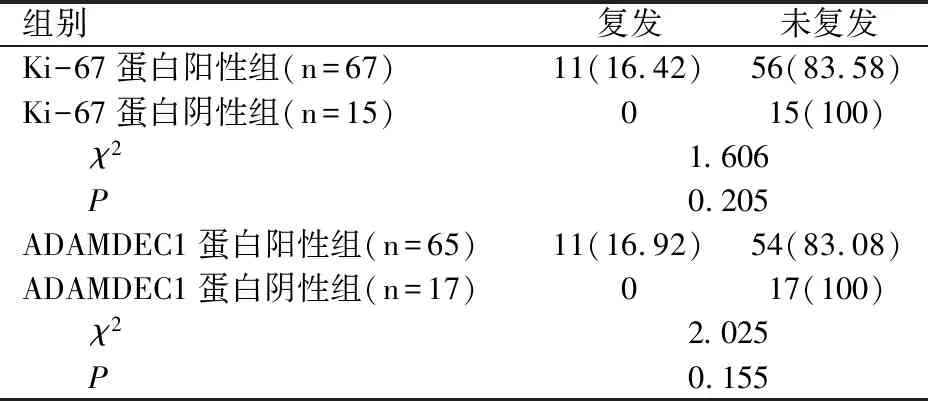
表3 Ki-67蛋白、ADAMDEC1蛋白表达与预后间关系[n(%)]
3 讨论
人的颅骨及大脑组织间,存在三层膜,由外到内依次为硬脑膜、蛛网膜及软脑膜,合称为脑膜。脑膜瘤是起源于蛛网膜帽状细胞的脑肿瘤,其好发于大脑半球的凸面、颅底及鞍旁区域,不同区域疾病症状存在一定差异性,但早期均无明显症状,瘤体不断增大压迫脑组织会引起颅内压增高等症状[9-11]。目前,临床对于脑膜瘤的病因尚未完全明确,普遍认为在电离辐射、雌激素刺激、头部创伤史等多种因素的作用下,引起蛛网膜细胞基因变异,致使蛛网膜帽状细胞出现不受控的增殖现象,最终形成脑膜瘤组织[12-14]。手术为当前治疗脑膜瘤的重要手段,切除脑膜瘤后可解除占位性压迫,减轻神经功能损害,缓解疾病症状。但脑膜瘤依据WHO分级可分为Ⅰ、Ⅱ、Ⅲ级,分级越高则肿瘤侵袭性越强,术后即使辅助放射治疗后也易出现疾病复发情况,影响患者远期预后。因此,需寻找新的治疗靶点,以完善早期治疗方案,降低远期复发风险。
Ki-67是反映细胞周期及细胞增殖活性的标志物,其在多种恶性肿瘤中均存在较高表达,可参与肿瘤的增殖及侵袭[15-17]。当Ki-67处于高表达状态时,肿瘤细胞DNA扩增速度更快,能够加快肿瘤细胞组蛋白的翻译及合成,使肿瘤细胞迅速增殖,并提高肿瘤的浸润能力,促进肿瘤细胞上皮间质转化[18-19]。在脑膜瘤中亦是如此,当Ki-67高表达时,则提示肿瘤细胞处于增殖活跃状态。同时,肿瘤的发展过程包括恶性增殖、侵袭生长、细胞突破基底膜、细胞外基质黏附等多个过程。而去整合素-金属蛋白酶家族在上述过程中均发挥重要作用。该家族是一种锌蛋白酶类的跨膜蛋白,具有金属蛋白酶及去整合素功能的结构域,可参与细胞间的黏连,并能影响细胞及基底膜间的相互作用,从而参与细胞迁移、增殖、分化等多方面的调节。而ADAMDEC1是该家族的重要成员,具有整联蛋白、金属内肽酶结合的活性,可介导信号转导途径,参与蛋白水平,并能负调控细胞附着。在恶性肿瘤中,ADAMDEC1处于高表达状态时,会降低细胞膜内的多种蛋白成分,破坏阻止肿瘤细胞侵袭的组织学屏障,为肿瘤的侵袭及转移创造有利条件[20-22]。本研究结果显示,观察组Ki-67蛋白、ADAMDEC1蛋白阳性表达率高于对照组;Ki-67蛋白阳性组、ADAMDEC1蛋白阳性组WHO分级Ⅱ-Ⅲ级、瘤周水肿、骨侵犯占比高于Ki-67蛋白阴性组、ADAMDEC1蛋白阴性组;提示脑膜瘤组织内Ki-67蛋白、ADAMDEC1蛋白阳性表达率高,且与临床病理特征存在密切关系。分析原因,Ki-67、ADAMDEC1蛋白处于高表达状态时,可提高肿瘤细胞的增殖及侵袭能力,故WHO分期更高,且在脑膜瘤的持续进展过程中会累及周围组织,引起瘤周水肿、骨侵犯等现象,加重患者病情。本研究结果显示, 82例患者随访两年,共出现11例复发,复发率为13.41%(11/82);Ki-67蛋白阳性组、ADAMDEC1蛋白阳性组复发率略高于Ki-67蛋白阴性组、ADAMDEC1蛋白阴性组,差异无统计学意义(P>0.05);提示Ki-67、ADAMDEC1蛋白表达与肿瘤复发存在一定关系。本研究中肿瘤复发患者均伴有Ki-67、ADAMDEC1蛋白阳性表达,但受限于样本量小等因素影响,未能够出现统计学方面的差异,后续还需扩大样本量,并延长随访时间,进一步论证Ki-67、ADAMDEC1蛋白阳性表达与肿瘤复发的相关性。
综上所述,Ki-67蛋白、ADAMDEC1蛋白在脑膜瘤中存在较高阳性表达率,其高表达与肿瘤WHO分级、瘤周水肿、骨侵犯关系密切,临床应高度重视,以此开展针对性治疗,改善远期预后。

