骨髓间充质干细胞移植促进跨区皮瓣术后血管新生的研究
薛 兰,毛春迎,田荆华,张争辉,李 岩
(菏泽医学专科学校,山东 菏泽 274000)
在临床上,患者遭受外部创伤、肿瘤切除术,以及自身先天性畸形,均会引起血管组织损伤,或损伤面积扩大[1]。针对上述问题,医生会采取跨区皮瓣的方式进行血管组织修复。动物实验表明[2],用穿支为蒂进行跨区取皮瓣,会导致动力供区和潜力供区间的皮瓣坏死[3],而且蒂部的供血下降,致使血管体间吻合点向远端进行供血[4]。简单地说蒂部供血越远,皮瓣的供血量越少。所以,远端组织的供血需求无法满足时,皮瓣的纤维化、萎缩问题越严重[5],直至皮瓣坏死。在较大组织缺损修复时,要尽量提高皮瓣新生率,并通过延迟法进行皮瓣组织修复。虽然延迟方法能促进皮瓣新生,但是该手术的成本较高[6],术后疼痛感强烈,无法在临床上广泛应用。因此,寻找一种有效药物,达到choke血管扩张、皮瓣新生的治疗目的[7],是基础临床医学研究的主要方向。有文献研究显示,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMMSCs)能扩张下肢侧副血管,促进血液流动,并在临床上作为辅助治疗手段。但是,也有部分学者认为BMMSCs的治疗效果不理想,并存在质疑。基于此,本文以BMMSCs为研究对象进行血管皮瓣新生研究,验证其实验效果。
1 材料与方法
1.1 材料
选取已清洁的40只SD大鼠,体质量为300~350g(北京医科大学动物实验中心,产地北京),DMEM/F12(Hyclone公司,产地美国);胰蛋白酶(Sigma公司,产地美国);倒置显微镜分别为DMEM、IX-70(Olympus公司,产地美国)、CD29、CD90、CD34和CD45抗体均购置于Biolegen公司(美国)、青霉素、链霉素(Gibco公司,产地美国);流式细胞仪(Coulter公司,产地美国)。
1.2 研究方法
1.2.1 全骨髓贴壁培养法
先取得SD大鼠两侧的胫骨和股骨(4对),为全髓差异贴壁培养法做准备;在超净台上,剪去胫骨和股骨骨端,用DMF=EM/F12对髓腔反复冲洗4次;利用滤网(200目)过滤,得到细胞悬液[8],用1000r/min离心机离心5min,撇去上清液。将青链霉素(浓度:1%)+FBS/DMEM(10%)培养基重悬细胞,按3×105个/L细胞密度接种于25cm2培养瓶中,放置于37℃,湿度饱和度100%,CO2浓度为5%的培养箱中进行抚育。待48h后进行首次换液,2~3d再进行换液。定期观察培养液中细胞分裂、增殖以及形态特征。如果细胞长满培养瓶底部,而且面积大于90%以后,按1:2传代。当细胞传至P3代后,用胰酶对细胞进行消化,收获细胞,计算细胞数。
1.2.2 细胞表面标记物流式细胞仪检测
通过细胞表面标记物流式细胞对其进行检测,选取第三代骨髓间充质干细胞。通过EDTA(浓度:0.1%)联合胰酶(浓度:0.25%)消化并收集P3代的BMMSCs[9],用PBS进行漂洗和重悬,经过滤网(规格:200目)进行处理。细胞计数后分别装于7个EP管中,每管规格为100、约为106细胞,分别为CD29、CD90、CD34、CD45、及其对照管。其中,CD90、CD45的对照组为同型。在20℃阴凉条件下进行标准稀释,稀释比例为CD29为1:16,CD45和CD90为1:8,CD34不能稀释。取标记抗体20混合到各管内,并在20℃、避光下培养40min。经PBS洗涤两遍后,用光电倍增管PMT2,检测PE的荧光度。
1.2.3 跨区皮瓣坏死模型的构建
在SD大鼠背部取得3支血管,胸背动脉穿支、肋间后动脉穿支,以及髂腰动脉穿支为蒂、囊括肋下动脉穿支皮瓣。皮瓣切除后,将SD大鼠随机分为观察组和对照组。对照组中皮瓣被取出后无任何干预,观察组皮瓣被取出后1h,经尾部静脉按照1mL/100g的使用剂量为SD大鼠注射骨髓间充质干细胞悬液(浓度:1×106个/mL)。1周后,提取肋间髂腰动脉、肋间动脉的choke区组织,进行石蜡包埋,并进行切片。最后,利用间接法染色法对Von Willebrand因子的免疫组染色。在200倍视野下,对随机取的3张切片进行10个视野观察,计算微血管管径,比较两组SD大鼠choke区血管的直径。处死大鼠后,用作图软件测量皮瓣坏死面积,坏死率。
1.3 统计学方法
采用SPSS 20.0统计软件进行处理,对choke区内的血管直径进行分析。其中,计量资料表示为均数±标准差,组间行t检验,计数资料表示为n(%),组间χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 BMMSCs的形态学观察
结果显示:原代细胞经1d培养后,出现大量死亡细胞,并悬浮于培养基表面,部分沉淀于贴壁。经2d后,提取未贴壁细胞。相对来说,贴壁细胞体积小,而且形态多样,并呈现圆形、椭圆形。经4~6d后,细胞分裂增殖速度更快,而且呈瘦小的长梭形,体积大于2d细胞,并铺满管底部,呈现漩涡状。其中,出现放射状、密集排列的细胞群。所以,传代培养时,细胞培养1~2d后出现贴壁;P2代BMMSCs细胞出现纤维样,多分布于底部; 50%以上的P3代呈长梭形,类似膜状,均匀铺展在底部,漩涡样分布多于P2代。
2.2 流式检测
用流式细胞仪对P3代进行检测,发现表面标志物CD90、CD29、CD34和CD45的阳性细胞率分别为93.5%、98.2%、0.82%和2.22%,如图1中A和B所示。
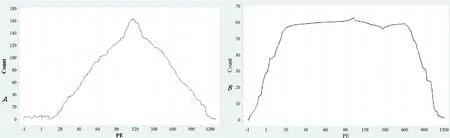
注:A为CD90,B为CD29,CD34和CD45略
2.3 皮瓣坏死率与choke血管直径
术后7d观察组的坏死率低于对照组,而choke血管直径大于对照组,存在显著差异(P<0.05),见表1。
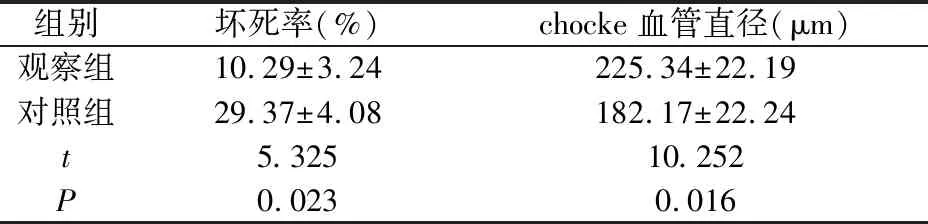
表1 两组大鼠皮瓣坏死率与chocke血管直径(n=20)
3 讨论
3.1 背部跨区模型
临床研究显示,背部表皮中每支动脉均有明确的供血范围,并与周围相邻动脉形成丰富吻合,即choke血管。当某侧血管被阻断,其管内血压会下降,血流会跨越原来的吻合部位向其供血。在跨越动力学供区的基础上,如再继续向远端供区延伸,此区域皮瓣为跨区皮瓣,是临床上进行组织修复的对象。切取跨区皮瓣后,choke区皮瓣会出现不同程度的坏死。SD大鼠背部由6个血管进行供应,可以切取含有3个血管体区、2个choke区跨区皮瓣,能构建研究远端30%的坏死模型,对皮瓣取缺血、缺氧,以及血管新生进行分析。
3.2 BMMSCs对背部跨区皮瓣坏死的作用
研究发现, BMMSCs植入肢体后,旁分泌产生多种促血管扩张细胞因子,诸如,单核细胞趋化蛋白-1等。临床研究发现,可以利用全骨髓差异贴壁法,从SD大鼠中分离和培养BMMSCs,并鉴定其特异性表型,以验证方法的可靠性。通过流式细胞检测鉴定BMMSCs,发现表面标记物特征与相关文献研究类似,能改善跨区皮瓣的新生率,血管本体比邻区choke血管的直径增加。BMMSCs进入皮瓣后,单核细胞、巨噬细胞集中于血管壁, MMP-2蛋白酶会消化血管基膜纤维,致使弹力纤维裂解,促进平滑肌层的细胞新生,使得choke血管发生扩张。因此,MMP-2蛋白酶促进局部组织血管的再生,其作用与细胞因子类似,优势明显。
3.3 皮瓣血流力学变化
choke管径细小会阻碍跨区皮瓣中血液流向远端,所以要适当进行药物干预,以扩张choke血管直径,改善远端供血。本研究中,观察组的choke血管内径显著大于对照组,对皮瓣远端供血的改善十分明显,能促进远端血管的再生。
总之,通过在SD大鼠背部的穿支,包括胸背动脉穿支、肋间后动脉穿支等,能构建有效的皮瓣坏死模型。而在该模型中,注射BMMSCs,能改善choke血管扩张,促进皮瓣存活。

