远隔缺血后适应通过水通道蛋白-4对局灶性脑缺血再灌注大鼠的血脑屏障保护机制
杨 军,安贵良,刘子琨,李浩然, 宋广福
(佳木斯大学附属第一医院神经外科,黑龙江 佳木斯 154003)
缺血性脑卒中患者接受静脉溶栓和或动脉取栓,恢复脑组织血液灌注后,脑组织常常伴有一系列并发症,包括出血性转化、血脑屏障的破坏和水肿加重,进一步加重脑损伤,这一现象被称为脑缺血再灌注损伤。血脑屏障破坏,会引发细胞毒性、血管源性水肿甚至危及生命的出血转化[1]。因此减轻脑水肿是改善缺血性脑卒中患者神经功能缺损和促进病情恢复的关键。水通道蛋白在脑部水的运输中发挥着双向作用,并参与脑水肿的形成和消除[2]。其中AQP4是近些年来备受关注的研究热点。远隔缺血适应(remote ischemic conditioning,RIC)是指通过对远隔器官实施短暂、重复、非致死性的缺血再灌注刺激诱导心,脑等重要器官的缺血耐受,从而保护脑神经细胞[3],减轻脑缺血-再灌注损伤[4]。它是一种无创性物理治疗技术,安全性较高,因此,在多种类型的缺血性脑血管病中被广泛研究和应用[5, 6]。本研究主要探讨远隔缺血后适应通过调节AQP4的表达来改善大鼠局灶性脑缺血再灌注后血脑屏障的破坏,进而产生脑保护作用。
1 材料与方法
1.1 实验材料
主要试剂及仪器:AQP4多克隆抗体(武汉三鹰生物技术有限公司),鼠抗β-肌动蛋白(北京博奥森生物技术有限公司),羊抗鼠IgG抗体(北京博奥森生物技术有限公司),SDS-PAGE凝胶制备试剂盒(大连美仑生物技术有限公司)。高速冷冻离心机(美国BECKMAN公司),VE-186垂直电泳仪、Tanon5200全自动化学发光仪(上海天能科技公司),全自动多功能酶标仪(美国Bio-TEK公司),全自动切片机(德国LEICA公司)。
1.2 实验动物
75只SPF级SD雄性大鼠,12周龄,体质量280~320g,购于哈尔滨医科大学动物学部(SYXK(黑)2021-018),合格证编号为230729221100028356。饲养于佳木斯大学动物实验中心。饲养环境:昼夜各半循环照明,湿度恒定,温度在 22 ~25 ℃。所有操作均符合佳木斯大学生物医学伦理要求。
1.3 实验方法
1.3.1 实验分组
将 SPF 级 SD 雄性大鼠75只,依据随机原则,均分为3组:假手术组25只、缺血再灌注组(I/R)25只和远隔缺血后适应组(RIPC)25只。其中I/R组及RIPC组各有1只大鼠在取脑后观察到蛛网膜下腔出血被排除在外。
1.3.2 大鼠缺血再灌注(MCAO/R) 模型建立
采用Longa等[7]线栓法制备小鼠缺血再灌注模型,造模前12h 禁食水,饮水自由。1%戊巴比妥钠(40mg/kg)腹腔注射麻醉,分离小鼠右侧颈外动脉、颈内动脉、颈总动脉,颈总动脉近心端及颈外动脉近分叉部分别穿一根手术线并结扎,向颈总动脉减一小口并向小鼠颈内方向插入线栓塞19~20mm遇阻停止,结扎颈总动脉远心端的手术线从而牢牢固定线栓。阻断90min后取出线栓,进行再灌注,恢复血供。远隔缺血后适应组:如既往方法所述[8],在再灌注开始时,通过双侧后肢阻断股动脉血流10min,开放10min,共3个周期。假手术组除了不进行线栓外,剩余操作均相同。死亡2只,造模不成功3只。
1.3.3 神经功能评分
再灌注24h后检测,根据Longa等[7]的方法,评估大鼠的神经行为。0分:无神经功能损害。1分:左前肢不能完全伸展。2分:行走时向左打转。3分:行走时向左侧跌倒。4分:不能行走且意识水平低下。
1.3.4 脑组织含水量测定
取右侧大脑半球称重量,即湿重,110℃烘烤24h后再次称重,即干重,脑含水量(%)=(湿重-干重)/湿重×100%。
1.3.5 TTC染色法
脑组织冠状切片,放在2%TTC溶液中,37℃避光水浴,30min充分染色,梗死组织染色呈白色,梗死体积%=[(正常侧大脑半球体积-梗死侧半球非梗死区体积)/对侧半球体积]×100%。
1.3.6 采用EB染色法评估血脑屏障破坏情况
麻醉大鼠,尾静脉注射2%伊文氏蓝溶液(4mL/kg),取脑组织称重,加入1mLPBS溶液后研磨,与2.5mL的60%三氯乙酸混合之后进行离心15min(12000rpm/min),低温保存约10min,吸取上清液,分光光度计在610nm处估计EB吸收率。
1.3.7 Western blot法分析AQP4的表达
分离出右侧纹状体及右侧顶叶皮质,并放在-80℃冰箱保存。分别经以下步骤:组织蛋白提取,溶液配制,配胶,电泳,转膜,封闭,一抗、二抗孵育,曝光,显影。测定蛋白灰度值与β-Actin的比。
1.4 统计学方法
采用SPSS26.0软件进行录入分析,结果均以(均数±标准差)表示。分析前使用正态性检验检验数据是否符合正态分布。符合数据的多组间独立样本比较采用单因素方差分析(one-way ANOVA),两组间比较采用独立样本t检验。非正态分布采用多独立样本秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠脑组织病理改变
Sham组:缺血侧海马CA1区组织细胞形态正常,无水肿及坏死;I/R组:CA1区呈明显的病理性改变,间质疏松、水肿,细胞周围间隙增宽,细胞排列紊乱,神经细胞体积缩小,细胞核浓缩且不规则;RIPC组:CA1区神经细胞浓缩和间质肿胀程度明显减轻,排列较规整,显著改善了细胞损伤。见图1。
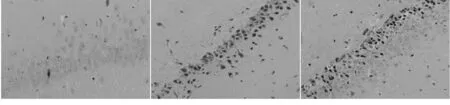
Sham组(×200) I/R组 (×200) RIPC组(×200)
2.2 大鼠神经功能评分
Sham组大鼠无神经功能障碍;I/R组出现明显神经功能障碍,神经功能评分显著升高(P<0.01);与I/R组比,RIPC组大鼠神经评分降低,改善了神经功能障碍,无统计学意义(P=0.081),见表1。
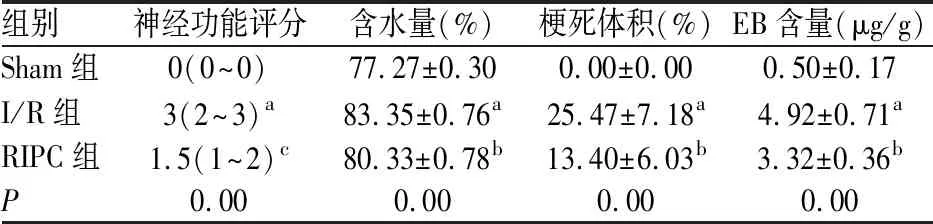
表1 各组大鼠神经功能、脑组织含水量、脑梗死体积以及脑血脑屏障情况比较(n=25)
2.3 脑组织含水量
评估脑水肿。和Sham组比,I/R组大鼠脑组织含水量明显升高(P<0.01);与I/R组比,RIPC组大鼠脑组织含水量显著降低(P<0.01),见表1。
2.4 TTC染色
测大鼠脑梗死体积,梗死区域呈白色,而正常的非梗死组织呈红色。Sham组大鼠脑组织无缺血梗死。与I/R组相比,RIPC组显著降低了大鼠脑梗死体积(P<0.01),见表1。
2.5 血脑屏障渗透性
EB渗透量:I/R组与Sham组有显著差异(P<0.01),RIPC组与I/R组差异有统计学意义(P=0.013),见表1。
2.6 AQP4的表达
纹状体区和皮质区I/R组的AQP4蛋白的表达明显高于Sham组(P<0.01)。而RIPC组中纹状体区AQP4蛋白的表达明显低于I/R组(P<0.01),见表2、图2。
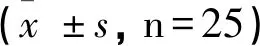
表2 各组大鼠脑组织纹状体区、皮质区AQP4比较
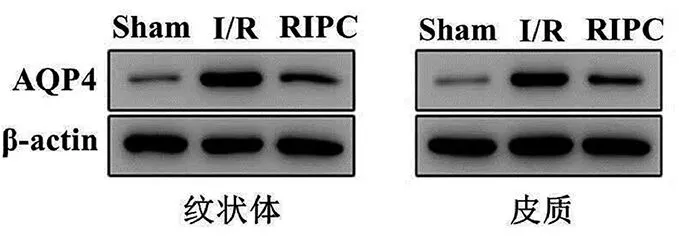
图2 各组大鼠缺血侧纹状体和皮质区AQP4的表达
3 讨论
脑缺血再灌注损伤是一种复杂的病理过程,包括缺血期原发性损伤和再灌注期继发性损伤[9]。这会导致神经细胞的严重损伤、凋亡和水肿,加重由细胞膜损伤、兴奋性氨基酸毒性、中性粒细胞活化毒性等多种因素引起的脑损伤[10]。血脑屏障是中枢神经系统和外周血循环之间的动态接口,在维持中枢神经系统稳态方面发挥着至关重要的作用。由于血脑屏障的破坏引起的脑水肿可扩大缺血性脑卒中的梗死面积[11]。因此,减轻脑水肿、保护血脑屏障完整性、降低血脑屏障通透性可有效缓解脑缺血再灌注损伤。
为了评价脑保护方法的效果,本研究采用了多种评价方法,包括干湿重法测量脑组织含水量、TTC染色测量脑梗死体积、EB染色评价血脑屏障的破坏程度。RIPC可以显著减轻脑水肿、降低血脑屏障通透性和减少梗死体积,从而有效缓解脑缺血再灌注损伤,起到神经保护作用。
AQP4是一种双向水特异性通道,主要分布在胶质界和星形细胞端足内,在血脑屏障处,星形胶质细胞利用AQP4来维持颅内液体平衡[12]。AQP4是中枢神经系统中表达最高的水通道蛋白,在脑水肿的形成和消散中起着至关重要的作用。既往有研究使用大鼠纹状体或顶叶皮质通过免疫印迹法进行AQP4的测定[13],但仅提供一个实验结果。考虑到不同区域可能会对AQP4表达的结果产生不同影响。因此本实验对AQP4在纹状体和顶叶皮质两个区域的表达进行测量。Western blot检测结果显示,大脑中动脉闭塞90min再灌注24h可导致AQP4在大鼠体内表达上调,经过RIPC处理后大鼠两部位AQP4的表达明显降低。
Aoki等[14]使用MCAO模型发现AQP4mRNA的表达随着脑水肿的加重而在缺血性病变外周显著升高,表明脑缺血引起的脑水肿可能与AQP4参与的水运输有关。这可能是由于AQP4的上调使水从细胞外和间质迅速转运到细胞内。此外,I/R损伤可以导致AQP4的表达上调,从而加重脑损伤。抑制AQP4后,脑I/R动物的脑水肿程度明显减轻,预后得到改善[15]。远隔缺血后适应治疗可以降低大鼠脑I/R损伤后AQP4的表达水平,因此推测AQP4可能参与了远隔缺血后适应对大鼠脑I/R损伤的神经保护作用。
研究表明,RIPC可以显著减少局灶缺血再灌注大鼠的脑梗死体积、降低脑水肿并减弱AQP4的表达[16],这表明RIPC的保护机制部分依赖于下调AQP4表达,从而改善功能结果。本研究数据显示,I/R组中AQP4的表达增加,而RIPC组显著下调了AQP4的表达,提示下调AQP4可以改善脑缺血再灌注早期的脑损伤。本研究的发现为RIPC在局灶性脑缺血再灌注模型中发挥有效的AQP4调节作用和神经保护作用提供了初步的证据。首先,只观察了再灌注24h后的结果,因为在缺血24h后观察到水肿高峰[17]。因此,研究了脑I/R后早期水肿的形成。由于条件的限制,没有评估造模是否成功。仅从10只局灶脑缺血再灌注大鼠脑组织切片的TTC染色及造模大鼠神经功能评分来看,这次造模是成功的,且与其他试验结果相符[18]。
远端缺血后适应可以改善MCAO/R后神经功能障碍,减轻脑水肿,减少梗死体积,降低血脑屏障通透性,产生脑保护作用;并且可以通过下调AQP4的表达,减轻缺血再灌注损伤,降低血脑屏障的通透性,减轻脑水肿,降低梗死体积。使用下肢作为远隔缺血后适应的器官是安全可行的,值得临床上进一步探讨并应用。

