胱抑素C在特发性肺纤维化中的价值及与肺功能的关系
朱明娣, 李树民,梁建合
(佳木斯大学附属第一医院呼吸与危重症医学科,黑龙江 佳木斯 154003)
肺纤维化(idiopathic pulmonary fibrosis,IPF)的病因目前尚未明确,是一组以肺泡结构破坏、成纤维细胞的增殖、胶原蛋白的过渡沉积尤其是以Ⅰ型和Ⅲ型胶原沉积为主要特征的肺间质过度修复性疾病[1]。一些药物已被用于治疗IPF,无论是单独使用还是联合使用,迄今为止,都没有明确的药物治疗可以改善IPF患者的生存率。其他已知药物中仅吡非尼酮、吡非尼酮可能对轻中度IPF患者的肺功能下降有缓解作用。但IPF的预后仍然非常差,约50%的患者在诊断后2-5年内死亡。这种预后不良的部分原因是IPF在早期通常无特殊表现,直到疾病处于晚期才出现喘憋,这也延迟了IPF的诊断。Grubb等[2]人研究发现胱抑素C(cystatin C,CysC)是作为肾功能评价的重要指标之一,能反映出肾小球滤过膜通透性改变的情况,另一方面,在一些纤维化疾病中,发现血清CysC水平升高,如多发性硬化症、慢性肝纤维化。Bollengier等[3]研究发现纤维化疾病的特征为细胞外基质蛋白的过度沉积,其中组织蛋白酶参与细胞外基质蛋白的动态调控过程。Turk等研究发现CysC可能参与组织蛋白酶在IPF中蛋白水解活性的调控,进而促进纤维化的发展[4]。在肺气肿、肺部炎症疾病和慢性肾脏疾病的患者中发现CysC水平升高。然而,CysC水平与肺功能之间的关系及其在IPF中的潜在价值尚未完全了解。此研究目的是评估IPF急性加重患者的CysC水平,并将其与IPF患者的稳定期进行比较。此外,通过研究以明确IPF患者的CysC与肺功能、C-反应蛋白(C-reactive protein,CRP)之间的关系。
1 资料与方法
1.1 一般资料
本研究经过佳木斯大学附属第一医院伦理委员会审核通过后收集研究对象相关资料,并进行下列研究,所选研究对象均签署知情同意书。选取2022年4月至2022年12月佳木斯大学附属第一医院呼吸与危重症医学科收治的确诊的30例IPF的患者,其中稳定期特发性肺纤维化组17例,急性加重期特发性肺纤维化组(acute exacerbations of idiopathic pulmonary fibrosis,AE-IPF)13例,抽取同时期院内体检中心健康体检者15例作为对照组。其中,IPF男13例、女17例,年龄(63.7±12.4)岁。健康对照组男7例、女8例,年龄(63.1±8.83)岁。两组研究对象在一般资料的对比上差异均无统计学意义(P>0.05)。
1.2 纳入及排除标准
1.2.1 纳入标准:依据2018年美国胸科学会/欧洲呼吸学(ATS/ERS/JRS/ ALAT)定制的IPF诊断标准[5],入组患者为行HRCT确诊的30例IPF患者(17例稳定期IPF患者、13例AE-IPF患者)。2016年国际工作组报告提出了以下AE-IPF诊断标准[6]:(a)既往已确诊的IPF或急性加重期确诊的IPF;(b)通常1个月内出现病情急剧恶化或严重呼吸困难;(c)高分辨率CT提示出现新的肺泡浸润影;(d)排除心源性因素或液体量增多引起的肺水肿。
1.2.2 排除标准:近期应用糖皮质激素治疗或患血液病的患者;其他肺部疾病,如尘肺、慢性阻塞性肺疾病等;恶性肿瘤患者;有其他脏器功能衰竭患者。
1.3 方法
两组入选者在入院时,使用间接法酶联免疫吸附实验(ELISA)测定血清中CysC水平,美国care Fusion公司肺功能仪检测患者的用力肺活量预计值(FVC%pred)指标,血清中的CRP水平使用仪器XN-3000全自动血细胞分析仪进行测定。
1.4 统计学方法
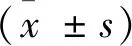
2 结果
2.1 CysC、CRP、FVC%pred比较
实验发现3组间在年龄(P>0.05)、性别(P>0.05)方面差异均无统计学意义。稳定期特发性肺纤维化组与急性加重期特发性肺纤维化组的平均血清CysC水平均显著高于对照组(P<0.001)。稳定期特发性肺纤维化与急性加重期特发性肺纤维化间CysC水平差异无统计学意义(P>0.05)。AE-IPF组的平均CRP水平显著高于稳定IPF组(P<0.001)。AE-IPF的FVC%pred水平明显低于稳定组(P<0.001)。

表1 各组间CysC、FVC、FVC%pred、CRP的比较
2.2 相关性分析
特发性肺纤维化患者中血清CysC水平与血清CRP水平呈正相关(r=0.568,P<0.01);CysC水平与FVC%pred呈负相关(r=-0.438,P<0.05),见图1,2。
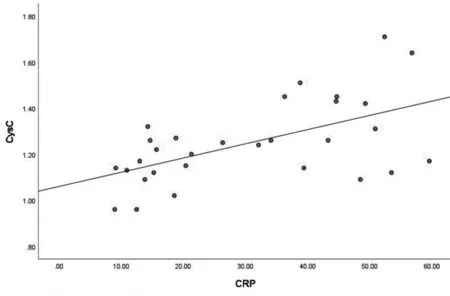
图1 CysC、CRP相关性分析
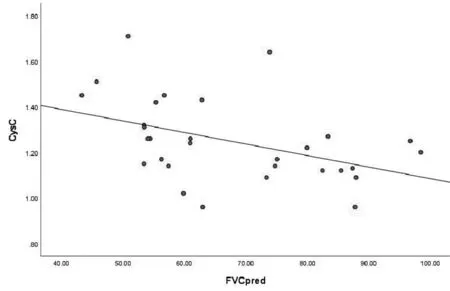
图2 CysC、FVC%pred相关性分析
3 讨论
特发性肺纤维化(IPF)是一种进行性间质性肺病,其特征是肺组织瘢痕的形成,导致气体交换受损,导致呼吸困难、干咳和全身疲劳等症状。IPF在男性中比女性更普遍,风险因素包括年龄增长、吸烟史以及在空气质量差的环境中工作,如采矿业[7]。患者生存质量受到严重影响。尽管吡非尼酮和尼替达尼在临床试验中都被证明可以减缓IPF的进展。此外,IPF的发病机制尚不完全清楚。然而,目前认为反复的肺损伤或感染会导致异常的过度修复过程,导致大量的细胞外基质沉积和肺组织瘢痕形成,这是IPF的主要特征。在肺纤维化的病理过程中,炎症是由多种细胞驱动的,包括巨噬细胞、中性粒细胞、淋巴样细胞、上皮细胞、内皮细胞和成纤维细胞等[8]。
CysC是由有核细胞产生,经过肾小球滤过从血液中清除,被认为是肾小球滤过率的生物标志物[9],优于肌酐。CysC的浓度比较稳定,不受性别、年龄和肌肉含量等肾外因素的影响。最近,一些研究表明,CysC水平在多发性硬化及肝纤维化期间有所升高。即使在没有确诊慢性肾病的个体中也是如此。Sarir等研究发现除了一些常见蛋白酶外,半胱氨酸组织蛋白酶也是一种在肺稳态中发挥重要作用的胶原酶,CysC是其天然抑制剂[10]。因此,CysC除了作为肾功能受损的指标外,还可能在纤维化疾病的发生发展中发挥关键作用。然而,CysC与特发性肺纤维化的关系尚未完全阐明。
Balta S等[11]研究发现 CysC 也作为一种内源性组织蛋白酶抑制剂来调节抗蛋白酶和血管壁蛋白酶的平衡,研究同时发现CysC与CRP的水平呈正相关,均可用来反映疾病的炎症程度。与炎症参数如白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子a(tumor necrosis factor alpha,TNF-a)和CRP有显著关系,也认为CysC的升高与肺部的炎症反应有关[12]。Frende‘us等人进行的体外研究发现,在培养物中添加胱抑素C ,可使γ干扰素(interferon-γ,IFN-γ)诱导的小鼠巨噬细胞中TNF-a的表达增强,这表明,胱抑素C可能会通过 IFN-γ启动巨噬细胞,促进TNF-a分泌[13]。推测IPF患者中胱抑素C的增加可能通过促进TNF-a产生,进而促进肺纤维化的形成。
罗红艳等[14]研究证明在组织急性缺氧时,肺组织合成并释放大量CysC ,调节从坏死组织或参与炎症反应的细胞中分泌出来的组织蛋白酶的活性,进而导致大量合成和释放炎症因子。Telo S等[15]学者研究同时发现吸烟并伴有肺气肿的患者 CysC 的水平会明显高于健康人群,由于呼吸困难而导致低氧血症的发生,巨噬细胞等炎症细胞在缺氧受损等情况及严重的肺部感染时会释放出大量的 CysC,从而导致患者血清 CysC 水平升高。本研究发现稳定期特发性肺纤维化组与急性加重期特发性肺纤维化组的平均血清CysC水平均显著高于对照组,并且CysC 水平与肺功能FVC%pred值呈负相关,因此我们推测 CysC 参与肺纤维化的炎症过程,并且患者血清 CysC 水平越高,肺功能越差,患者的病情越严重。这一结果提示血清 CysC 水平有机会应用于评价肺纤维化的患者肺功能及炎症水平,方便临床工作中更早期明确患者肺纤维化进展情况,及时科学地调整治疗方案。
本研究有一些局限性。首先,样本量相对较小。第二,为了更好地探索与特发性肺纤维化严重程度相关的因素,患者均为住院患者,比门诊患者更容易被识别为特发性肺纤维化急性加重期。因此,该结论不适用于门诊患者。最后,由于本研究采用了横断面设计,结果只能证明CysC与特发性肺纤维化肺严重程度之间的关系,而不是因果关系。然而,基于研究结果,相信结果可以证明血清 CysC 水平有机会应用于评价肺纤维化的患者肺功能及炎症水平程度。在未来的实验中,需要更大队列的前瞻性研究,同时包括住院患者和门诊患者。

