松萝酸经HMGB1-RAGE信号通路治疗胶原诱导性关节炎大鼠关节炎机制研究
潘晓艺 黄颖 张军 徐晖 陆道敏 刘灿 凌益 安阳


【摘 要】目的:探討松萝酸经高迁移率族蛋白B1(HMGB1)-晚期糖基化终产物受体(RAGE)信号通路治疗胶原诱导性关节炎(CIA)大鼠关节炎的机制。方法:选取SPF级5周龄Wistar雌鼠
54只,随机分为空白对照组,模型对照组,松萝酸低、中、高剂量组和羟氯喹组,每组9只。除空白对照组外,其余各组采用Ⅱ型胶原乳剂建立CIA模型。松萝酸低、中、高剂量组分别给予2 mg·kg-1·d-1、
6 mg·kg-1·d-1、54 mg·kg-1·d-1松萝酸灌胃,羟氯喹组给予36 mg·kg-1·d-1羟氯喹灌胃,空白对照组及模型对照组则予以等量生理盐水灌胃。连续灌胃4周后,处死大鼠,收集血清,取滑膜组织,分别行HE染色病理检测,ELISA法检测白细胞介素-1β(IL-1β)、基质金属蛋白酶(MMP)、血管内皮生长因子(VEGF)含量,Western blot法检测HMGB1、RAGE mRNA表达水平;PCR法检测HMGB1、RAGE蛋白表达量。结果:与模型对照组比较,松萝酸中、高剂量组滑膜增生程度减低,炎性细胞浸润减少,血清HMGB1、IL-1β、MMP、VEGF表达显著下降(P < 0.05),且HMGB1、RAGE蛋白活性、mRNA含量明显降低(P < 0.05)。结论:松萝酸能减少炎性细胞浸润及滑膜细胞增殖,其机制可能与抑制HMGB-RAGE信号通路有关。
【关键词】 类风湿关节炎;胶原诱导性关节炎;松萝酸;HMGB1-RAGE信号通路;大鼠
Study on the Mechanism of Usnic Acid Treating Collagen Induced Arthritis in Rats Through HMGB1-RAGE Signal Pathway
PAN Xiao-yi,HUANG Ying,ZHANG Jun,XU Hui,LU Dao-min,LIU Can,LING Yi,AN Yang
【ABSTRACT】Objective:To investigate the mechanism of usnic acid in the treatment of collagen induced arthritis(CIA)in rats through HMGB1-RAGE signaling pathway.Methods:A total of 54 SPF grade five-week-old Wistar female mice were selected and randomly divided into a blank control group,a model control group,low,medium,and high dose groups of usnic acid,and a hydroxychloroquine group,with 9 mice in each group.Except the blank control group,the other groups used type Ⅱ collagen emulsion to establish CIA models.The low,medium,and high dose groups of usnic acid were given 2 mg·kg-1·d-1,6 mg·kg-1·d-1 and 54 mg·kg-1·d-1 usnic acid by gavage,while the hydroxychloroquine group was given 36 mg·kg-1·d-1 of hydroxychloroquine by gavage.The blank control group and the model control group were given equal amounts of physiological saline by gavage.After continuous gavage for four weeks,rats were euthanized,serum was collected,synovial tissue was taken,and HE staining and pathological detection were performed.ELISA was used to detect the content of IL-1β,MMP and VEGF,Western blot was used to detect the expression levels of HMGB1 and RAGE mRNA,and PCR method was used to detect the expression levels of HMGB1 and RAGE proteins.Results:Compared with the model control group,the medium and high-dose groups of usnic acid showed a decrease in synovial hyperplasia,inflammatory cell infiltration,and the expression of HMGB1,IL-1β,MMP and VEGF in serum significantly reduced(P < 0.05),and the protein activity of HMGB1 and RAGE,and the content of mRNA significantly reduced(P < 0.05).Conclusion:Usnic acid can reduce inflammatory cell infiltration and synovial cell proliferation,and its mechanism may be related to the inhibition of the HMGB-RAGE signaling pathway.
【Keywords】 rheumatoid arthritis;collagen induced arthritis;usnic acid;HMGB1-RAGE signaling pathway;rats
类风湿关节炎(rheumatoid arthritis,RA)是一种
临床常见的以关节慢性炎性反应,关节滑膜增生及血管翳形成为特点的自身免疫性疾病,属中医学“痹病”“尪痹”等范畴。研究发现,高迁移率族蛋白B1(HMGB1)在RA疾病进展中有着重要的促进作用,在RA患者滑膜组织、滑液甚至血清中,HMGB1表达水平显著升高[1-2],且与RA患者病情活动度呈正相关[3]。松萝为侗族医药,有除湿通络、清热解毒之功,主要用于治疗痹病。松萝酸为松萝干燥地衣提取物,分子式为C18H16O7,现代研究证实,松萝酸具有抗炎、镇痛、抑制血管生成、减少炎性渗出等作用[4]。课题组在前期的临床研究中证实,松萝的组方制剂可以有效改善RA患者的临床症状和体征[5],降低胶原诱导性关节炎(CIA)大鼠HMGB1 mRNA的表达量,抑制HMGB1的蛋白表达[6]。松萝酸经HMGB1-晚期糖基化终产物受体(RAGE)信号通路治疗RA研究未见文献报道。
因此,本实验拟通过建立CIA大鼠模型,探讨松萝酸经HMGB1-RAGE信号通路调控CIA大鼠关节滑膜炎症的可能作用机制,为民族医药治疗RA提供新的理论依据。
1 实验材料
1.1 实验动物 选取SPF级5周龄Wistar雌性大鼠54只,体质量150~180 g,购自湖北省实验动物研究中心,实验动物生产许可证号SCXK(鄂)2020-0018,喂养环境室温20~25 ℃、湿度70%左右,自由进食、自由饮水,适应环境1周后开始实验。
1.2 实验仪器 电热恒温鼓风干燥箱(上海精宏实验设备有限公司,型号DHG 9203A);PCR仪(东胜创新生物科技有限公司,型号EDC-810);全自动酶标仪(美国Thermo scientific,型号Multiskan MK3);垂直电泳槽(北京六一仪器厂,型号DYCZ-40);微型高速离心机(美国Labnet,型号C2500-R-230V);电热恒温培养箱(日本ASONE,型号ICV-450);离心机(湖南湘仪实验室仪器开发有限公司,型号HI650);轮转式病理切片机(德国Leica,型号RM 2016);生物显微镜(奥林巴斯,型号BX53)。
1.3 实验药品与试剂 松萝酸(CAS125-46-2,Solarbio,批号IU0130);羟氯喹(Solarbio,批号IH0720);磷酸酶抑制剂(碧云天,批号S1873);BCA蛋白浓度测定试剂盒(碧云天,批号P0010),RIPA裂解液(碧云天,批号P0013B);HMGB1检测试剂盒(武汉优尔生商贸有限公司,批号SEA399Ra);基质金属蛋白酶-1(MMP-1)检测试剂盒(武汉优尔生商贸有限公司,批号SEA097Ra);白细胞介素-1β(IL-1β)
检测试剂盒(欣博盛,批号ERC007.48);血管内皮生长因子(VEGF)试剂盒(Elabscience,批号E-EL-R2603c);苏木素(Sigma,批號H9627);抗β-actin抗体(武汉博士德生物工程有限公司,批号BM0627);抗HMGB1抗体(武汉三鹰生物技术有限公司,批号10829-1-AP);抗RAGE抗体(武汉三鹰生物技术有限公司,批号bs-4999R)。
2 方 法
2.1 动物模型制备 按随机数字表进行编号,将54只Wistar大鼠随机分为空白对照组,模型对照组,松萝酸低、中、高剂量组和羟氯喹组,每组
9只。模型制备方式为将Ⅱ型胶原溶于0.1 mol·L-1的醋酸中,搅拌溶解,配成2 mg·mL-1溶液,置4 ℃冰箱过夜。与弗氏完全佐剂等体积混合,乳化配制成Ⅱ型胶原乳剂,分别于大鼠尾根部多点皮内注射0.1 mL致炎,复制稳定的CIA大鼠模型[7]。模型制备成功评价:采用关节炎评分法,即模型制备成功的大鼠趾端至踝关节红肿,关节炎症评分 >
4分[8]。
2.2 给药剂量 根据课题组前期的药代学研究结果,本研究给药剂量松萝酸低、中、高剂量组分别为2 mg·kg-1·d-1、6 mg·kg-1·d-1、54 mg·kg-1·d-1。
羟氯喹成人用量400 mg·d-1,参照60 kg成人与动物药物剂量换算系数表[9],大鼠与人的对应换算系数为W = 5.4,羟氯喹组给予羟氯喹
36 mg·kg-1·d-1灌胃,空白对照组与模型对照组给予等量生理盐水灌胃。
2.3 样品采集 灌胃4周后麻醉处死大鼠,股动脉取血4~6 mL,室温静置30 min后,置于离心机以3000 r·min-1离心15 min,离心半径10 cm,取上清,分装于Ep管内,标记后保存于-80 ℃超低温保存箱内待测。沿大鼠膝关节侧面髌骨外缘纵行切开,钝性分离关节囊的纤维层和滑膜层,无菌剥离滑膜组织,快速置于Ep管中,液氮保存待测。
2.4 酶联免疫吸附测定(ELISA)法检测HMGB1、IL-1β、MMP、VEGF水平 解冻血清,按照试剂盒设空白孔、标准孔、待测样品孔,分别加样,36 ℃孵育90 min,洗板5次,加入酶标试剂,36 ℃反应,温育1 h,洗板5次,加入TMB
100 μL,覆膜36 ℃避光,温育15 min,后加入终止液,测量OD值,进行计算。
2.5 逆转录荧光实时定量(RT-PCR)法检测大鼠膝关节滑膜HMGB1、RAGE mRNA表达水平 提取总RNA,逆转录合成cDNA,反应条件:50 ℃ 2 min,95 ℃10 min;95 ℃ 30 s,60 ℃ 30 s,40个循环。每个样本3个副孔,重复3次。引物由武汉巴菲尔生物技术服务有限公司合成,引物设计见表1。
2.6 蛋白免疫印迹(WB)法检测HMGB1、RAGE蛋白表达量 取大鼠滑膜组织于匀浆器进行研磨、裂解,离心,取上清,即为大鼠滑膜蛋白,用BCA蛋白浓度试剂盒进行蛋白定量,经水浴、SDS-
PAGE电泳后转膜至PVDF膜,封闭1 h,一抗4 ℃
过夜,反复洗膜后孵育,ECL化学发光试剂盒显色,
扫描胶片,用图像分析测定各条带吸光度(A)值作定量分析。
2.7 关节滑膜病理形态学观察 取关节滑膜、软骨组织,4%多聚甲醛溶液,石蜡包埋,常规HE和胶原纤维染色。显微镜下观察滑膜组织的炎性细胞浸润以及血管翳形成情况,图像分析系统分析结果。
2.8 统计学方法 采用SPSS 22.0软件进行统计分析。计量资料符合正态分布以表示,采用t检验。以P < 0.05为差异有统计学意义。
3 结 果
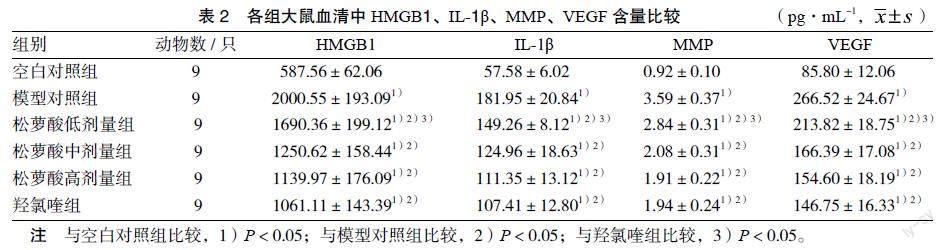
3.1 各组大鼠血清中HMGB1、IL-1β、MMP、VEGF含量比较 与空白对照组比较,模型对照组,松萝酸低、中、高剂量组,羟氯喹组的HMGB1、IL-1β、MMP、VEGF含量均升高(P < 0.05);与模型对照组比较,松萝酸中、高剂量组及羟氯喹组HMGB1、IL-1β、MMP、VEGF含量均降低(P < 0.05);与羟氯喹组比较,松萝酸低剂量组HMGB1、IL-1β、MMP、VEGF含量升高(P < 0.05)。见表2。
3.2 各组大鼠滑膜组织中HMGB1、RAGE mRNA表达比较 与空白对照组比较,模型对照组,松萝酸低、中、高剂量组,羟氯喹组大鼠滑膜组织中HMGB1、RAGE mRNA表达显著增加(P < 0.05);与模型对照组比较,松萝酸中、高剂量组及羟氯喹组HMGB1、IL-1β、MMP、VEGF mRNA表达减少(P < 0.05);与羟氯喹组比较,松萝酸低剂量组HMGB1、RAGE mRNA表达差异有统计学意义(P < 0.05)。见表3。
3.3 各组大鼠滑膜组织中HMGB1、RAGE蛋白表达比较 与空白对照组比较,模型对照组,松萝酸低、中、高剂量组,羟氯喹组大鼠滑膜组织中HMGB1、RAGE蛋白表达显著增加(P < 0.05);與模型对照组比较,松萝酸中、高剂量组及羟氯喹组HMGB1、RAGE蛋白表达减少(P < 0.05);与羟氯喹组比较,松萝酸低剂量组HMGB1、RAGE蛋白表达增多(P < 0.05)。见图1,表4。
3.4 各组大鼠关节滑膜病理形态学观察 除空白对照组外,其余各组可见明显炎性细胞浸润及血管翳的形成,与模型对照组比较,松萝酸中、高剂量组滑膜增生程度减低,炎性细胞浸润减少。见图2。
4 讨 论
RA属中医学“痹病”范畴。《素问·痹论篇》记载:“风寒湿三气杂至,合而为痹也。”在侗族医学中,RA属“风湿痛”范畴,多因外感风、寒、湿、热等邪,致使脉道不通、气血水津代谢异常,机体蕴生“邪热”,疼痛乃邪热蕴阻关节之外象。侗医名家吴定元所著《草木春秋》中记载:“筋痛拘急者,血气热也……。”对风湿痛的发病特征进行了描述,并提出“赶邪、消水”的治法,认为有邪当驱赶,肿胀宜消水。用药方面,侗医学认为“药有气无味者为阳,主表散、上升,有味无气者为阴,主里、下降,清淡者利水,有毛有刺者追风”“邪气犯于表,水湿停于内,用药以升散,有如提壶揭盖,热气上升、水液自流”,体现了阴阳协调、不分不离的思想。侗药松萝性味甘、平,有气无味而属阳,生于树颠而下垂,位阳兼有阴的属性,阴阳一体,表里均可,有除湿通络、清热解毒之功,可治风湿痹痛、跌打损伤。
RA发病错综复杂,病因及发病机制尚不清楚,主要病理改变为滑膜增生,伴随着多种细胞因子异常分泌。HMGB1-RAGE信号通路在RA发生、发展过程中起着重要作用。HMGBl是一种广泛表达、高同源性、高度保守的低分子量非组蛋白核蛋
白[10-13]。在机体受到外源性或内源性炎症刺激,或细胞凋亡、坏死以及免疫细胞活化等情况下,位于细胞核内的HMGB1可被释放至细胞核外。IL-1β作为促炎因子在RA的滑膜增生及病程进展中十分重要,可促进免疫细胞的浸润及MMP的释放,是导致炎症产生和关节破坏的关键因子[14]。RAGE是免疫球蛋白超家族中的一员,作为一种膜配体蛋白,已经证实在多种慢性炎症性疾病中表达增加并发挥关键性作用[15]。当配体作用于RAGE后,可以激活信号通路引起下游的一系列反应,在RAGE激活的众多配体中,HMGB1是亲和力最高的一种。在HMGB-RAGE信号通路中,一方面,HMGB1通过与上游致炎因子IL-1β相互作用形成正反馈[16],使炎症反应得以维持;另一方面,RA患者滑膜组织中RAGE表达上调[17],HMGB1与RAGE相结合后,能诱导VEGF[18],以及下游致炎因子MMP[19]、IL-1β分泌,促进炎症发生,引起血管翳的形成,最终导致关节破坏。因此,本研究检测了松萝酸对CIA大鼠血清以及关节滑膜HMGB1-RAGE信号通路的影响,结果显示,松萝酸能有效降低CIA大鼠血清及滑膜HMGB1、RAGE蛋白的表达,说明松萝酸能抑制HMGB1-RAGE信号通路和相关炎症因子的表达,以及血管翳的形成,从而起到预防骨破坏,保护关节的
作用。
综上所述,松萝酸能降低CIA大鼠关节炎症状及血清中炎性因子表达,抑制滑膜增生及炎性细胞浸润,其作用机制可能与HMGB1-RAGE信号通路有关,但是否存在其他作用机制,仍待进一步研究。
参考文献
[1] MUSUMECI D,ROVIELLO GN,MONTESARCHIO D.An overview on HMGB1 inhibitors as potential therapeutic agents in HMGB1-related pathologies[J].Pharmacol Ther,2014,141(3):347-357.
[2] WANG LH,WU MH,CHEN PC,et al.Prognostic significance of high-mobility group box protein 1 genetic polymorphisms in rheuma-toid arthritis disease out-
come[J].Int J Med Sci,2017,14(13):1382-1388.
[3] 陈真富,高利霞,庞婷婷,等.类风湿关节炎患者血清高迁移率族蛋白1水平变化及与疾病活动和骨破坏的关系[J].中国病案,2021,22(7):90-93.
[4] 郝凯华,韩涛,胡鹏斌.松萝酸抑制小鼠H22肿瘤生长及作用机制研究[J].中国药师,2016,19(1):29-32.
[5] 安阳,陆道敏,马武开,等.松筋通络方对胶原性关节炎大鼠血清IL-1、IL-1β、TNF-α及滑膜病理的影响[J].风湿病与关节炎,2013,2(11):32-34.
[6] 雷玉梅,安阳,张军,等.松萝提取物对CIA大鼠HMGB1介导的炎症因子表达的影响[J].中医药学报,2022,50(2):28-32.
[7] 马武开,陆道敏,姚血明,等.苗药金乌健骨方对胶原诱导关节炎模型大鼠NF-κB及IL-17表达的影
响[J].中国中西医结合杂志,2016,36(5):624-628.
[8] 熊国林,黄海啸,谢玲,等.类风湿关节炎大鼠模型的制备[J].解放军医学杂志,2007,2(13):121-123.
[9] 黄继汉,黄晓晖,陈志扬.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[10] YANG H,TRACEY KJ.High mobility group box 1(HMGB1)[J].Crit Care Med,2005,33(12 Suppl):
S472-S474.
[11] YANG H,WANG H,CHAVAN SS,et al.High mobility
group box protein 1(HMGB1):the prototypical endogenous danger molecule[J].Mol Med,2015,21
(S1):S6-S12.
[12] ANDERSSON U,WANG H,PALMBLAD K,et al.High mobility group 1 protein(HMG-1)stimulates proinflammatory cytokine synthesis in human monocytes[J].J Exp Med,2000,192(4):565-570.
[13]徐力,劉晶.HMGB1在评价类风湿关节炎疾病活动度中的意义及与RA-ILD关系初探[J].风湿病与关节炎,2015,4(4):10-12,19.
[14] 包喜文,李振英,吴霞,等.黑骨藤追风活络胶囊对胶原诱导性关节炎大鼠IL-1β、IFN-γ、IL-15的影
响[J].中国中医急症,2018,27(2):293-295,308.
[15] 陈文革,杨朝晖,黄高.类风湿关节炎滑膜组织RAGE的表达及意义[J].中国免疫学杂志,2014,30(9):1256-1258.
[16] ZHU B,ZHU Q,LI N,et al.Association of serum/plasma high mobility group box 1 with autoimmune diseases:a systematic review and Meta-analysis[J].Medicine (Baltimore),2018,97(29):e11531-e11539.
[17] PULLERITS R,SCHIERBECK H,UIBO K,et al.High mobility group box protein 1-A prognostic marker for structural joint damage in 10-year follow-up of patients with juvenile idiopathic arthritis[J].Semin Arthritis Rheum,2017,46(4):444-450.
[18] SEONG RJ,HYUN SD.Damage-associated molecular patterns in inflammatory diseases[J].Immune Network,2018,24(41):4622-4634.
[19] MAHMOUD HA,SOLAHAYE KS,AGHAJANI H,et al.
Quercetin decreases Th17 production by down-regulation of MAPK-TLR4 signaling pathway on T cells in dental pulpitis[J].J Dent,2018,19(4):259-264.
收稿日期:2023-05-17;修回日期:2023-06-22