唑来膦酸预防骨质疏松性椎体压缩性骨折术后椎体再发骨折的疗效分析
钱黎,王大寿,潘奇,肖杨,段斌武,陈黔
随着人口老龄化,骨质疏松症的发病率逐年增加,骨质疏松性椎体压缩骨折(OVCF)已成为临床常见的脊柱病变[1]。OVCF 可致腰痛、身高降低、脊柱畸形、肺功能降低,并增加患者的卧床时间。经皮椎体成形术(PVP)具有损伤小、手术时间短、恢复快、并发症少的优点,已成为OVCF 的首选术式[2-3]。但仍有部分患者PVP 术后椎体再发骨折,椎体再骨折可严重影响患者的生活质量,因此防止骨量持续丢失、预防椎体再骨折极为重要[4-5]。目前临床上用于治疗骨质疏松症的药物有补钙剂、雌激素、降钙素、甲状旁腺激素、双膦酸盐等。其中,唑来膦酸是一种通过促进破骨细胞凋亡来抑制破骨细胞活性的药物,是目前临床使用最多的双膦酸盐,其可增加骨密度(BMD),降低骨重塑率和椎体再骨折的风险[6]。本研究通过观察椎体成形术后注射唑来膦酸的OVCF 患者骨代谢和椎体再骨折的发生情况,确定唑来膦酸对椎体骨折的保护作用。
1 对象与方法
1.1 研究对象 回顾性分析2018年1月—2020年12月我院疼痛科进行PVP手术的152例OVCF患者的临床资料。纳入标准:(1)单节段2 周内在胸腰椎或腰椎区原发OVCF。(2)MRI表现为T1低信号、T2高信号。(3)年龄60~85岁,骨密度T值≤-2.5 或伴有脆性骨折史,即腰痛,局部棘突压痛,和(或)伴相应椎体叩痛。排除标准:(1)因恶性肿瘤、感染和(或)其他疾病导致继发性椎体骨折或继发性骨质疏松。(2)术前、术后有明显神经功能障碍。(3)椎体后壁破裂者。(4)椎间隙狭窄者。(5)对双膦酸盐过敏者。(6)既往使用过抗骨质疏松药物者。根据术后唑来膦酸输注情况,将患者分为唑来膦酸组(68例)和对照组(84例)。
1.2 手术操作 PVP 患者俯卧位,胸部和腹部下放置垫片。在消毒后给予2%盐酸利多卡因局麻。在整个手术过程中,麻醉师全程监测患者的血压、体温、心电图、呼吸、血氧饱和度等生命体征。在脊柱旁区域做一个小的皮肤切口,对应于压缩性骨折的水平,在透视引导下使用10号骨活检针行经皮椎弓根入路。检查前后侧位后,将针推进塌陷椎体前1/3处。将20 g PMMA 粉末与3 g 硫酸钡混合在一个10 mL 的注射器中,通过螺旋注射器小心地输送,并进行监测。将骨水泥以控制的速度插入椎体,直到椎体后1/3 被填充。术后鼓励患者佩戴护具下床行走。所有患者出院后接受我科骨折联络服务,并定期返回医院进行随访,记录2 年内椎体再发骨折情况。
1.3 术后治疗 唑来膦酸组患者使用唑来膦酸前确保肌酐清除率>35 mL/min,血钙不低于2.13 mmol/L。在术后1 周、12个月和24个月静脉滴注唑来膦酸(规格:5 mg∶100 mL,正大天晴药业集团股份有限公司,国药准字H20113138),单剂量5 mg,1 年1 次,注射时间不少于15 min,用药后至少10 d内每日补充钙50 mg 和维生素D 800 IU。给予唑来膦酸前后,静脉给予生理盐水500 mL,吲哚美辛100 mg预防急性期反应。对照组在相同时间点用500 mL生理盐水替代唑来膦酸。其他术前及术后的基础抗骨质疏松治疗和康复措施与唑来膦酸组相似。
1.4 观察指标 收集2组患者入院时一般临床资料,包括性别、年龄、基础疾病史、体质量指数(BMI)以及术前、术后3、6、12个月的基线BMD、疼痛视觉模拟评分(VAS)、血清I型前胶原氨基端肽(P1NP)、β-胶联降解产物(β-CTX)水平。
1.5 检测方法 采用美国HOLOGIC公司的双能X线骨密度测量仪测量BMD T值,在T≤-2.5时判定为骨质疏松[7]。采用疼痛VAS 评定,总分0~10 分,分数越高疼痛程度越强。采用酶联免疫吸附试验测定血清P1NP和β-CTX 水平,试剂盒购自上海联祖生物科技有限公司。
1.6 统计学方法 采用SPSS 22.0 进行数据分析,符合正态分布的计量资料以均数±标准差()表示,组间比较采用独立样本t检验,计数资料以例(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料比较 2 组患者性别、年龄、BMI、骨折部位、PMMA 和手术时间比较差异无统计学意义(P>0.05),见表1。
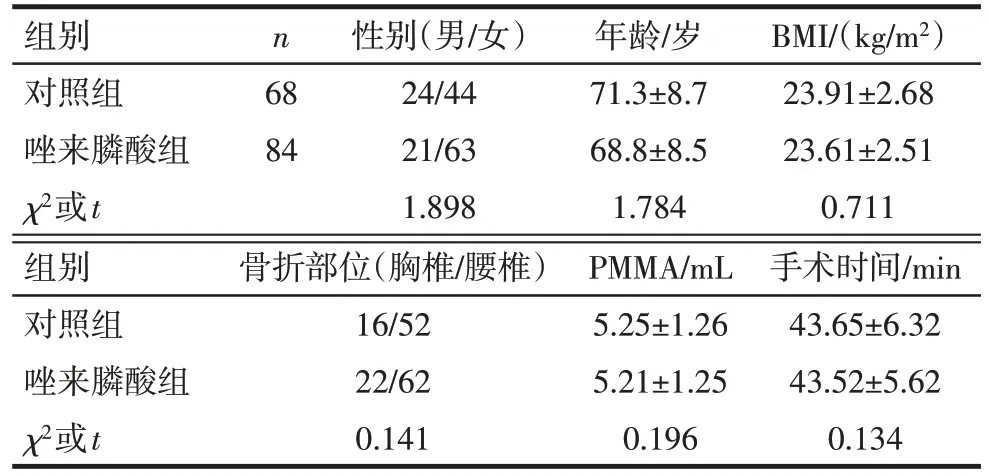
Tab.1 Basic clinical data of inpatients in both groups表1 2组住院患者基础临床资料
2.2 术后1年内BMD T值变化 2组术前BMD T值差异无统计学意义,术后3、6、12 个月时,唑来膦酸组的BMD T值均高于对照组(P<0.01),见表2。
Tab.2 Comparison of T values of bone mineral density before surgery,3,6 and 12 months after surgery between the two groups表2 2组术前及术后3、6、12月BMD T值比较 ()
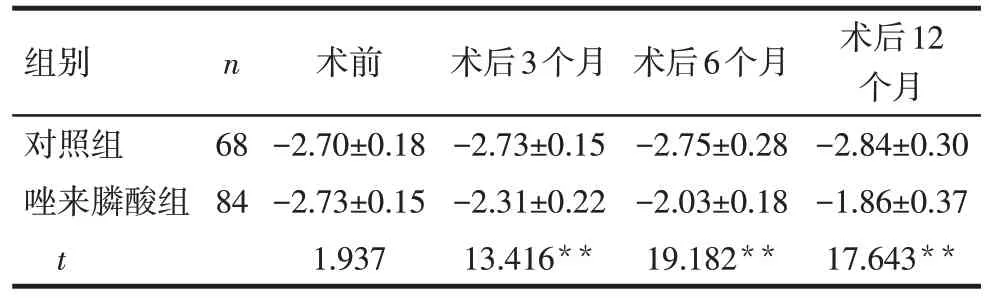
Tab.2 Comparison of T values of bone mineral density before surgery,3,6 and 12 months after surgery between the two groups表2 2组术前及术后3、6、12月BMD T值比较 ()
**P<0.01。
组别对照组唑来膦酸组t n 68 84术前-2.70±0.18-2.73±0.15 1.937术后3个月-2.73±0.15-2.31±0.22 13.416**术后6个月-2.75±0.28-2.03±0.18 19.182**术后12个月-2.84±0.30-1.86±0.37 17.643**
2.3 术后1年内疼痛VAS 变化 2组术前疼痛VAS差异无统计学意义,术后3、6、12 个月时,唑来膦酸组的疼痛VAS较对照组下降(P<0.05),见表3。
Tab.3 Comparison of pain VAS before surgery,3,6 and 12 months after surgery between the two groups表3 2组术前及术后3、6、12月疼痛VAS比较(分,)
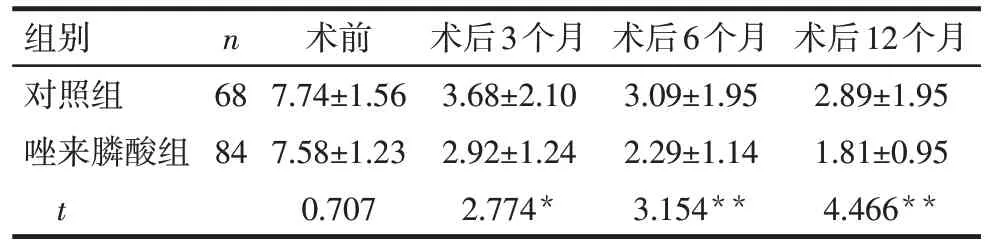
Tab.3 Comparison of pain VAS before surgery,3,6 and 12 months after surgery between the two groups表3 2组术前及术后3、6、12月疼痛VAS比较(分,)
*P<0.05,**P<0.01。
组别对照组唑来膦酸组t n 68 84术前7.74±1.56 7.58±1.23 0.707术后3个月3.68±2.10 2.92±1.24 2.774*术后6个月3.09±1.95 2.29±1.14 3.154**术后12个月2.89±1.95 1.81±0.95 4.466**
2.4 术后1年内血清β-CTX、P1NP水平变化 术后3、6、12 个月时,唑来膦酸组β-CTX 和P1NP 较对照组下降(P<0.01),见表4、5。
Tab.4 Comparison of β-CTX levels before surgery and 3,6,12 months after surgery between the two groups表4 2组术前及术后3、6、12月β-CTX水平比较(µg/L,)
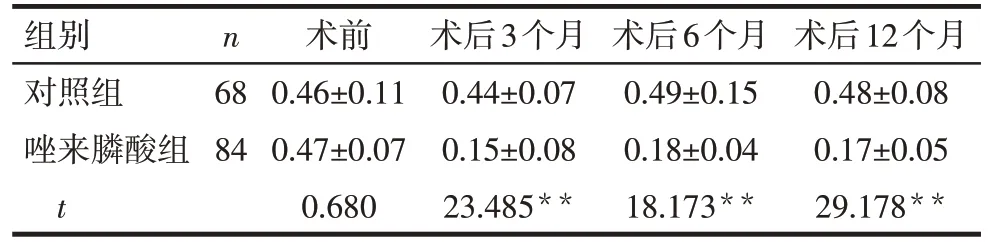
Tab.4 Comparison of β-CTX levels before surgery and 3,6,12 months after surgery between the two groups表4 2组术前及术后3、6、12月β-CTX水平比较(µg/L,)
**P<0.01。
组别对照组唑来膦酸组t n 68 84术前0.46±0.11 0.47±0.07 0.680术后3个月0.44±0.07 0.15±0.08 23.485**术后6个月0.49±0.15 0.18±0.04 18.173**术后12个月0.48±0.08 0.17±0.05 29.178**
Tab.5 Comparison of P1NP levels before and 3,6,and 12 months after surgery between the two groups表5 2组术前及术后3、6、12月P1NP水平比较(µg/L,)

Tab.5 Comparison of P1NP levels before and 3,6,and 12 months after surgery between the two groups表5 2组术前及术后3、6、12月P1NP水平比较(µg/L,)
**P<0.01。
组别对照组唑来膦酸组t n 68 84术前42.42±12.96 42.34±13.58术后3个月44.26±8.07 17.24±2.55术后6个月43.59±11.14 18.52±2.75术后12个月42.88±12.16 18.62±3.07 0.68028.971**19.904**17.617**
2.3 术后椎体再骨折发生率比较 术后1年唑来膦酸组再发椎体骨折3 例(4.41%),对照组6 例(7.14%),2 组再骨折率差异无统计学意义(χ2=1.037,P>0.05);术后2年唑来膦酸组再发椎体骨折率(5.95%,5/84)低于对照组(16.18%,11/68),差异有统计学意义(χ2=4.171,P<0.05)。
3 讨论
OVCF 是最常见的骨质疏松性骨折,在骨折前并没有明显的临床表现。流行病学调查显示OVCF患者PVP术后再发骨折率约30%[8]。其中多数再发骨折位于PVP 术后邻近椎体,增加了患者疾病痛苦及医疗费用负担[9],因此如何预防PVP 术后再发骨折尤为重要。
目前普遍认为PVP术后再发骨折机制包括两方面:(1)PVP术后伤椎弹性模量增高,邻椎应力集中,易发生OVCF[10]。(2)骨密度降低导致骨量减少,骨脆性增加[11]。因此,骨质疏松患者的抗骨质疏松治疗和轻微创伤的预防尤为重要。唑来膦酸目前已成为治疗骨质疏松症的一线药物,其主要分子靶点是破骨细胞中反式异戊二烯延长酶,有强大的抗骨吸收作用[12]。接受唑来膦酸治疗的患者依从性更高,因为唑来膦酸只需要每年静脉滴注1 次,而其他两种双膦酸盐则需要每天或每周口服。美国食品药品监督管理局(FDA)在2008 年扩大了唑来膦酸的临床使用范围,并将其作为老年髋部骨折患者的常规用药,以防止腰椎部位发生骨折。张强等[13]发现应用唑来膦酸后老年OVCF 患者在术后各时间点的BMD T 值均高于对照组,伤椎再发骨折率和邻椎再发骨折率均低于对照组。本研究中,术后各时间点唑来膦酸组的BMD T 值均高于对照组,同时术后3个月时唑来膦酸组疼痛VAS 低于对照组,术后2 年椎体再发骨折率均低于对照组,这一结果与常青等[14]报道一致,提示唑来膦酸治疗可以更好地减少骨吸收,降低术后不适感,减少椎体再骨折的发生。
P1NP 和β-CTX 是骨细胞在代谢活动中分泌的特定物质,反映骨转化水平。P1NP 是成骨细胞分泌,作为骨形成标志物,β-CTX 是Ⅰ型胶原分解的产物,可作为骨吸收的特异指标。本研究中唑来膦酸组术后3、6、12个月β-CTX和P1NP的水平相比对照组降低,与相关的研究结果一致[15]。本研究证实唑来膦酸组在术后3、6、12 个月的骨代谢指标较对照组明显好转,对于预防椎体再发骨折具有明显优势,进一步证实使用唑来膦酸作为应对骨质疏松症患者椎体再发骨折的预防药物比单纯保守治疗更有效。为了减少再发椎体骨折的发生率,笔者建议针对骨质疏松患者,在行椎体成形术前后都应进行标准化的抗骨质疏松治疗,基本治疗包括改变生活方式,补充维生素D和钙制剂。
综上所述,应用唑来膦酸在接受PVP 手术的患者中产生了有益的结果,通过唑来膦酸的治疗可以降低PVP患者术后2年的椎体再骨折的风险。但是本研究中选取的患者数量较少,随访时间有限,在后续的研究中将选取更多的患者和更长的随访时间,以提高研究结论的可靠性。

