钙蛋白酶2通过诱导三阴乳腺癌细胞上皮间质转化抵抗紫杉醇的机制探讨
陈聪,吴元肇,郑克思,应文兵,胡逸人
三阴性乳腺癌是具有较强侵袭性表型的乳腺癌亚型,易复发和转移,且无法进行内分泌治疗和人表皮生长因子受体2 靶向治疗[1-2]。化学治疗仍然是三阴性乳腺癌的重要治疗手段,但随着治疗的推进,肿瘤细胞逐渐出现药物抵抗而产生继发性耐药,最终导致治疗失败[3]。因此,如何解决药物抵抗具有重要临床意义。钙蛋白酶-2(Calpain-2)是广泛表达于人体的钙蛋白酶家族成员,其主要通过蛋白水解活性发挥其生物学作用[4]。研究显示,Calpain-2在肾细胞癌[5]、乳腺癌[6]、胰腺癌[7]等多种恶性肿瘤中发挥作用,参与调控细胞侵袭、迁移及转移。此外,Calpain-2 还在肺癌[8]和结直肠癌[9]化疗抵抗中发挥重要作用。但在三阴性乳腺癌中,Calpain-2与药物抵抗的关系及相关机制还不清楚。本研究通过外源性过表达Calpain-2,观察其在三阴性乳腺癌细胞抵抗紫杉醇(PTX)中的作用及机制,为临床治疗提供基础理论支持。
1 材料与方法
1.1 主要材料 人三阴性乳腺癌MDA-MB-231细胞购自南京科佰生物科技有限公司;Calpain-2过表达质粒和空载质粒购自上海和元生物技术有限公司;脂质体2000 购自上海Invitrogen 公司;DMEM 高糖培养基、青-链霉素混合液、噻唑蓝(MTT)购自北京索莱宝科技有限公司。Calpain-2 抗体、E-钙黏蛋白(E-cadherin)抗体、N-钙黏蛋白(N-cadherin)抗体、波形蛋白(Vimentin)抗体、yes 相关蛋白(YAP)抗体和甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自武汉云克隆科技股份有限公司;小鼠抗人大肿瘤抑制基因1(LATS1)抗体、p-LATS1抗体、p-YAP抗体、山羊抗小鼠IgG抗体及山羊抗小鼠IgG(H+L)Alexa Fluor 488 二抗购自上海爱必信生物科技有限公司;YAP抑制剂XMU-MP-1购自美国MCE公司;胎牛血清(FBS)购自美国Gibco 公司。多功能酶标仪(型号SpectraMax 190)购自美国Molecular Devices 公司;全自动数码凝胶成像分析仪(型号Tanon 2500)购自上海天能公司;高速低温离心机(型号AllegraTM21R)购自美国贝克曼公司;倒置荧光显微镜(型号IX71)购自日本奥林巴斯公司。
1.2 方法
1.2.1 细胞培养、转染及分组 将MDA-MB-231 细胞接种于含10%FBS和1%青-链霉素混合液的高糖DMEM培养基,在37 ℃、5%CO2培养箱中培养。取对数生长期细胞,以1×105个/孔接种于6 孔板中培养过夜。次日,将10 µL Calpain-2过表达质粒和空载质粒加入100µL高糖DMEM培养基中,并静置5 min。各向100µL 高糖DMEM 培养基中加入20µL脂质体2000,并静置5 min。将各质粒稀释液与脂质体2000稀释液混匀静置20 min。取出细胞,弃去旧培养基并以PBS 清洗,加入上述混合液,补加800µL 高糖DMEM 培养基,置于培养箱培养10 h。而后更换为全培养基继续培养。将转染Calpain-2过表达质粒和空载质粒的细胞设为过表达组和空载体组,同时以不做转染的正常细胞作为空白组。蛋白质免疫印迹实验对Calpain-2蛋白表达进行验证。
1.2.2 MTT 法检测细胞存活率 细胞以8 000 个/孔接种于96孔板中,以0、1、5、15、25、50 nmol/L PTX 处理细胞48 h,同时,以DMSO 处理细胞作为溶剂对照,以未处理的细胞作为空白对照。药物处理结束后每孔加入15µL MTT(5 g/L)溶液于培养箱孵育4 h。弃去培养液,加入150µL MDSO 溶解结晶后检测570 nm波长处吸光度值,实验重复3次。细胞存活率(%)=(实验孔-空白对照孔)/(溶剂对照孔-空白对照孔)×100%。计算细胞存活率为50%时的药物浓度,即半数抑制浓度(IC50)。
1.2.3 免疫荧光法检测细胞YAP 蛋白分布 将细胞接种于35 mm激光共聚焦专用培养皿中,过表达组和空载体组细胞转染10 h后,细胞更换全培养基继续培养24 h。弃去旧培养基,以4%多聚甲醛和免疫组织细胞通透液分别处理10 min。细胞以10%正常山羊血清封闭1 h 后,于4 ℃孵育YAP 抗体过夜。次日洗去一抗并孵育IgG(H+L)Alexa Fluor 488 二抗1 h,PBST 洗去二抗后加入DAPI 避光孵育5 min。细胞用PBST 洗3 遍,滴加抗荧光猝灭封片液封片,于荧光显微镜下成像并拍照。实验重复3次。
1.2.4 蛋白质免疫印迹实验检测蛋白表达 3 组细胞用含1×蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液裂解细胞10 min。在4 ℃、14 000×g离心20 min 并收集上清液。采用BCA蛋白定量法检测上清液蛋白浓度,随后以蛋白上样缓冲液制备蛋白样品。样品经SDS-PAGE 电泳和转印法将蛋白分离并转印至PVDF 膜上。将载有蛋白的PVDF 膜于4 ℃孵育Calpain-2(1∶1 000)、E-cadherin(1∶2 000)、N-cadherin(1∶1 000)、Vimentin(1∶1 000)、LATS1(1∶1 000)、p-LATS1(1∶1 000)、p-YAP(1∶1 000)及YAP(1∶1 000)抗体过夜。次日洗去一抗后孵育对应山羊抗兔IgG抗体或山羊抗小鼠IgG抗体1 h。去除二抗后用ECL化学发光试剂盒在凝胶成像仪下对蛋白条带进行成像。实验重复3次。
1.2.5 XMU-MP-1 干预 以XMU-MP-1(1 µmol/L)处理过表达组细胞24 h 作为XMU-MP-1+过表达组,同时培养空载体组和过表达组细胞作为对照。MTT 法检测PTX 对各组细胞存活的影响,蛋白质免疫印迹实验检测N-cadherin、Vimentin和E-cadherin蛋白表达。实验重复3次。
1.3 统计学方法 以Graphpad 7.0 软件进行数据分析。计量数据以均数±标准差()表示,多组间数据比较采用单因素方差分析,组间多重比较使用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 Calpain-2 增强MDA-MB-231 细胞抵抗PTX 空载体组Calpain-2 蛋白表达与空白组差异无统计学意义,而过表达组Calpain-2蛋白表达高于空载体组(P<0.05),见图1A、B。PTX 处理后空白组和空载体组细胞存活率差异无统计学意义,但与空载体组相比,过表达组细胞存活率升高(P<0.05),见图1C。计算PTX 对各组细胞的IC50发现,过表达组IC50高于空载体组(P<0.05),见图1D。
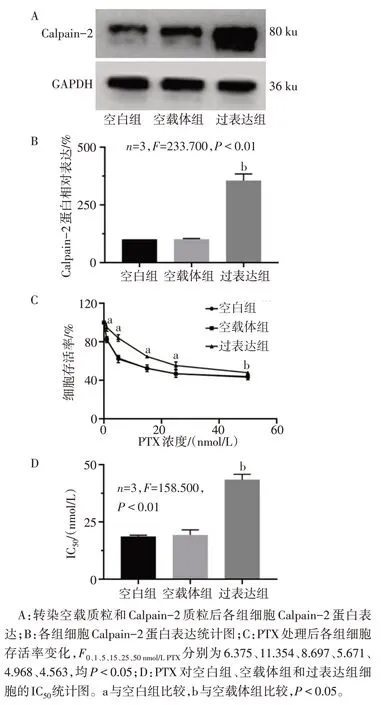
Fig.1 Role of Calpain-2 in the resistance of triple-negative breast cancer cells to PTX图1 Calpain-2在三阴性乳腺癌细胞抵抗PTX中的作用
2.2 Calpain-2 诱导三阴性乳腺癌细胞EMT 相较于空白组,空载体组E-cadherin、N-cadherin 及Vimentin 蛋白表达差异无统计学意义;与空载体组相比,过表达组细胞N-cadherin 和Vimentin 蛋白表达上调,E-cadherin 蛋白表达下调(P<0.05),见图2。
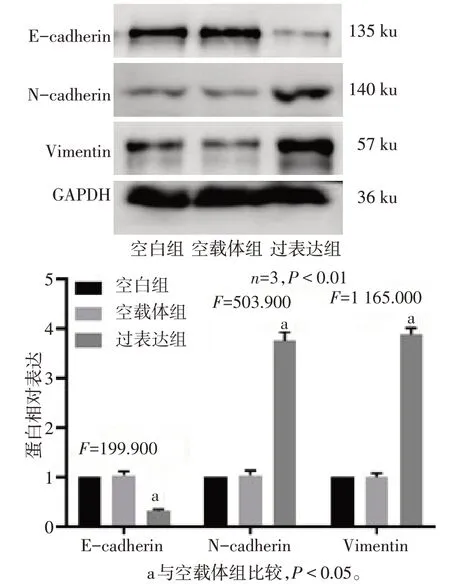
Fig.2 Effect of Calpain-2 on EMT of triple-negative breast cancer cells图2 3组细胞EMT相关蛋白表达水平变化
2.3 Calpain-2 诱导YAP 磷酸化及胞浆转移 相较于空白组,空载体组p-LATS1和p-YAP蛋白表达差异无统计学意义;与空载体组相比,过表达组p-LATS1 和p-YAP 蛋白表达上调(P<0.05),见图3。与空载体组相比,过表达组细胞核内YAP 分布减少,见图4。
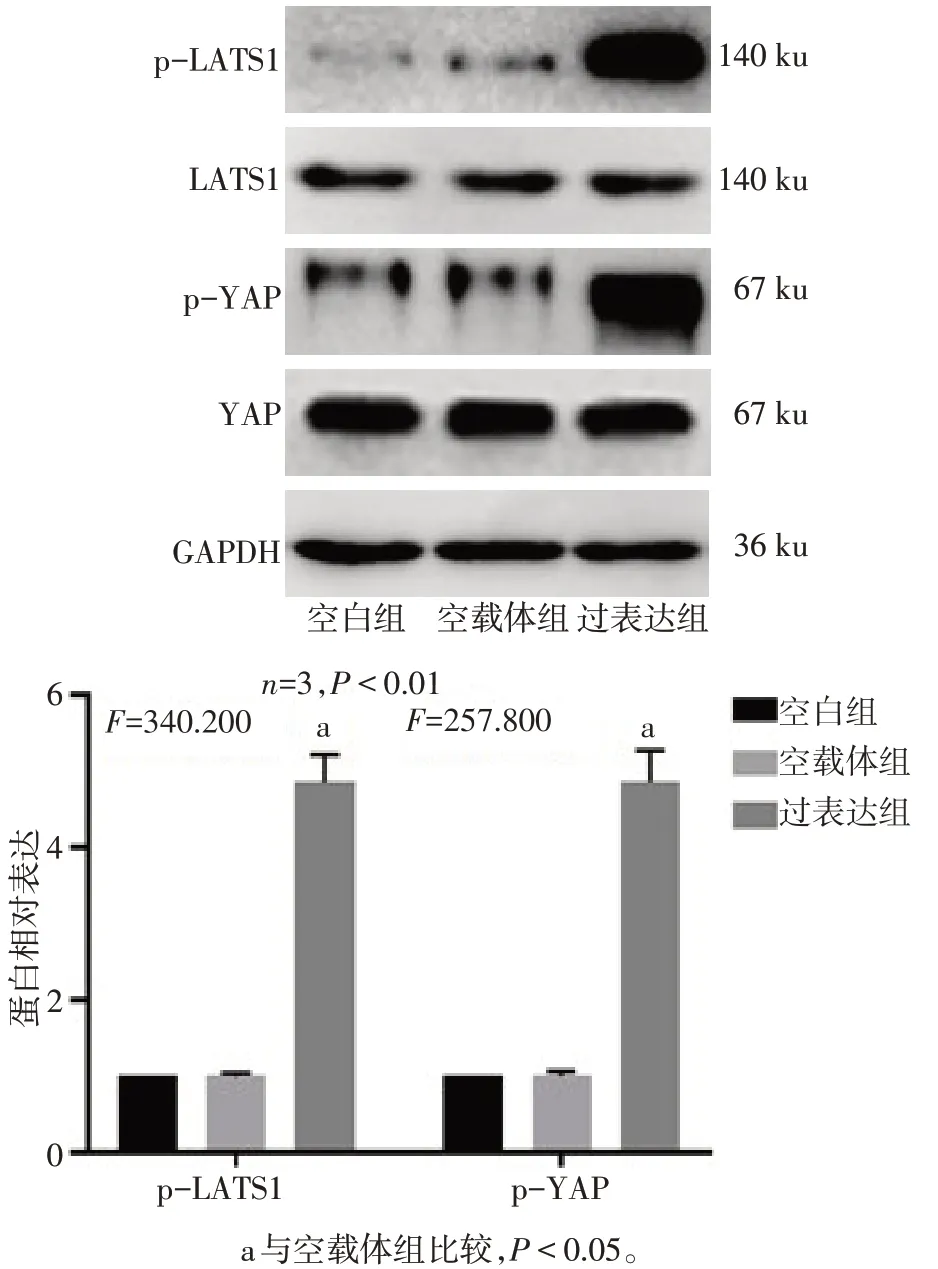
Fig.3 Effect of Calpain-2 on the expression of YAP图3 Calpain-2对YAP表达的影响
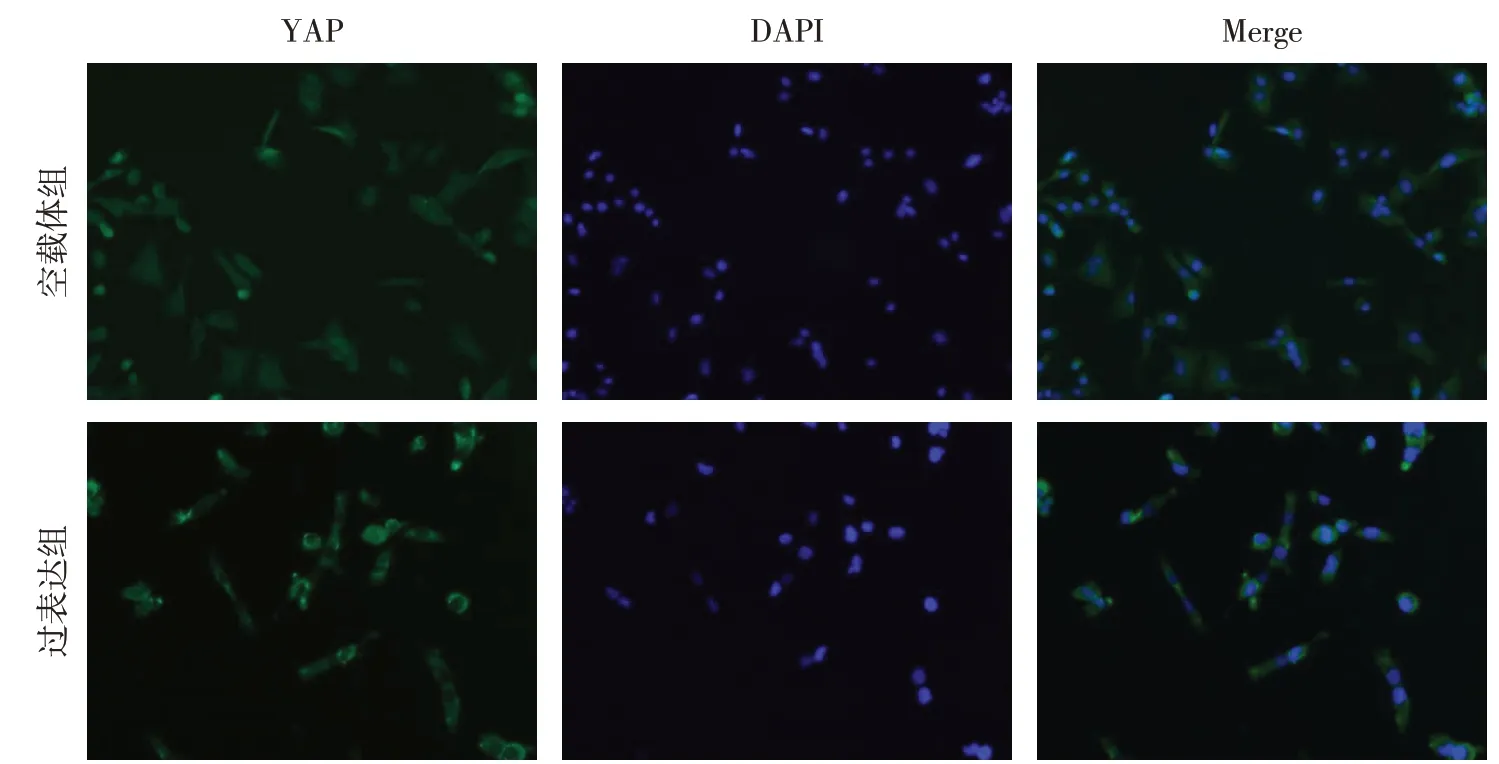
Fig.4 Effect of Calpain-2 on the distribution of YAP(immunofluorescence,×400)图4 Calpain-2对YAP蛋白分布的影响(免疫荧光染色,×400)
2.4 抑制表达YAP 可逆转Calpain-2诱导的三阴性乳腺癌细胞EMT 与过表达组相比,XMU-MP-1+过表达组N-cadherin 和Vimentin 蛋白表达下调,E-cadherin蛋白表达上调(P<0.05),见图5。
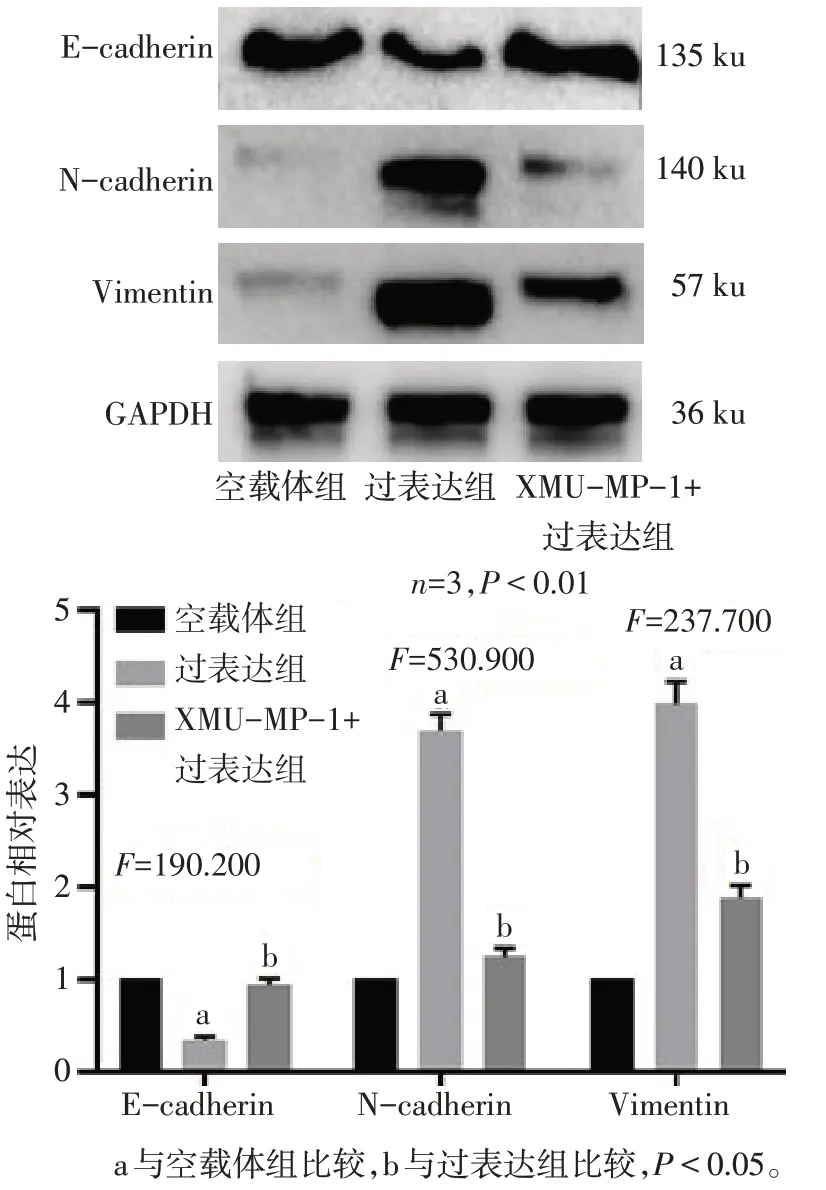
Fig.5 Role of YAP inhibition in Calpain-2 induced EMT in triple negative breast cancer cells图5 抑制YAP在Calpain-2诱导三阴性乳腺癌细胞EMT中的作用
2.5 抑制YAP 可逆转Calpain-2诱导的三阴性乳腺癌细胞PTX 抵抗 PTX 处理后,与过表达组相比,XMU-MP-1+过表达组细胞存活率降低(P<0.05),见图6A。XMU-MP-1+过表达组IC50低于过表达组(P<0.05),见图6B。
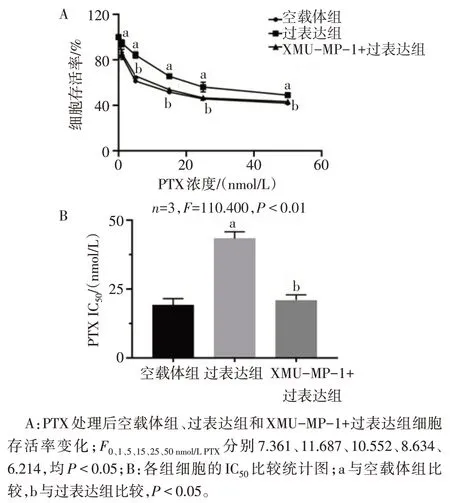
Fig.6 Inhibition of YAP in Calpain-2-induced PTX resistance in triple-negative breast cancer cells图6 抑制YAP在Calpain-2诱导的三阴性乳腺癌细胞PTX抵抗中的作用
3 讨论
药物抵抗是三阴性乳腺癌治疗失败的主要原因之一。Calpain-2 已被证实在恶性肿瘤化疗药物抵抗中发挥作用。研究显示,Calpain-2通过表皮生长因子受体(EGFR)-磷酸化蛋白激酶B(pAKT)通路增强非小细胞肺癌对PTX的化疗抵抗[8]。还有研究报道,Calpain-2 依赖性的核因子κB 抑制因子α(IκBα)降解介导了结直肠癌异种移植中的盐酸伊立替康耐药[9]。本研究发现,外源性过表达Calpain-2 可增强三阴性乳腺癌细胞抵抗PTX。这与文献报道[8]结果相类似,但Calpain-2 的相关信号机制还不清楚。上皮间质转化(EMT)是肿瘤细胞获得更强迁移和侵袭能力的重要生物学过程[10]。目前,大量研究显示,肿瘤细胞EMT 参与化疗药物抵抗。Cheng等[11]发现,G蛋白结合蛋白1通过磷酸激酶1激活的EMT 信号在非小细胞肺癌中促进厄洛替尼的抵抗。卵巢癌相关研究显示,lncRNA CHRF 通过miR-10b诱导的EMT和信号转导和转录激活因子3信号激活参与卵巢癌顺铂抗抵抗[12]。而在三阴性乳腺癌中,EMT 在介导TGF-β 诱导的抗药性中发挥重要作用[13]。本研究显示,与空载体组相比,Calpain-2 过表达组间质标志物N-cadherin和Vimentin蛋白表达上调,上皮标志物E-cadherin 蛋白表达下调,提示Calpain-2可能诱导三阴性乳腺癌细胞EMT。
YAP 是Hippo 信号通路的核心效应因子,在肿瘤生物学活动中发挥重要作用。目前,YAP 的生物学作用尚存争议,其细胞核表达存在抑癌和促癌两种观点。部分研究显示,YAP 被上游蛋白LATS1/2磷酸化后定位于细胞质并最终降解,而去磷酸后,YAP转运到胞核内发挥促癌作用[14-15]。另有研究发现,YAP细胞核表达与肿瘤细胞恶性程度呈负相关,主要发挥抑癌作用[16-17]。本研究发现,Calpain-2 过表达组MDA-MB-231 细胞YAP 磷酸化和细胞浆表达增加。为验证YAP 胞浆表达的潜在作用,本研究继续观察了XMU-MP-1 的干预作用。XMU-MP-1作为化学合成的小分子化合物,可阻断MST1/2-LATS1/2 通路磷酸化,从而诱导YAP 从细胞浆易位至细胞核内[18]。本研究结果发现,XMU-MP-1预处理可逆转Calpain-2 诱导的MDA-MB-231 细胞PTX抵抗。提示Calpain-2 诱导的YAP 胞浆表达促进了PTX抵抗,Calpain-2在MDA-MB-231细胞中起促癌作用。同时,本研究还发现XMU-MP-1预处理可逆转Calpain-2 过表达诱导的MDA-MB-231 细胞EMT,提示YAP参与介导Calpain-2诱导的三阴性乳腺癌细胞EMT。
综上,Calpain-2过表达可诱导MDA-MB-231细胞对PTX 抵抗,而该作用与YAP 介导的EMT 有关。本研究揭示了Calpain-2 诱导三阴性乳腺癌细胞化疗抵抗的作用及其机制,完善了对Calpain-2生物学功能的认识,可为临床治疗提供基础理论支持。

